高效液相色谱法测定奥沙普秦胶囊溶出度的研究
孙 荧,赵亚萍,李群林,宋丽娟
奥沙普秦(Oxaprozin)化学名为4, 5-二苯基恶唑-2-丙酸,别名苯恶丙酸和恶丙秦,是一种新的丙酸类非甾体抗炎药(NSAID),其作用机制为抑制环氧化酶,抑制前列腺素的生物合成,发挥抗炎、镇痛、解热作用[1]。临床上主要适用于类风湿关节炎、变形性关节炎、强直性脊柱炎、肩周炎、颈肩腕症侯群,也用于痛风性关节炎、外伤和手术后的镇痛[2,3]。目前,奥沙普秦肠溶片及奥沙普秦肠溶胶囊已被《中国药典》(2020年版二部)收录,奥沙普秦片已被日本橙皮书和USP39版收录,奥沙普秦胶囊未被新版药典或其他国际权威标准收录,现执行标准为2000年以前制定,该标准的溶出介质为pH 7.9的磷酸盐缓冲液,采用紫外分光光度法测定溶出度,专属性差,测定结果容易超出药典规定的范围。本研究拟采用高效液相色谱法(high performance liquid chromatography, HPLC)测定奥沙普秦胶囊溶出度[4-9],为制定该制剂的质量标准提供依据。
1 仪器与试药
1.1 仪器 Waters 2695 HPLC色谱仪;Mettler320 pH计;Mettler XP205分析天平;溶出仪SOTAXAT7。
1.2 试药 奥沙普秦对照品(50 mg,中国药品生物制品检定所,批号100353- 201602;200 mg,USP对照品99.8%,批号LotNO.GOL342),奥沙普秦胶囊(山东仁和堂有限公司,0.2 g)三批(批号:170901,180102,180103),奥沙普秦原料(山东仁和堂有限公司,批号:160603),羟甲淀粉钠,羟丙甲纤维素,硬脂酸镁。
2 方法与结果
2.1 色谱条件 色谱柱Inertsil C8(250 mm×4.6 mm;5 μm)为固定相;0.1%磷酸(pH为2.0)-乙腈(55∶45)为流动相;流速1.0 ml/min;检测波长286 nm;柱温35 ℃;进样体积20 μl。稀释溶液为0.05 mol/l磷酸二氢钾缓冲液(pH 7.4)。
2.2 检测波长 取奥沙普秦对照品和奥沙普秦胶囊内容物及辅料,分别用稀释液溶解并稀释,奥沙普秦最终浓度为12 μg/ml,在200~400 nm的波长范围内扫描。奥沙普秦对照品最大吸收波长为285.5 nm,奥沙普秦胶囊最大吸收波长为286.7 nm,辅料在该波长处无吸收,选择286 nm波长为奥沙普秦测定波长。
2.3 HPLC方法学考察
2.3.1 供试品溶液 称取奥沙普秦胶囊内容物0.2050 g,加稀释液溶解并稀释,摇匀,0.45 μl滤膜过滤,取续滤液作为供试品溶液,浓度为2 mg/ml。
2.3.2 对照品溶液 称取奥沙普秦对照品0.2002 g至100 ml容量瓶中,加稀释液适量,振摇使溶解并稀释至刻度,摇匀,作为对照品溶液。
2.3.3 系统适用性 取供试品溶液20 μl,按照预设色谱条件测定,记录色谱图(图1)。奥沙普秦与相邻杂质分离度均大于1.5,理论塔板数14 500,证明该方法系统适用性良好。

图1 奥沙普秦测定系统适用性溶液色谱图
2.3.4 检出限与定量限 取对照品溶液,加稀释液分别稀释至浓度为0.12 μg/ml、0.036 μg/ml(以奥沙普秦计),按照预设色谱条件进行测定,测得奥沙普秦的定量限为2.4 ng,最小检出量为0.72 ng。
2.3.5 重复性试验和溶液的稳定性 取对照品溶液,加稀释液稀释至浓度为15.0 μg/ml(以奥沙普秦计),进行测定,重复进样6次,根据峰面积计算相对标准偏差(relative standard deviation, RSD)为0.05%,重复性良好。取供试品溶液,加稀释液稀释浓度为12.0 μg/ml(以奥沙普秦计),于室温放置0、1、4、8、12、24 h,进行测定,RSD为0.5%,结果表明24 h内供试品溶液稳定。
2.3.6 线性及范围 取对照品溶液,精密量取0.1、0.5、1.0、3.0、5.0、7.0 ml分别稀释至50 ml进行测定,记录色谱图,在进样量4.004~280.28 μg/ml范围内,线性回归方程 y=50594x,相关系数r2=1,进样量与峰面积呈良好的线性关系。
2.3.7 回收率 按照企业处方配比制成空白辅料,分别称取相当于奥沙普秦80%、100%、120%的原料和辅料,按照预设色谱条件进行测定,计算回收率。在磷酸盐缓冲液(pH 7.4)中平均回收率为99.17%,RSD为 0.15%(表1)。
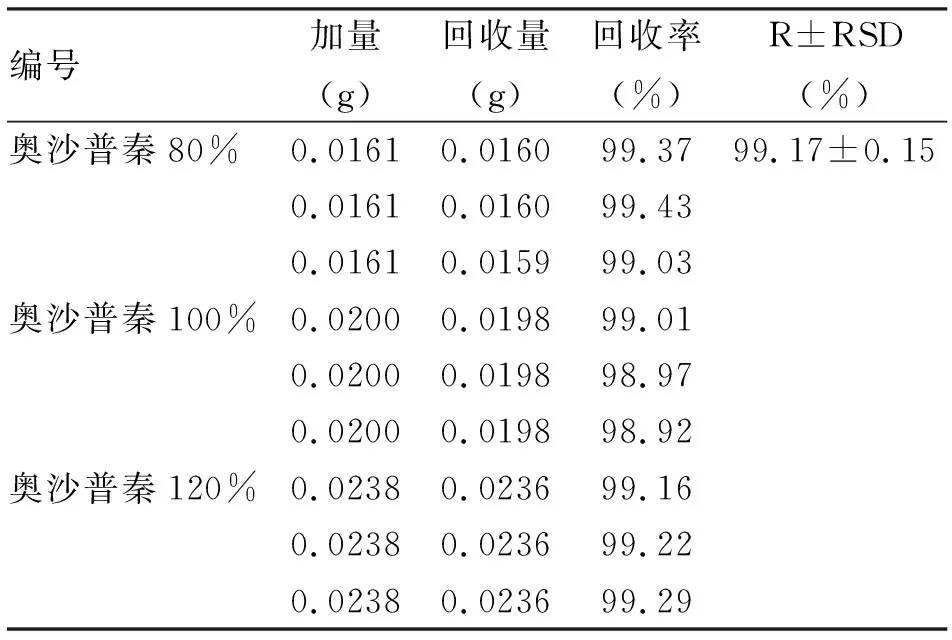
表1 奥沙普秦HPLC法回收率 (n=9)
2.4 溶出方法的研究
2.4.1 溶出介质 奥沙普秦的pKa值为4.23,为弱酸性药物。采用不同pH的溶出介质,更能反映药品在不同体内环境下的溶出释放情况[10,11]。参照标准[12,13],同时结合《普通口服固体制剂溶出曲线测定与比较指导原则》[14],选择pH 6.8磷酸盐缓冲液、pH 7.4磷酸盐缓冲液和脱气纯化水作为溶出介质。随机选取6粒奥沙普秦胶囊配制3组试液,转速为100 r/min,溶出体积1000 ml。取样时间点为0、15、30、45、60、90、120、180 min,每次取样10 ml,并及时补充等体积空白溶出介质。0.45 μm滤膜过滤,HPLC外标法测定,绘制溶出曲线(图2)。

图2 奥沙普秦胶囊在三种介质中转速为100 r/min溶出体积为1000 ml的溶出曲线图A.pH 6.8的溶出介质;B.pH7.4的溶出介质;C.水为溶出介质
实验结果显示溶出介质为pH 6.8,平均溶出量未达到80%,溶出介质pH 7.4的缓冲液在30 min溶出量大于80%;在纯化水中的溶出量小于40%;选定pH7.4磷酸盐缓冲液作为溶出介质。
2.4.2 溶出方法 参照日本橙皮书标准(桨法、50 r/min, 200 mg:45 min, 900 ml)、USP39标准(奥沙普秦片:桨法,75 r/min,45 min,1000 ml)、药典标准(篮法、100 r/min,45 min,1000 ml),选择篮法100 r/min为实验转速,以pH 7.4的缓冲液作为溶出介质,溶出体积1000 ml,温度37 ℃,绘制溶出曲线(图3)。结果显示,提高转速能有效提高溶出率,故选用篮法,100 r/min,45 min为奥沙普秦胶囊溶出方法。
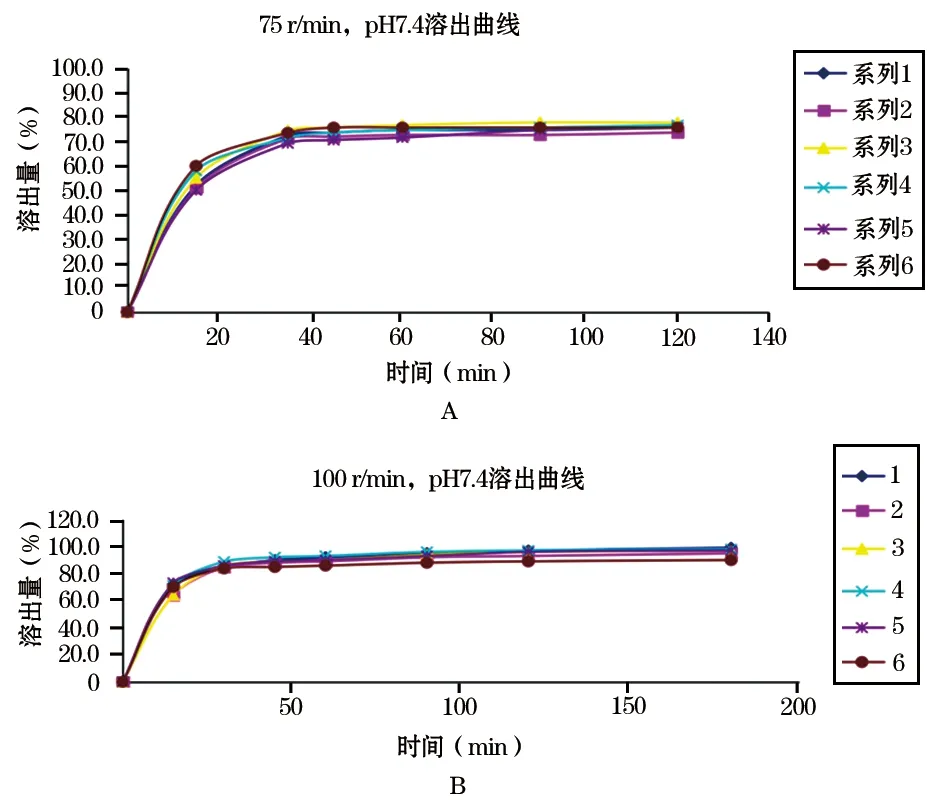
图3 奥沙普秦胶囊篮法两种转速的溶出曲线图A.转速75 r/min;B.100 r/min
2.4.3 溶出度测定结果 综合上述试验结果,最终确定溶出介质为0.05 mol/L磷酸二氢钾缓冲液(pH 7.4),篮法,转速100 r/min,溶出体积1000 ml。测定三批样品的溶出度(平行6份),平均溶出量依次为95.0%、99.0%和96.9%(表2)。

表2 HPLC法奥沙普秦胶囊溶出度测定结果 (%)
3 讨 论
HPLC法测定奥沙普秦胶囊溶出度具有较高的专属性、精密度、灵敏度及准确率及线性范围宽等优点,同时规避了紫外分光光度法检测的多步稀释过程,简化了实验步骤,具有较强的可行性。
参照国内外药典含量和有关物质的选用液相条件,考察了pH 2.5的水系和pH 2.00的水系,比较了C8、C18色谱柱等,确定了最佳的液相条件,并进行了方法学考察,发现C8色谱柱、pH 2.00的水系是合理的。
取奥沙普秦对照品和胶囊及辅料,在200~400 nm的波长范围内扫描3D图谱,结果显示在286 nm波长处有最大吸收,而辅料在该波长处无吸收,因而选择286 nm波长为奥沙普秦测定波长是合理的。
奥沙普秦胶囊现行执行标准采用溶出度测定法第1法,以pH 7.9磷酸盐缓冲液为溶出介质,转速为100 r/min,溶出时间30 min,限度为70%。USP39采用桨法,以pH7.4磷酸盐缓冲液为溶出介质,转速为75 r/min,溶出时间45 min,限度为75%。USP39收录的是奥沙普秦片,使用桨法75 r/min,本研究中胶囊剂,故仍然采用篮法,转速100 r/min,溶出介质修订为pH 7.4磷酸盐缓冲液,溶出时间修订为45 min,限度修订为75%。
根据《普通口服固体制剂溶出曲线测定与比较指导原则》,配制pH 6.8磷酸盐缓冲液、pH 7.4磷酸盐缓冲液和脱气纯化水作为溶出介质,三种方法按照预设色谱条件测定,按外标法以峰面积计算奥沙普秦在各个时间点的累积溶出量,绘制出溶出曲线,结果表明:溶出介质pH 6.8磷酸盐缓冲液优于纯化水,pH 7.4磷酸盐缓冲液优于pH 6.8,而最后选择pH 7.4磷酸盐缓冲液为溶出介质。溶出介质的pH能够影响药物的溶出,奥沙普秦为弱酸型药物,在酸性条件下,药物的解离受抑制,溶解度低。在pH 5.0~7.8范围内随着pH的升高,奥沙普秦的解离度增加,溶解度也增加[15]。
图3B溶出曲线表明,样品在45 min时,制剂中的各组分均在90%以上,且两个时间点的溶出量差在5%以内,即为溶出平台期,故选择45 min为溶出测定的取样时间,同时将取样点溶出量(>90%)减去15%作为溶出限度。溶出限度通常不少于70%~85%[14],确定奥沙普秦胶囊的溶出限度为标示量的75%。药物检测的溶出介质一般为500、900、1000 ml,参考国内外药典,奥沙普秦的处方量较大,故选择1000 ml作为溶出介质的体积。
综上所述,HPLC法专属性强,重复性好,精密度高,测定结果不受辅料及制剂工艺影响,HPLC法可以在溶出度仪取样后直接进行液相测定,简化实验步骤,可获得更宽的线性范围,减少实验误差。该方法作为奥沙普秦胶囊溶出度的有效测定方法,可为奥沙普秦胶囊制剂的质量标准提高提供重要参考。

