酶和ATP教学中常见问题释疑
祝远超

“降低化学反应活化能的酶”和“细胞的能量‘货币ATP”分别是人教2019版教材《必修1·分子与细胞》中第五章的内容。学生在学习该部分内容时经常遇到各种问题。那么,常见的问题有哪些?又该如何解答呢?
1pH影响酶促反应速度的原理
酶促反应介质的pH既可影响酶分子的结构,特别是活性部位内必需基团的解离程度和催化基团中质子供体或质子受体所需的离子化状态,也可影响底物和辅酶的解离程度,从而影响酶与底物的结合。只有在特定的pH条件下,酶、底物和辅酶的解离状态,最适宜于它们相互结合,并发生催化作用,使酶促反应速度达到最大值。
2酶的最适温度和最适pH是否是固定值酶促反应速度最大时的温度或pH称为酶的最适温度或最适pH。酶的最适温度和最适pH均不是酶的特征性常数,二者不是固定值。前者与反应所需的时间有关。酶可以在短时间内耐受较高的温度,相反,延长反应时间其最适温度便降低。后者受底物浓度、缓冲液的种类和浓度以及酶的纯度等因
素的影响。
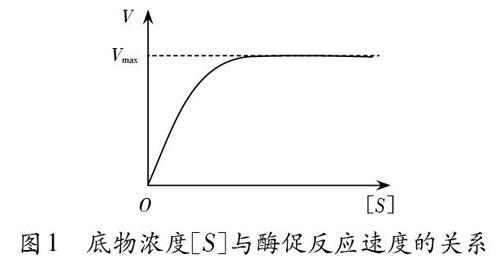
3底物浓度与酶促反应速度的关系
酶促反应速度与底物浓度的关系可用米氏方程表示:V=V max [S]/ (K m +[S]) (其中V max 为最大反应速度; [S]为底物浓度;Km为米氏常数,可近似地表示酶和底物的亲和力:Km值大,说明酶和底物的亲和力小,反之则大;V是在不同[S]时的反应速度)。
由米氏方程可知,当底物浓度很低([S]<
4酶浓度与酶促反应速度的关系曲线图和底物浓度与酶促反应速度的关系曲线图的区别
酶浓度与酶促反应速度的关系:在一定的温度和pH条件下,当底物浓度大大超过酶浓度时,酶浓度[E]与酶促反应速度呈正比关系(图2)。
其实,酶浓度和底物浓度影响酶促反应速度的实
质是相同的,一个酶分子一次只能催化一个底物分子发生反应。图1和图2不同的原因是二者的前提条件不同:图1的前提条件是酶的量一定,而图2的前提条件是底物充足([S]>>[E])。因此,图1中存在饱和现象,而图2中不存在饱和现象。
5抑制剂对酶活性影响与理化因素对酶活性影响的区别
酶的抑制剂是指能使酶的活性下降而不引起酶蛋白变性的物质。抑制剂对酶活性的影响与理化因素对酶活性的影响的不同之处主要有两点:1对酶有无选择性。抑制剂通常對酶有一定的选择性:一种抑制剂只能引起某一类或几类酶的抑制。一些理化因素如温度、pH等对酶无选择性,可影响各种酶的活性。2是否使酶失活。抑制剂虽可使酶活性降低,但不会使酶变性失活,去除抑制剂后,酶活性又可恢复。一些理化因素如高温、过酸、过碱等可破坏酶的空间结构,使酶变性失活。
6有关酶的实验设计应注意的几个问题
6.1用淀粉、蔗糖和淀粉酶验证酶的专一性时,不能用碘液作为检测试剂
碘液可与淀粉进行显色反应(淀粉遇碘液变蓝),故碘液能检测淀粉酶能否催化淀粉分解,而碘液既不能与蔗糖进行显色反应,也不能与蔗糖水解的产物进行显色反应,即用碘液无法检测淀粉酶能否催化蔗糖分解。因此,用淀粉、蔗糖和淀粉酶验证酶的专一性时,不能用碘液检测反应物是否水解了,而可用斐林试剂进行检测,斐林试剂虽不能与淀粉和蔗糖进行显色反应,但可与二者水解产生的还原糖(淀粉水解依次产生麦芽糖和葡萄糖,蔗糖水解产生葡萄糖和果糖,而麦芽糖和葡萄糖均为还原糖)发生作用,产生砖红色沉淀。
6.2用淀粉和淀粉酶探究酶的最适温度时,不能用斐林试剂来检测底物的分解情况
虽然用斐林试剂能检测淀粉的分解情况,但检测时需要水浴加热,而用淀粉和淀粉酶探究酶的最适温度时需严格控制温度(因温度是该实验的自变量)。因此,该实验不能用斐林试剂检测底物的分解情况,而应用碘液检测(碘液与淀粉进行显色反应时不需加热)。
6.3在做酶的相关实验时,不能让酶溶液与底物溶液混合后再控制实验条件
酶具有高效性,一旦酶与底物接触,就会立即发生反应。因此,在做酶的相关实验时,不能让酶溶液与底物溶液混合后再控制实验条件,而应先控制好实验条件,再让酶溶液与底物溶液混合。
7ATP是否是细胞内唯一的直接能源物质
因ATP能够直接为细胞的生命活动供能,故常称其为直接能源物质。那么,细胞内的直接能源物质只有ATP吗?当然不是。细胞内有一些游离存在的多磷酸核苷酸,它们是核酸合成的前体、重要的辅酶和能量载体。其中,最常见的就是ATP。细胞在能量传递中,除ATP作为主要的能量载体外,还有其他一些5′-三磷酸核苷和2′-脱氧核苷也参与细胞的能量传递作用,如UTP参与糖原的合成和糖醛酸代谢,GTP参与糖异生和蛋白质的合成,CTP参与磷脂的合成,ATP、CTP、UTP和GTP参与RNA的合成,dATP、dCTP、dGTP和dTTP参与DNA的合成等。由此可见,ATP并不是细胞内唯一的直接能源物质。
总之,“降低化学反应活化能的酶”和“细胞的能量‘货币——ATP”两节中疑难、易错问题较多。只有把这些问题弄清楚了,才能真正突破这两节教学的难点,使学生释疑并深刻理解相关内容,在高考中立于不败之地。

