终末期肾病并发慢性心力衰竭患者的临床特点及危险因素分析
宓洪挺,李新科,钱平安,刘洁泉
终末期肾病(ESRD)患者由于自身肾功能不可逆的衰退,只能依靠肾脏替代治疗来维持正常的新陈代谢,维系生命,ESRD 是各种慢性肾脏病持续进展后共通的最终结局。近年的一项全球大规模多中心研究显示,全球ESRD 患者数量正在快速增加,且亚洲和非洲的低收入国家数量尤为庞大。其中中国是增速尤为显著的国家之一,给医疗体系带来巨大压力[1]。对于ESRD 患者,慢性心力衰竭(CHF)导致的心源性猝死是期最常见的死亡原因,死亡率达31.8%~70%[2-3]。目前国内对于ESRD 患者并发CHF的特点和危险因素分析尚无统一标准。为此,本文收集116 例ESRD 患者的临床资料,根据其是否并发CHF分为ESRD 无CHF 组和ESRD 联合CHF 组,分析其特点及并发CHF的危险因素,旨在为临床提供相关参考。
1 资料与方法
1.1 一般资料 选择2019 年1 月至2020 年6 月宁波市第九医院、宁波市鄞州区第二医院收治的ESRD患者116例。入选患者均确诊为ESRD且未开始透析或透析龄<48 个月;符合美国肾脏基金会制定指南中终末期肾病的诊断标准(GFR≤15 ml·min-1·1.73 m-2)。CHF标准参考中国心力衰竭诊断和治疗指南2014 版,并以达到临床心力衰竭及难治性终末期心力衰竭为标准入组。按照是否合并CHF 分为ESRD 合并CHF组和ESRD 无CHF 组。
1.2 方法 收集116 例ESRD 患者的临床资料:(1)一般项目:年龄、性别、病因、住院时间等;(2)既往史:心脑血管病史、糖尿病病史、其他慢性病病史、手术史,外伤史,过敏史,有无烟酒嗜好等;(3)现病史:本次起病诱因、时间、症状、患者意识状态、并发症、终末期肾病出现的时间及透析方式等;(4)患者重要生化指标:血红蛋白、血肌酐(Scr)、尿素氮、尿酸、国际标准化比值及血小板计数;(5)检查结果:心脏超声、心脏射血分数、心电图、QT 间期、QTc,QT 间期离散度(QTd)等;(6)预后。
1.3 统计方法 采用SPSS23.0 统计软件进行统计分析。计量资料以均数±标准差表示,采用t 检验,多组比较采用方差分析;计数资料采用2检验;相关危险因素采用单因素分析和非条件逐步Logistic回归。P<0.05为差异有统计学意义。
2 结果
2.1 一般临床特点 116 例中男69 例,女47 例;平均年龄(62.9±14.2)岁。CHF发生率47.4%(55/116),男女发病率差异无统计学意义(P >0.05)。入组患者最常见的基础疾病为心血管系统高血压病(93 例,80.2%),其次为贫血(91 例,78.4%)。而虽说总例数较少,但有自身免疫性疾病基础病变(5/6,83.3%)和肝功能不全(7/11,63.6%)的患者并发CHF的概率相对更高。见表1。
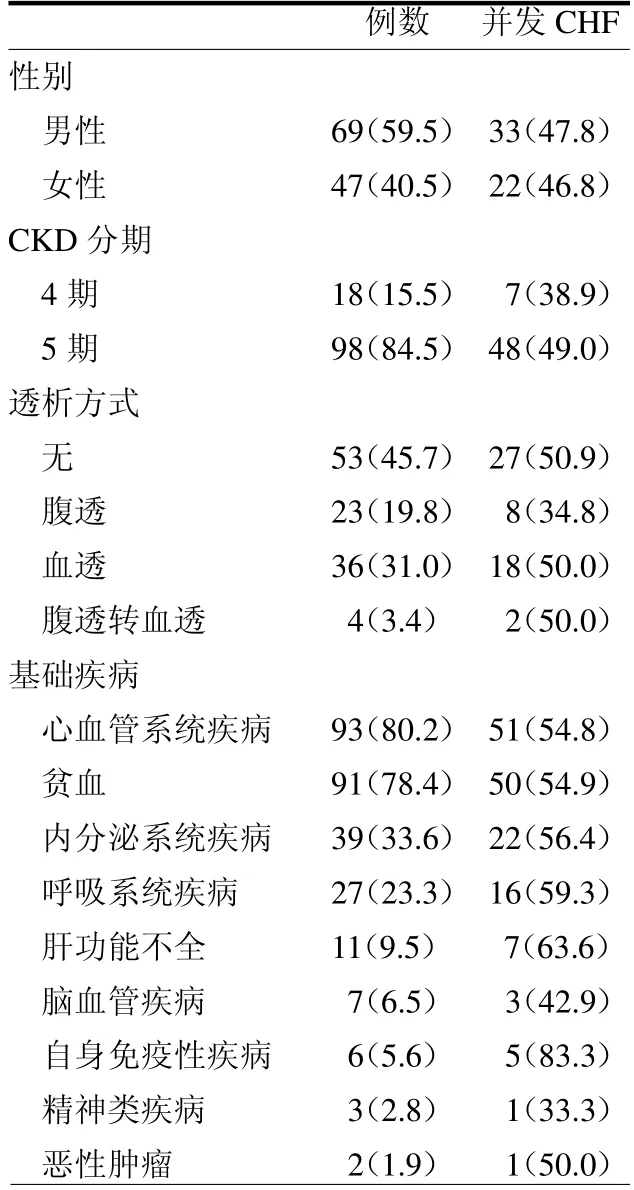
表1 一般临床特点 例(%)
2.2 ESRD 并发CHF 的危险因素ESRD 并发CHF 组与无CHF 组基础心血管疾病、基础贫血、异常心电图改变及QTd 延长等差异均有统计学意义(P <0.05),见表2。
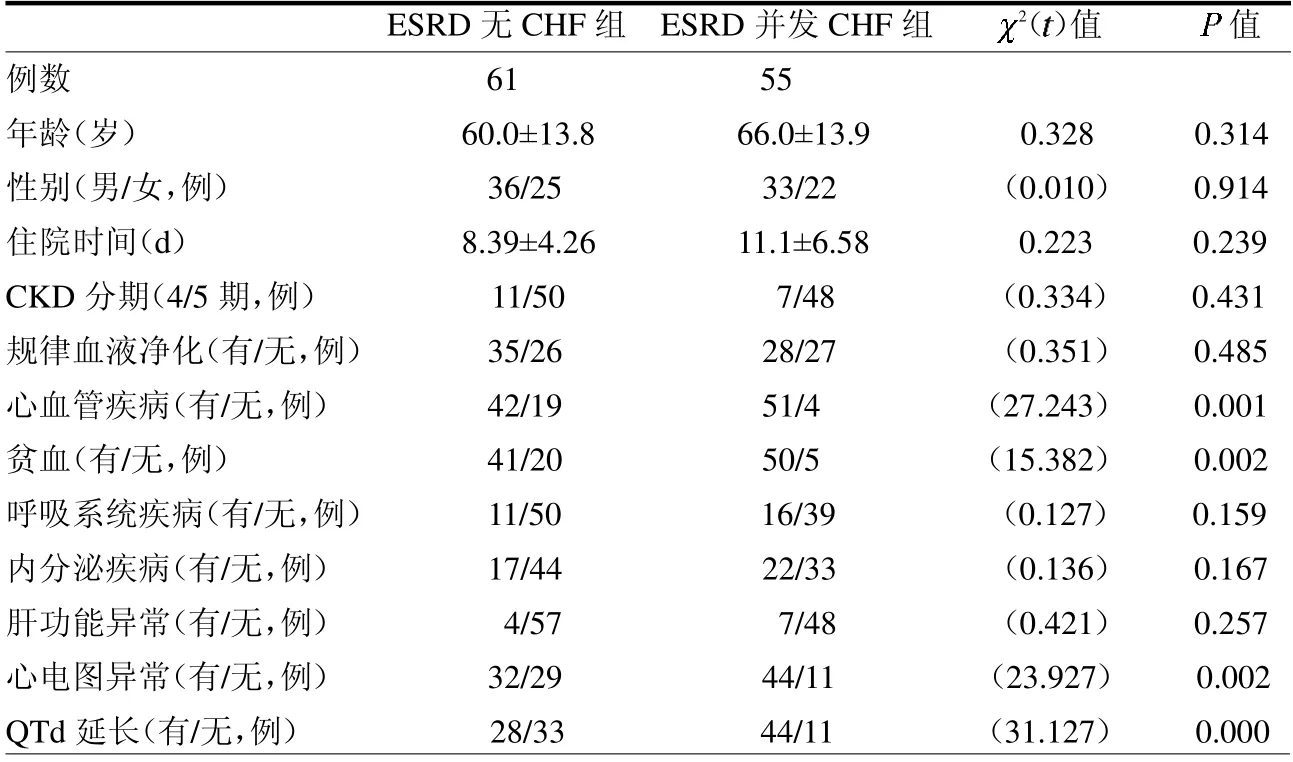
表2 ESRD 并发CHF 的单因素分析
2.3 ESRD 并发CHF 的多因素分析Logistic回归分析显示心血管系统疾病、检出异常心电图、QTd 延长和贫血为ESRD 并发CHF 危险因素(均P <0.05),见表3。
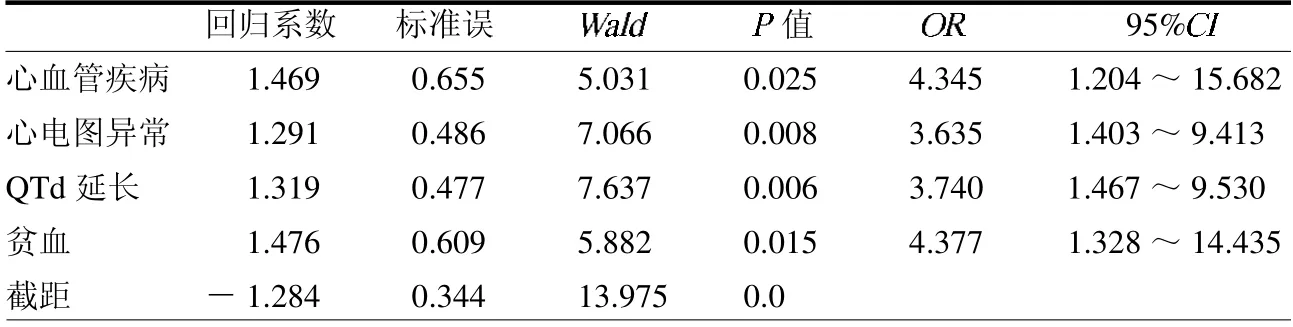
表3 终末期肾病患者并发慢性心力衰竭危险因素的多因素分析
3 讨论
3.1 ESRD 并发CHF 的临床特点 本研究中同期ESRD 住院患者CHF 发病率为47.4%,男女发病率无明显差异。患者除ESRD 外,具有基础心血管疾病最为常见,包括动脉硬化及心肌病,其次为贫血(多数为肾性贫血),内分泌系统疾病(多数为糖尿病)。但相比较而言,具有呼吸系统疾病、肝功能不全及自身免疫系统疾病的患者,并发CHF的概率更高,需在临床上加以注意。多因素Logistic回归显示:具有心血管系统疾病、检出异常心电图、QTd 延长和贫血为终末期肾病患者并发心力衰竭的危险因素。
3.2 ESRD 并发CHF 的原因 国外流行病学统计数据显示,ESRD 患者CHF发生率相比较普通人群明显升高,其心源性死亡的风险是普通人群的10~20倍。慢性肾脏病患者早期可以无任何症状,或仅有少量轻度不适,但进入终末期后,患者其体内各器官系统受贫血、酸中毒、毒性物质、肾性高血压等作用,可出现心肌受损或心力衰竭。其导致CHF的主要的病理改变包括心室重构、动脉粥样硬化、血管钙化等,最终危及患者生命[4]。下文将对本研究中得出的危险因素一一加以分析。
3.2.1 心血管系统疾病 本研究结果显示,具有心血管系统疾病是ESRD 患者并发CHF 的重要危险因素和直接原因。ESRD 患者所具有的基础心血管系统疾病大致可分为动脉血管疾病和心肌疾病。动脉血管疾病主要为动脉粥样硬化,所有患者均通过颈动脉B超检查评估颈动脉硬化情况,而经济条件允许或有高风险患者,则继续行胸部CT 和/或冠脉造影进一步明确患者是否具有冠状动脉粥样硬化情况。而检查结果也显示,患者初步检查发现一处血管硬化的同时,继续检查往往会发现全身多处血管硬化。相关研究显示,ESRD 患者往往同时具有颈动脉粥样硬化和冠状动脉粥样硬化,两者具有明显的相关性,且动脉血管粥样硬化是ESRD患者发生心血管事件的直接危险因素。ESRD 患者是动脉血管硬化的高危人群,其发病原因主要是随着患者慢性肾脏病的进展,肾功能下降,患者的钙磷代谢失衡、继发性甲状旁腺功能亢进等疾病也在不断加重,以至于慢性肾脏病患者心血管钙化的发生率逐渐增高[5]。除此之外,ESRD 患者普遍存在脂代谢紊乱,容易导致脂质沉积,全身性动脉血管粥样硬化。最后,ESRD 患者多数还存在高同型半腕氨酸血症、血清脂联素下降,以及一氧化氮-活性氮(NO-ROS)失衡和尿毒症毒素引发的炎症反应等。以上疾病都可以一定程度上引起患者血管内皮细胞损伤、引起动脉管壁结构和功能的变化,导致动脉粥样硬化,继而发生CHF[6]。心肌疾病可以分为尿毒症性心肌病和扩张性心肌病两类。ESRD 患者体内蓄积各种尿毒症毒素,引起心血管系统的毒性作用,并可直接导致心肌细胞受损,心肌细胞肥大甚至纤维化[7]。且ESRD 患者一般少尿甚至无尿,虽可通过控制饮水或透析等方式进行容量控制,但多数患者仍存在顽固的容量负荷过重的问题,引起心肌重塑、心脏形态学改变。与此同时,ESRD 患者的顽固性高血压也是其发生心肌疾病的重要原因。高血压治疗的重要原则是维持患者血压平稳正常,但ESRD患者,尤其是进行透析治疗的ESRD 患者,这一目标却较难达到。如此,ESRD 患者的心脏受肾脏功能障碍的影响,不断恶化,最终发展为CHF[8]。
3.2.2 异常心电图 本研究结果显示检出异常心电图是ESRD 患者并发CHF的危险因素(OR=3.635)。本组研究中其主要表现为具有慢性心律失常、ST-T 改变、QTd 延长、传导阻滞、左心室高电压及早搏等。ESRD 患者自身血液净化能力显著下降,导致电解质紊乱和多种尿毒症毒素蓄积,影响患者的心脏传导系统,表现出各类心电图异常。透析前后因尿毒症代谢产物水平变化,患者亦会表现出相应的心电变化[9]。相关研究显示ESRD 患者随着病程越长,肾功能逐步恶化,患者心功能不全亦逐渐加重,同时心电图异常检出率逐步增高,相关结果呈正相关,与本研究结论相符[10]。
3.2.3 QTd延长 本研究结果显示QTd延长亦是危险因素之一(OR=3.740),略高于检出异常心电图(OR=3.635),或具有更高的预警意义。临床上常使用QTd作为评价心室复极的指标,但由于心电图各导联QTd 本身即存在差异性,单纯以QTd 改变作为评价标准似乎并不够精确。相关动物实验研究显示,通过测量体表心电图各导联间QTd,可以更好的反映受试动物心室肌复极不一致性和电不稳定性的区域性变化程度,对恶性心律失常具有更大的预测意义。对于ESRD 患者,QTd 除受心率影响外,更易受心脏外因素的影响。心肌细胞复极过程中对局部代谢产物的浓度比较敏感,如伴随心肌缺血产生缺氧、酸中毒和细胞外K+升高、儿茶酚胺及乙酰胆碱等尿毒症毒性物质堆积均有可能改变心肌细胞的电生理特性,表现为QTd 延长[11]。国内研究显示在冠心病患者中QTd 改变,尤其是QTd 延长是患者因心律失常死亡的独立危险因素,对QTd 进行分析有利于预测不良心血管事件,以及慢性心力衰竭的发生[12]。常规检测心电图的同时,对ESRD 患者QTd 加以计算并评估,可以更好的预测患者并发慢性心力衰竭的可能性。
3.2.4 贫血 本组ESRD患者本身合并贫血的概率较高(91 例,78.4%),与相关研究[13]相符。且贫血是ESRD 患者并发CHF 的4 个危险因素中暴露风险最高的一个(OR=4.377)。患者在贫血状态下,血液携氧能力下降,间接导致心脏负荷增加,左心高排。上述症状如长期存在可导致心脏过度代偿,引起高动力学状态的一系列表现,乃至于左心室肥大和/或左心扩张,导致CHF,是导致患者病死的重要危险因素[14]。而一项包括7项随机对照研究的Meta分析更显示,通过适当纠正贫血,可有效改善ESRD 预后,降低患者的住院率,减轻患者负担[15]。由此可知,贫血对于ESRD 患者或不可避免,但注意监测患者的血红蛋白水平,及时并适当的纠正贫血,有助于降低患者CHF 的发生率,改善预后。
3.3 总结 ESRD 患者并发CHF 后预后不佳。具有心血管系统疾病、检出异常心电图、QTd 延长和贫血是ESRD 患者并发CHF 的危险因素。充分了解患者相关特点,运用血常规、心电图和超声等检查,有助于早期识别高风险患者,进而早期干预,通过调脂清除毒素、改善贫血等综合手段可延缓疾病进程,提高ESRD 患者生活质量,改善预后等。

