腰椎管内占位肠源性囊肿1例报告并文献复习
赵庆禹,卢海平,马亚萍,伍富俊,肖殷,王信
(1.遵义医科大学附属医院骨科,贵州 遵义 563000;2.澳洲昆士兰科技大学骨组织工程,澳洲 布里斯班 4059)
肠源性囊肿是一种临床上少见的先天性发育畸形疾病,1958年Harriman用它来描述神经管原肠、内胚层或呼吸道囊肿[1]。椎管内肠源性囊肿占椎管内肿瘤的0.7%~1.3%,可见于任何年龄,多发于青少年,多见于男性,男女比例约为2︰1[2]。多数患者无明显典型的临床表现,少部分患者可表现为颈肩背部疼痛或不适,疼痛机制可能是由于神经、脊髓受压出现运动、感觉、自主神经功能障碍等[3]。椎管内的肠源性囊肿可以发生在脊髓的任何层面,最常见于下颈椎和上胸椎,极少发生在腰椎和骶椎[4]。本病的诊断主要依赖于影像学检查,尤其是磁共振成像(magnetic resonance imaging,MRI)检查[5]。2012年1月17日遵义医科大学附属医院收治1例肠源性囊肿患者,为青年男性,符合发病年龄段,结合临床表现、影像学和病理检查诊断为L1~2椎管内占位肠源性囊肿,行经后路L1及L2全椎板切开、占位物摘除、横突及椎板间植骨融合钉棒系统内固定术,术后疗效满意。本研究结合文献探讨该疾病的病因、临床诊断和治疗,现报告如下。
1 病例资料
1.1 术前诊断 20岁男性患者,腰背部疼痛伴左大腿疼痛2个多月。2个多月前无明显诱因出现腰背部隐痛,夜间静息性疼痛,平卧休息疼痛加重,下床活动后疼痛缓解,咳嗽及喷嚏时疼痛无明显加重,无间隙性跛行,无下肢麻木,无伴鞍区感觉减退及大小便困难,无伴畏寒、发热,无低热、盗汗。就诊外院考虑为腰肌劳损,予口服止痛药、休息等保守治疗后症状无明显缓解。3周后疼痛较之前加重,向左大腿前外侧放射,时有大便稍费力,外院考虑为腰椎间盘突出症,予以保守治疗,症状无缓解。为求进一步诊治就诊我院,门诊行腰椎MRI检查后,遂以“腰椎管内占位”为诊断收入我院脊柱外科,完善相关检查。患者脊柱无明显畸形,腰椎生理曲线变浅,腰部皮肤无红肿及窦道;L5和S1椎轻度压痛和叩击痛,压痛未向远端肢体放射,竖棘肌无紧张,腰椎活动不受限;骨盆无畸形,分离试验及挤压试验均阴性,鞍区痛、温、触觉无明显异常,肛门括约肌稍乏力,双侧提睾反射稍减弱,二便尚未见明显异常。双下肢无明显畸形,双髋关节活动无明显受限,双侧髂腰肌、股四头肌、胫前肌、腓肠肌、趾屈肌、踇趾背伸肌肌力5级;双下肢皮肤感觉无减退,双侧膝腱反射、跟腱反射存在;双下肢直腿抬高试验(30°)及加强试验阴性;双侧Thomas征、“4”字征及双侧股神经牵拉试验阴性;双侧髌及踝阵挛未引出,双侧Oppenheim征(-),Babinski征(±)。影像学检查:术前腰椎正侧位X线示L5椎脊柱裂;腰椎MRI示L2椎体后缘见结节状低信号,L1~2椎间盘T2W1信号为低信号并向后突出,硬膜囊受压变形;L1~2椎退行性变,L2椎水平椎管内脊髓后部占位性病变。初步诊断:(1)L1~2椎管内占位:考虑为神经鞘膜瘤;(2)马尾神经压迫症;(3)L1~2椎间盘突出;(4)L5脊柱裂(见图1~2)。

图1 术前X线片示L5、S1脊柱裂 图2 术前MRI示L1~2椎退行性变,L2椎水平椎管内脊髓后部占位性病变 图3 术中取出物病理学检查结果(HE,×100)
1.2 手术方法 完善术前准备,在全麻下行“后路L1、L2全椎板切开、占位物摘除、横突及椎板间植骨融合钉棒系统内固定术”。术中见L1~2椎间水平局部硬膜囊稍向后突起,切开硬膜囊见大小约35 mm×20 mm×22 mm等T1长T2信号囊实性肿块位于蛛网膜下,病变上下方蛛网膜下腔增宽,病变右侧终丝及马尾神经见结节状长T2信号肿物,小心切开蛛网膜见脊髓圆锥下方有上下两个相连的类圆形肿物。上方肿物直径约3 cm,边界清楚、光滑,与神经等组织无明显黏连,呈囊性,内含透明黏液;下方肿物直径约1.5 cm,呈实性,内有多个囊性腔隙,小囊肿之间有肿瘤样组织,与周围脊髓圆锥、马尾神经等神经组织黏连紧密,界限不清,有部分神经束穿行其间,分离切除困难。故小心分离并切除大部分囊壁组织并留取标本,少部分囊壁组织因与神经组织紧密黏连,分界不清,难以完全切除。查无活动性出血后行“横突及椎板间植骨融合钉棒系统内固定术”。术中所取标本送病理检查。手术顺利,术中生命体征平稳。
1.3 术后处理 术后予以抗生素使用3 d,卧床休息1个月,下床活动时佩戴胸腰部支具及扶拐保护。手术切除的腰椎管内肿物样本病理报告为“见囊壁内单层或假复层柱状上皮细胞衬于基底膜”,符合L1~2椎管内肠源性囊肿(见图3)。术后行X线和CT检查示L1~3之间内固定在位,L5、S1脊柱裂。出院诊断:(1)L1~2椎管内占位,为肠源性囊肿;(2)马尾神经压迫症;(3)L1~2椎间盘突出;(4)L5脊柱裂。出院随访6个月、1年、2年,临床疗效显著,术前出现的腰背部疼痛及左大腿疼痛症状明显减轻至逐渐消失,恢复良好,未发现任何术后并发症(见图4)。
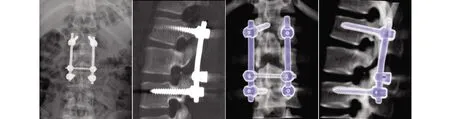
图4 术后1周X线片及CT示L1~3内固定在位
2 讨 论
肠源性囊肿是临床少见的与内胚层发育障碍相关的先天性囊性病变。发病机制不清,多认为是胚胎发育第3周神经管与原肠分离障碍残留的前肠或呼吸芽等内胚层组织[6]。胚胎发育早期,原肠与神经管在正常分离期间受到某些因素影响导致分离障碍,部分组织残留并嵌入脊索和外胚层之间;在内胚层的发育过程中,部分内胚层的正常发育也会受到某些因素影响而出现异常,向后移位、嵌入神经管内,最终形成囊肿[7]。更多发病机理有待进一步探索。肠源性囊肿多数发生于中轴处,以颈髓和上胸髓腹侧多见,腰骶髓少见,常伴先天性脊柱畸形,如脊柱裂、蝴蝶椎、半椎体、皮肤瘘等[8]。本病例伴L5脊柱裂,符合其他文献报道的该病特征。
目前多采用影像学检查诊断椎管内肠源性囊肿。MRI因能清晰显示脊柱中发生病变范围、病变大小、形状和部位及病变与脊髓的关系,可为手术方案制定、手术方式选择和预后判断等提供依据,是首选诊断方法[9-10]。肠源性囊肿的MRI显示病灶边缘光滑,长轴与脊髓平行,T1WI信号呈等、高于脑脊液信号,若囊液内含有较多蛋白质或陈旧性出血,则呈等或高信号;T2WI信号呈等或低于脑脊液信号,脊髓明显受压变形,部分可于横断面或矢状位见囊肿嵌入髓内,称“脊髓嵌入征”,是其特征性表现[11-13]。本研究病例MRI表现为L2椎体后缘见结节状低信号,L1~2椎间盘T2W1信号为低信号并向后突出,硬膜囊受压变形,与文献报道相符。
病理学检查是确诊肠源性囊肿最可靠的方法[13-14]。肠源性囊肿镜下表现为:囊壁由单层扁平上皮、柱状上皮或分泌粘液的杯状细胞构成,囊肿外层为纤维结缔组织。有学者根据囊肿壁组织细胞结构不同,将其分为三型,Ⅰ型:由单层、假复层立方、柱状上皮构成与胃肠上皮及呼吸道上皮类似囊壁;Ⅱ型:囊壁除类似Ⅰ型组织外,还有粘液腺、平滑肌、横纹肌、脂肪、软骨等组织;Ⅲ型:除以上组织成分外,还包括有室管膜及神经胶质组织成分。80%以上囊肿为Ⅰ型,是最常见的肠源性囊肿。本研究病例属于Ⅰ型肠源性囊肿[12,15]。
肠源性囊肿的临床表现通常不典型,其症状与发生部位相关,主要为压迫症状和囊液渗漏导致的刺激症状,表现为囊肿所在部位神经根性疼痛伴运动障碍。应与囊性神经鞘瘤、神经纤维瘤、脊膜瘤、表皮样囊肿、皮样囊肿、畸胎瘤、脂肪瘤、蛛网膜囊肿、脊髓空洞、脊髓血管网织细胞瘤等髓外椎管内疾病相鉴别[7]。如神经鞘瘤表现为包膜完整的实心结节或囊块,多数随神经走行方向,可跨椎管内外呈“哑铃”状,信号不均匀,可见囊变坏死,无“脊髓嵌入征”,增强后囊壁及实性部分强化,不合并脊柱畸形[11]。本病例研究即可排除初步诊断的“L1~2椎管内占位:疑神经鞘膜瘤”。
肠源性囊肿在脊髓中对颈和胸段的影响最大,在腰椎管中罕见,对已有神经功能障碍者或在出现并发症前,应及早诊断和治疗。外科手术切除是最佳治疗方法,可较好改善术前临床体征和解除神经受压症状[5,16-17]。手术切除过程中可完全切除病变部分,但不是所有病例适用完全切除。导致难以完全切除的因素包括有限的接触通道、骨异常、脊髓或髓内囊肿黏连[18-19]。完全切除可能造成永久性神经损伤,此时选择非完全切除是适当的治疗手段[20-21],尽管非完全切除会增加复发可能性[22],可对部分残余囊壁使用小功率电凝处理,使其内壁变性、坏死、分泌黏液功能丧失,以降低复发率[23]。本研究案例由于部分囊壁组织与神经组织黏连紧密,分界不清,故选择非完全切除。还需进一步探索该病的更佳治疗方法。
综上所述,肠源性囊肿的病因不十分清楚,临床症状不典型,MRI是首选诊断方法,病理学检查是最可靠的确诊方法,对已出现神经症状的患者应及早手术治疗,积极完善术前准备,术中病变组织行病理学检查。本病例行后路L1及L2全椎板切开、占位物摘除、横突及椎板间植骨融合钉棒系统内固定术治疗椎管内占位肠源性囊肿,术后患者疼痛明显减轻,随访患者恢复良好,治疗效果满意。

