欧洲千里光CYCLOIDEA(CYC)类SvRAY1基因的克隆及功能分析
陈柯俐,朴春兰,郝燕敏,冯丽君,周佳圆,栾思楠,刘乐乐,李菲菲,袁思明,崔敏龙
(1. 浙江农林大学 林业与生物技术学院,浙江 杭州 311300;2. 浙江农林大学 园艺科学学院,浙江 杭州311300)
被子植物因拥有精密的花器官及丰富多样的花型为人们普遍观赏,其发育过程由高度精密的调控网络所决定,转录因子在其中有重要的作用[1-2]。控制花发育的转录因子主要为TCP家族转录因子[3-4],该家族转录因子以玉米Zea mays的TEOSINTE BRANCHED1(TB1)、金鱼草Antirrhinum majus的CYCLOIDEA(CYC)及水稻Oryza sativa的PROLIFERATING CELL FACTORS1和PROLIFERATING CELL FACTORS2(PCF1和PCF2)基因的首字母命名,通过细胞增殖影响分生组织的生长而控制植物花对称性或分蘖[5-8]。TCP家族蛋白包含有1个高度保守的 TCP结构域,即碱性螺旋-环-螺旋(basic Helix-Loop-Helix,bHLH)结构,该结构与DNA结合位点及蛋白的二聚化有关[9]。根据bHLH结构可将TCP家族分为2个亚家族:PCF(又称TCP-P或I类)和CYC/TB1(又称TCP-C或Ⅱ类)[10]。CYC/TB1类蛋白由CINCINNATA(CIN)和ECE进化枝组成,ECE谱系经历了2次复制事件,产生CYC1、CYC2和CYC3进化枝,而CYC2进化枝参与花对称性的建立。菊科Asteraceae植物进化成功的原因可归功于其精美的花序结构[11],使其看起来像一朵单独的花,实则由数十朵乃至百朵舌状花及筒状花构成。花序外缘为舌状花(ray floret),两侧对称、无雄蕊、艳丽多彩,主要用来吸引虫媒授粉。花序内侧为筒状花(disc floret),辐射对称,一般含有雄蕊或者兼具雌雄蕊,主要用来完成世代繁殖。菊科种类及数目繁多,具有很高的经济与观赏价值。对于菊科而言,头状花序能够产生不同类型花是其繁衍的主要创新之处。对菊科中CYC类基因的分析发现:基因的重复和分支是生物体进化决定过程中常见的现象,是其独特性和进化成功的主要因素。欧洲千里光Senecio vulgaris为菊科植物,分布于世界各地,其生长周期短(90 d)、繁殖能力强、易于生长,花序具有天然多态性,分为辐射对称与非辐射对称。该天然多态性由CYC2类RAY基因座所控制。RAY基因的表达通过调控舌状花的形态最终影响了欧洲千里光的花对称性,即辐射对称与非辐射对称之间的过渡或转化[12],然而,人们对于这种形态上的变化原因并未做出深入探究。本研究在欧洲千里光RAY1基因研究的基础上,克隆SvRAY基因并分析其过表达表型影响因素,旨在为菊科花序发育的分子机制提供参考。
1 材料与方法
1.1 实验材料
以欧洲千里光种子为实验材料,在25 ℃、光周期16 h光/8 h暗条件下被种植于人工气候室。
1.2 SvRAY1基因的克隆及其超表达载体的构建
下载欧洲千里光RAY1基因序列(FJ356698.1)并在美国国家生物信息中心(NCBI)进行引物设计比对(Primer-BLAST),利用NEBcutter V 2.0 (http://nc2.neb.com/NEBcutter2/)网站分析其潜在酶切位点;添加BamHⅠ、SacⅠ等酶切位点及保护碱基,引物由杭州有康生物有限公司合成(表1)。以欧洲千里光cDNA序列为模板,克隆获得SvRAY1基因目的片段。PCR反应程序:97 ℃预变性3 min,95 ℃变性1 min,60 ℃退火1 min,72 ℃延伸2 min,72 ℃总延伸10 min,35个循环;目的片段纯化回收后连接至pEASY-T1Simple载体(全式金),并转化大肠埃希菌Escherichia coli感受态DH5α菌株中(杭州有康生物公司),根据蓝白斑筛选及菌落PCR实验后挑取菌落摇菌送至杭州有康生物公司测序。
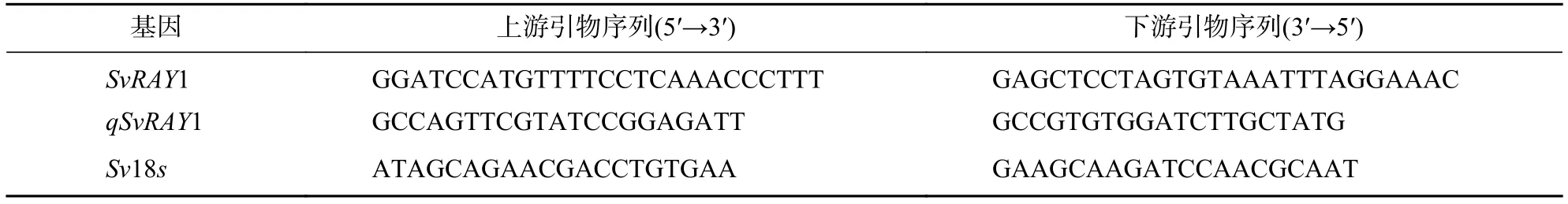
表1 本研究中SvRAY1基因克隆和用于 qRT-PCR 的引物序列Table 1 Primers were used for cloning of SvRAY1 and qRT-PCR analysis in this study
提取测序正确菌落质粒,进行BamHⅠ和SacⅠ限制性内切酶的单双酶酶切检验,并对重组质粒及超表达载体pBI121进行双酶切反应,将目的片段与载体片段进行酶连,转化大肠埃希菌DH5α后,挑取单克隆进行菌落PCR。挑选阳性克隆子并摇菌提取质粒,进行单、双酶切检验酶连正确后转化到农杆菌Agrobacterium tumefaciensGV3101,获得超表达载体(图1)。
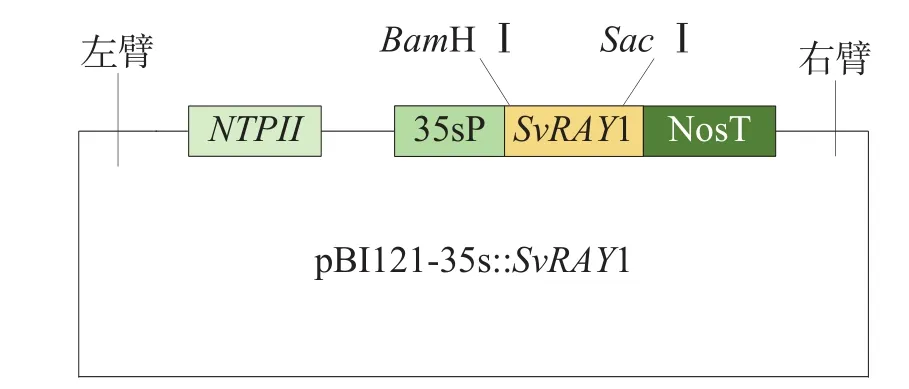
图1 SvRAY1基因超表达载体示意图Figure 1 Schematic diagram of overexpression vector of SvRAY1
1.3 SvRAY1 基因生物信息学分析
将克隆的SvRAY1基序在NCBI网站进行Blastx检索,下载各物种CYC基因氨基酸FASTA格式文件;利用Clustal X及MEGA 10软件,采用最大似然法,步长设置为1 000,进行多序列比对及系统发育树的构建,使用GeneDoc软件及iTOL在线工具(https://itol.embl.de/login.cgi)[13]显示比对结果及进化树美化修饰;利用MEME网站(http://memesuite.org/tools/meme)[14]、SOPAM在线软件 (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)[15]、SWISS-MODEL 在线建模工具(http://swissmodel.expasy.org/)[16]分析SvRAY1基序氨基酸丰度,预测氨基酸序列二级结构组分、比例及其分布信息、蛋白质的三维结构。
1.4 SvRAY1 基因实时荧光定量表达分析
研究欧洲千里光生长的2个阶段:营养生殖过渡阶段-花序(cap)和生殖发育阶段(S1~S4) (图2)的SvRAY1基因的表达情况。根据实时荧光定量PCR反应(qPCR)引物设计原则设计特异引物qSvRAY1F、qSvRAY1R及内参基因引物Sv18sF、Sv18sR。参照RNA提取试剂盒RNAeasy PLANT Mini Kit(QIAGEN)、cDNA合成试剂盒EasyScriptFirst-strand cDNA Synthesis SuperMix (全式金)说明书,使用Eva Green荧光染料 (Biotium)、premix Ex Taq HotStart Version (Takara)提取RNA并合成cDNA后于实时荧光定量PCR仪(Bio-Rad, CFX ConneaTM Real-T)上进行反应。反应体系:95 ℃预变性10 min,95 ℃ 变性 10 s,60 ℃ 退火 15 s,72 ℃ 延伸 25 s,共进行45个循环。试验设置3个重复反应,并采用法计算各部位、阶段SvRAY1基因的相对表达量。

图2 欧洲千里光头状花序的不同发育阶段形态比较Figure 2 Comparison of capitulum form of different developmental stages of S. vulgaris
1.5 SvRAY1 转基因植株鉴定及形态学观察分析
利用植物组织培养技术经卡那霉素筛选获得SvRAY1转基因抗性植株[12]。利用改良的SDS法[加入质量分数为2%聚乙烯吡咯烷酮(PVP)处理,防止酚类物质氧化抑制PCR反应]提取抗性植株基因组DNA后,使用卡那霉素引物及特异性引物进行PCR检测后获得阳性苗。观察并统计野生型欧洲千里光及阳性苗舌状花长宽、筒状花与舌状花数目之比等,并采用t检验进行数据整理。使用扫描电子显微镜观察野生型及SvRAY1转基因植株的舌状花腹侧表皮细胞,分析其细胞形态。
1.6 数据分析
使用Excel 2016、SPSS 25.0等软件进行显著性分析及图表制作。使用SPSS 25.0软件,分别输入野生型及转基因舌状花的相关数据,通过成对样本t检验,分析比较平均值,默认置信区间为95%。检验方差齐次性,进一步进行t检验,查看双尾显著性值,判断野生型与转基因植株间方差显著性。
2 结果与分析
2.1 SvRAY1 基序生物信息学分析
将克隆出的SvRAY1基序在NCBI进行Blastx分析,对其中与SvRAY1基因编码氨基酸序列相似性较高的序列进行筛选,并将筛选出来的翠菊Callistephus chinensis CcCYC2d、橙舌狗舌草Tephroseris rufa TrCYC2d、杭白菊Chrysanthemum×morifoliumCmCYC2d、甘菊Chrysanthemum lavandulifoliumClCYC2d、非洲菊Gerbera hybridaGhCYC2c和GhCYC5等基因氨基酸进行系统进化树的构建(图3)。系统发育进化树表明:SvRAY1与CcCYC2d、TrCYC2d、HaCYC2d、DvCYC2d等处于同一分支,亲缘关系近。
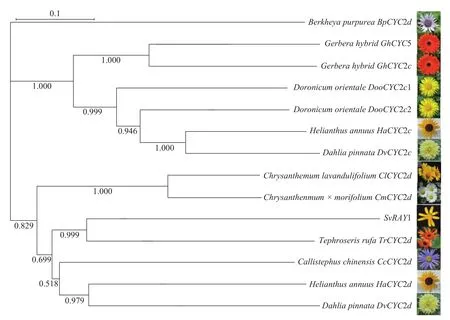
图3 SvRAY1系统发育进化树分析Figure 3 SvRAY1 phylogenetic tree analysis
SvRAY1氨基酸序列空间二级结构(图4)表明:无规卷曲所占比例52.89%,超过总结构元件比例的一半,其次分别为α螺旋、延长链及β转角,所占比例分别为33.13%、10.64%、3.34%。其蛋白结构模型与经典金鱼草花对称AmCYC蛋白结构模型相似,有明显的折叠层次,结构单元主要为α螺旋及无规卷曲,且它们的蛋白结构中有一活性部位,推测SvRAY1基因具有AmCYC基因的功能保守性,即可能参与调控花发育过程中花对称性的形成。
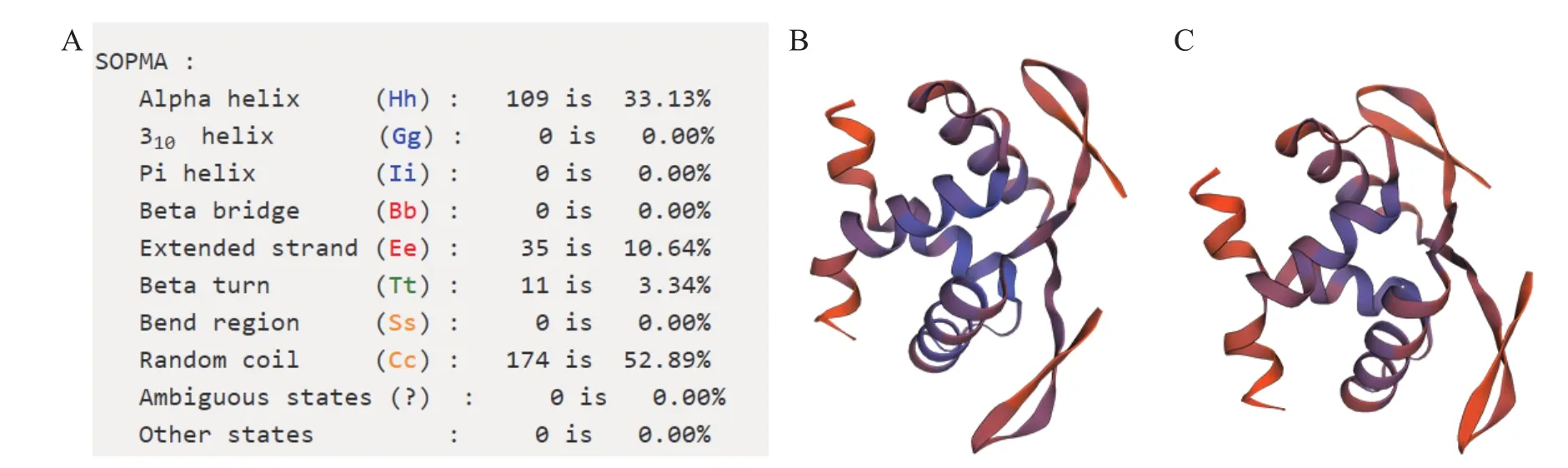
图4 SvRAY1氨基酸序列二级、三级结构组分及其比例分布Figure 4 Secondary and tertiary structure components of SvRAY1 amino acid sequence and their ratios
2.2 SvRAY1 基因不同发育阶段表达分析
qRT-PCR反应结果表明(图5):SvRAY1基因在各阶段均有表达, S1~S4阶段相对表达量均比花序阶段高,且S3、S4阶段舌状花(S3R、S4R)中相对表达量均高于筒状花(S3T、S4T),表明SvRAY1基因主要在舌状花部位中表达,且舌状花的相对表达量最高,故推测其过表达可能影响舌状花发育。
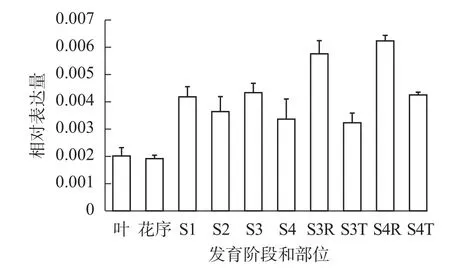
图5 SvRAY1基因在欧洲千里光不同发育时期和不同部位的相对表达分析Figure 5 Expression analysis of SvRAY1 in different floral development stages and tissues of wild type S. vulgaris by qRT-PCR
2.3 SvRAY1 转基因植株表型观察
分别选取6株野生型及经分子鉴定的SvRAY1超表达载体植株,每株随机选取5个,共30个头状花序进行形态学统计(舌状花长宽、筒状花与舌状花数目之比),并进行成对样本t检验分析(表2)。结果表明:与野生型相比,SvRAY1转基因植株舌状花长度较野生型不同程度变短,各转基因株系宽度均显著变宽(P<0.05),舌状花与筒状花数目之比也有显著差异。
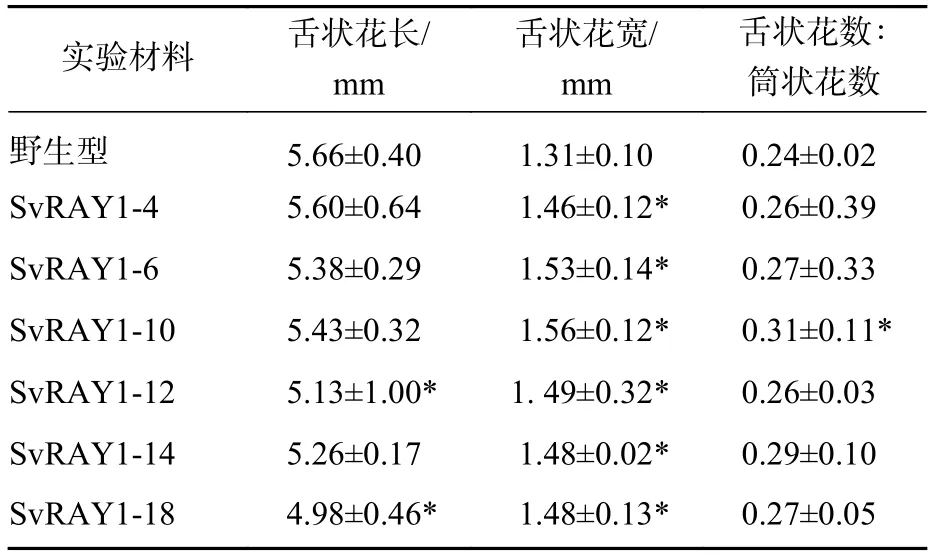
表2 舌状花形态统计学分析Table 2 Statistical comparison of ray floret morphology between wild type and transgenic S. vulgaris
探究SvRAY1转基因舌状花变宽原因,使用扫描电子显微镜观察其腹侧表皮细胞,分析细胞数目及形态变化。与野生型相比,转基因SvRAY1植株舌状花表皮细胞形态发生不同程度的变化。舌状花远轴端尖端细胞较野生型小、分布密集;中轴端细胞边缘由弯曲变为平滑且细胞变宽变短,表明转基因SvRAY1植株可能因为细胞分裂旺盛(图6红色曲线标注),使舌状花整体变宽。

图6 野生型及SvRAY1舌状花腹侧表皮细胞扫描电镜形态差异观察Figure 6 Observation of adaxial epidermal cell differentiation between wild type and transgenic S. vulgaris by SEM
3 讨论
被子植物精美的花器官具有很高的观赏价值,同时也具有遗传繁殖功能[1]。菊科植物头状花序中的舌状花配合筒状花遗传生殖功能进行虫媒吸引,两者相互协调,其复杂性与授粉专业化、异交率、遗传多样性、物种进化和快速繁殖有关[11],从而促使菊科植物在进化史上发生数目与种类的急剧增加。核心双子叶植物中,CYC2基因可作为花对称性调控因子参与花对称性的建立,而菊科中舌状花花对称性的建立使其更好地与筒状花进行功能适应。
文献报道[12]认为:欧洲千里光RAY1基因过表达参与舌状花长度的变化,舌状花变短,但未深入探究其产生原因,故本研究克隆SvRAY1基因,进一步研究舌状花花型变化原因。生物信息学技术表明:克隆的SvRAY1基因与CcCYC2d、TrCYC2d处于同一分支,蛋白结构与AmCYC相似,预测所克隆的SvRAY1基因具有CYC基因保守功能。
对非洲菊GhCYC2[11]、向日葵Helianthus annuus HaCYC2c、HaCYC2d基因[17]舌状花花原基中的表达研究表明:这些基因主要在舌状花中表达,且通过影响细胞增殖调节舌状花大小。构建欧洲千里光pBI121-35s::SvRAY1过表达载体,并对各阶段花发育表达量进行分析。该转基因植株随着生长发育SvRAY1基因的表达量随之上升,且主要在S3、S4阶段的舌状花中表达,表达量是同时期筒状花的1.5~2.0倍,进一步推测SvRAY1基因过表达可能主要定位在舌状花S3、S4阶段,且对欧洲千里光舌状花表皮细胞发育影响最大。观察转基因SvRAY1植株并进行形态学统计,舌状花长度不同程度变短,宽度显著变宽,舌状花与筒状花数目之比也有显著性。SvRAY1转基因舌状花表型不但与RAY1过表达表型相似且获得了不同表型。
扫描电子显微镜观察到舌状花显著变宽的SvRAY1-6转基因植株腹侧表皮细胞。远轴端及中轴端细胞较野生型变小,分裂旺盛,但远轴端细胞形态变化不大,中轴端细胞除变小变短外,其细胞形态也发生了变化,即由边缘弯曲变为平滑。转基因舌状花不同部位表皮细胞数目及形态的变化共同影响了舌状花的发育,其中中轴端的细胞变化可能对舌状花变宽起到主要的影响。金鱼草CYC、DICH和蓝猪耳Torenia fournieri CYC及苦苣苔科Gesneriaceae非洲堇Saintpaulia ionantha SiCYCA基因过表达以不同形式调节细胞分裂,因此,CYC基因可能通过控制表皮细胞数目、大小及形态等调控花器官发育。SvRAY1基因行使的功能与上述基因相似[6-7,18-19],即CYC2类SvRAY1基因可能通过细胞分裂、细胞形态变化从而影响舌状花的发育。
同时,SvRAY1基因过表达舌状花与筒状花数目比例较野生型高,即舌状花数目较野生型多,拥有更好吸引虫媒的条件,较野生型更能吸引虫媒授粉,完成生殖繁衍功能。而在向日葵、非洲菊及杭白菊CYC基因突变体及过表达株系中,或通过筒状花与舌状花之间的转变[20-21],或改变舌状花的长度、数目[22]使花序小花组成及花序大小发生变化,行使与SvRAY1基因过表达相似功能,更好地完成世代繁衍任务。
菊科头状花序很复杂,虽然其发育存在着一定生化功能上的保守性,但舌状花与筒状花发育存在着时间、空间的表达多变性以及功能多样化[13]。除了已知的CYC2类基因调控菊科花型外,还有其他未知的基因以及其他途径共同调控花型变化模式。一些研究表明:激素可能参与CYC基因调节途径,可能影响花对称性的形成。例如拟南芥Arabidopsis thaliana的生长素和独脚金内酯合成突变体中,TCP18表达量降低,表明激素可能影响TCP家族基因表达[23]。CYC基因为TCP家族成员之一,金鱼草中CYC基因调节细胞分裂,欧洲千里光SvRAY1影响细胞分裂,调整舌状花表型,因此,CYC与激素调节途径的研究可在以后的实验中进一步研究。
菊科中,通常认为舌状花的存在与否由关键的一二个基因或一些其他基因所修饰[24]。这些基因间的表达并不是独立的,大多可互作或者通过基因网络调控[25],或通过CYC基因间,或与ABC基因协同调控头状花序发育,例如:菊花CmCYC2f基因作为CmCYC2c下游靶标,诱导菊花中特定花的分化[25]以及CmCYC2b-CmCYC2d、CmCYC2b-CmCYC2e和CmCYC2c-CmCYC2d蛋白间相互作用形成蛋白二聚体[26],菊花A类基因与CYC2类基因相互作用参与筒状花和舌状花的分化[27]。金鱼草花对称模式CYCDICH-RAD-DIV调控网络,烟叶苣苔Primulina heterotricha的CYC1C与CYC1D的双正向自调控反馈环[28]等通过基因调控网络作用于花型的发育。各种调控元件通过对发育调控网络进行修饰、改变,致使被子植物花型多种多样。因此,后续可以继续研究SvRAY1基因间互作,SvRAY1基因与其他花发育基因等的互作,共同参与花型的调控。

