纹理分析评估肺磨玻璃结节样腺癌的浸润性:基于CT平扫与增强图像的对照研究
吕燕,叶靖,凌俊
肺腺癌是肺癌最常见的病理类型。肺腺癌病理分成浸润前病变(pre-invasive lesion,PIL)、微浸润性肺腺癌(micro-invasive lung adenocarcinoma,MIA)及浸润性肺腺癌(invasive adenocarcinoma,IA)[1]。其中PIL包括非典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)及原位癌(adenocarcinoma in situ,AIS)。PIL和MIA患者行肺段切除术后的5年无病生存率接近100%,而对于IA患者以肺叶切除术为主,且术后5年无病生存率<90%。因此,术前准确评估肺结节的浸润性对手术方式的选择及预后的评估具有重要作用[2]。
在CT影像诊断方面,对于病变的侵袭性,通常根据病变的大小、形态、边缘、内部特征(空泡征)、其内实性成分的大小和比例及周围特征(胸膜牵拉、血管聚集)等来判断[3-4]。Lee等[3]指出胸膜牵拉征、磨玻璃密度(ground-glass opacity,GGO)结节内实性成分的面积及比例是鉴别肺腺癌浸润性的独立预测因子。但是,不同层次、不同资历的放射科医师对CT特征的理解和认识存在一定的差异。此外,传统的图像特征分析存在操作复杂、人为因素影响大和图像特征特异性差等问题。因此,传统的CT影像诊断工作中判断肺腺癌浸润性的准确性仍有待提高。
AAH或AIS仅表现为纯磨玻璃(pure GGO,pGGO)结节[4]。然而,随着浸润性的增加,肿瘤可能仍然以GGO的形式出现,MIA和IA既可表现为pGGO结节,也可以表现为混合磨玻璃(mixed GGO,mGGO)结节[5-7]。因此,我们假设,通过纹理分析技术提取GGO结节的纹理特征,如偏度、峰度和熵等,可以使我们检测到GGO结节内物理体素水平的变化特点,从而可用于IA与PIL/MIA的鉴别诊断。许多文献已经指出CT纹理分析技术在众多疾病的诊断、治疗监测和预后评估中是可行的[8-11]。因此,本研究旨在研究CT图像纹理分析技术鉴别肺腺癌浸润性的可行性及其诊断效能,并进一步对比了非对比增强CT和对比增强CT图像在其中的价值。
材料与方法
1.一般资料
回顾性搜集2017年1月-2020年6月在本院行胸部CT平扫和增强扫描并检出肺部GGO样结节的600例患者的临床和影像资料,筛选出符合以下条件的病例:①经手术病理证实为肺腺癌,且CT检查前未接受过活检、放疗和化疗等操作或治疗;②CT图像中包含重建层厚为1.25 mm的图像;③GGO结节直径为5~30 mm;④GGO无明显的分叶征和毛刺征,且不含有钙化、空洞及坏死成分(图1);⑤可为pGGO结节,也可为含少量形态规则的实性成分(呈斑点状或线样)的mGGO(图2)。最终77例符合要求的患者纳入本研究,男25例,女52例,年龄23~75岁,平均(53.40 ±11.13)岁。病理分型:PIL 12例,MIA 36例,IA 29例。
2.检查方法
使用Lightspeed VCT(30例)、Discovery CT 750 HD(28例)或GE Optima CT660 128层(19例)CT机。扫描参数:120 kV,210 mAs,层厚5.00 mm,螺距0.984或1.375;重建层厚1.25 mm。所有图像存储于PACS系统。
3.纹理特征提取
从PACS系统中调取薄层CT重建图像,并存储为DICOM格式,然后将图像调入Matlab 7.3.0后处理软件进行纹理分析。在病灶所在的所有层面,逐层沿病灶边缘手动勾画ROI,继而得到病灶的三维容积ROI(图3)。软件可以自动计算并提取出基于病灶整体的各种纹理特征。本研究分析的纹理特征参数包括直方图参数和灰度共生矩阵(gray level co-occurrence matrix,GLGM)参数。直方图参数包括第10、25、50、75和90 百分位数(percentile,P)、标准差、平均值、偏度和峰度,GLGM参数包括能量、熵、相关性和均匀性。

图1 患者,男,54岁,右肺上叶纯磨玻璃结节,术后病理结果为原位癌。HRCT示结节形态规则(箭),无钙化、空洞、分叶征及毛刺征。 图2 患者,女,52岁,右肺上叶混合性磨玻璃结节,术后病理结果为微浸润性肺腺癌。HRCT示结节形态规则(箭),无钙化、空洞、分叶征及毛刺征,其内实性成分较小、形态规则、呈线样。 图3 女,45岁,右肺上叶纯磨玻璃样结节。在CT图像上沿病灶边缘逐层手动勾画ROI,软件即可生成结节的三维容积ROI,用于提取结节的纹理特征参数。
4.统计学分析
使用SPASS 20.0软件进行统计学分析。先对各项计量资料进行Kolmogorov-Smirnov正态性检验。采用独立样本t检验(正态分布)或Mann WhitneyU检验(偏态分布)分别对的IA组与PIL/MIA组各项纹理参数值(分别基于非增强CT和增强CT图象提取)进行比较,对差异有统计学意义的指标进行ROC曲线分析并计算曲线下面积(area under the curve,AUC),获得各参数的诊断效能。以P<0.05为差异有统计学意义。
结 果
1.IA组与PIL/MIA组纹理参数的比较
IA组与PIL/MIA组纹理参数值及组间比较结果见表1~2。基于平扫CT图像提取的纹理特征参数中,平均值、标准差、P10、P25、P50、P75和P90、能量、熵、相关性和均匀性在两组间的差异有统计学意义(P<0.001),而偏度和峰度在两组间差异无统计学意义(P>0.05)。基于增强CT图像提取的纹理特征参数中,P75、P90、能量、熵和相关性在两组间的差异有统计学意义(P<0.05)。

表1 2组基于平扫CT图像提取的纹理参数值的比较

表2 2组基于增强CT图像提取的纹理参数值的比较
2.ROC曲线分析
对组间差异有统计学意义的参数进行ROC曲线分析,结果见表3~4。基于平扫和增强CT图像提取的纹理特征参数中,均以熵的AUC最大,其次为能量的AUC(图4a~b)。当联合能量和熵进行诊断时,基于非增强CT图像的AUC为0.873,基于增强CT图像的AUC为0.847(图4c)。

表3 基于平扫CT图像提取的纹理特征参数鉴别的效能
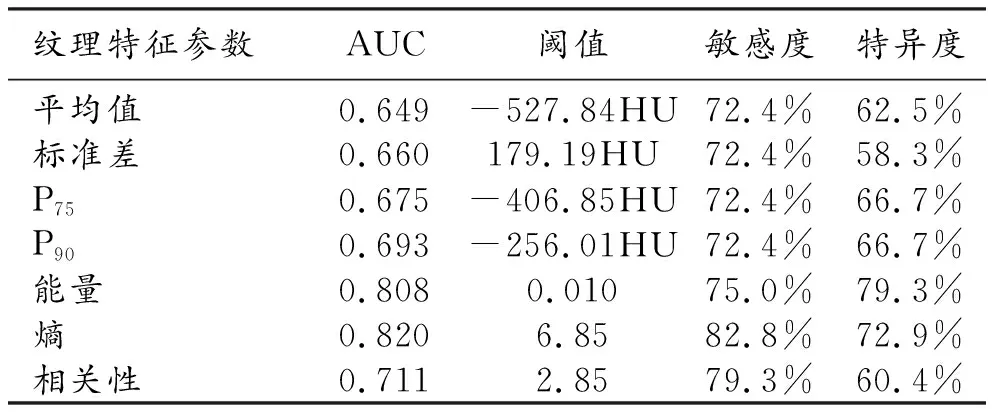
表4 增强CT图像提取的纹理特征参数鉴别的效能

图4 纹理特征参数(能量和熵)评估肺腺癌浸润性的ROC曲线。a)基于平扫CT图像提取的能量和熵的ROC曲线,AUC分别为0.839和0.859;b)基于CT增强图像提取的能量和熵的ROC曲线,AUC分别为0.818和0.820;c)联合能量和熵进行评估时,基于平扫图像时AUC为0.873,基于增强图像时AUC为0.847。
讨 论
表现为GGO的肺腺癌在遗传和组织病理学水平上具有异质性。异质性是公认的恶性肿瘤的特征,反映了较高的细胞密度、坏死、出血和黏液样变[12]。纹理分析通过检测图像中细微体素灰度的分布和关系来定量获取图像中的信息,从而提取与组织异质性相关的定量参数[13]。
Lee等[14]发现,pGGO可表现为AAH、AIS或MIA,mGGO则主要表现为MIA和IA,其结果与本研究结果一致。在本研究中,所有PIL均表现为pGGO,而MIA和IA部分表现为pGGO、部分表现为mGGO。一些研究表明,含有实性成分、毛刺征、分叶征、空泡征和胸膜凹陷征是GGO的典型恶性征象[14-16]。为了更好地解决临床实际问题,部分研究中将有明显恶性征象的病例剔除,包括肿瘤明显分叶、空泡、明显的实性成分及不规则形状的实性成分[17-18]。我们团队同样是将pGGO或含有少量实性成分的mGGO结节纳入本研究中(图3)。谭明瑜等[19]将样本分为浸润前病变和浸润性病变,即PIL和MIA/IA。Li等[20]将样本分为3组,即PIL、MIA和IA。Son等[17]和Chae等[18]与本研究一样,将样本分为PIL/MIA组和IA组。PIL/MIA和IA患者的手术方式及预后相差较大[2-3],因此,样本分为PIL/MIA和IA两组,不仅使实验设计简单,而且能够更好地解决临床实际问题。既往有研究者使用平扫CT图像进行纹理分析[18-20],也有一些研究者使用对比增强CT图象[21-22]。然而,这些研究中并没有解释原因。本研究中旨在探讨并比较了基于平扫CT和对比CT图像的纹理分析技术在鉴别IA和PIL/MIA中的价值。
本研究共选取了13个纹理特征参数。在基于平扫CT图像的纹理分析中,有11个参数对鉴别AI与MIA/PIL有统计学意义,其中以能量和熵的诊断效能较高。在基于增强CT图像的纹理分析中,有8个参数有鉴别诊断价值,同样以能量和熵的诊断效能较高。有研究表明,高熵值与肺癌[17,21]、肝硬化[23]和附件肿瘤[24-25]的恶性程度相关。熵是衡量图像灰度分布随机性的特征参数,代表了图像纹理的复杂性,图像纹理越复杂,熵值越高[26]。能量反映了纹理的灰度分布均匀性和粗糙度,图像越均匀,能量越高。肺腺癌浸润性增加伴有细胞通透性改变、异常血管生成、黏液化和坏死,从而导致肿瘤的不均匀性。因此IA在病理上表现为成分混杂和不均匀。本研究结果显示IA组的能量小于PIL/MIA组,IA组的熵大于PIL/MIA组,表明IA在CT图像上灰度分布相对不均匀、局部纹理较杂乱,而PIL/MIA多表现为灰度分布较均匀、局部纹理规律性较强。
最初假设偏度或峰度可能有助于区分IA与PIL/MIA,如之前的许多研究结果所示[16,18,27,28]。然而,目前本研究结果并未能证实这一点。猜测可能是由于IA、PIL和MIA的直方图差异太大,无法准确区分。大部分研究中基于整个GGO病灶来提取纹理特征,即在薄层CT图像上逐层勾画ROI,得到整个病灶的三维容积ROI,而不是使用GGO最大直径所在层面(单层面)来提取纹理特征[26,29,30],此外,不同的放射科医师对GGO最大直径的选择可能有所不同。因此,在本研究中,同样提取病灶的三维图像进行纹理分析。
在GGO的影像诊断中,平扫和增强CT图像有各自的优点:增强CT可提供病灶的血供特征以及是否肺血管受累,从而有助于间接判断病灶的良、恶性;而平扫CT操作简单,无需使用对比剂,在GGO病灶的定期复查和对比观察过程中是主要的检查方法。在本研究中,与增强CT图像相比,平扫CT图像上提取的纹理参数中在两组间差异有统计学意义的参数更多。基于平扫CT图像提取的能量和熵的诊断效能略高于增强CT图像,尽管它们都具有良好的诊断性能。笔者分析原因可能如下:首先,使用碘对比剂获得的增强CT图像主要与存在不同血管化区域有关。然而,基于平扫CT图像的纹理分析可以反映肿瘤细胞在病灶内的分布。此外,在增强CT扫描中,腋静脉、锁骨下静脉和上腔静脉内的高浓度碘对比剂可能产生明显的射线束硬化伪影,并可能干扰附近GGO病变的显示(图5)。因此,对于CT纹理分析,NECT可能是一个更好的选择。
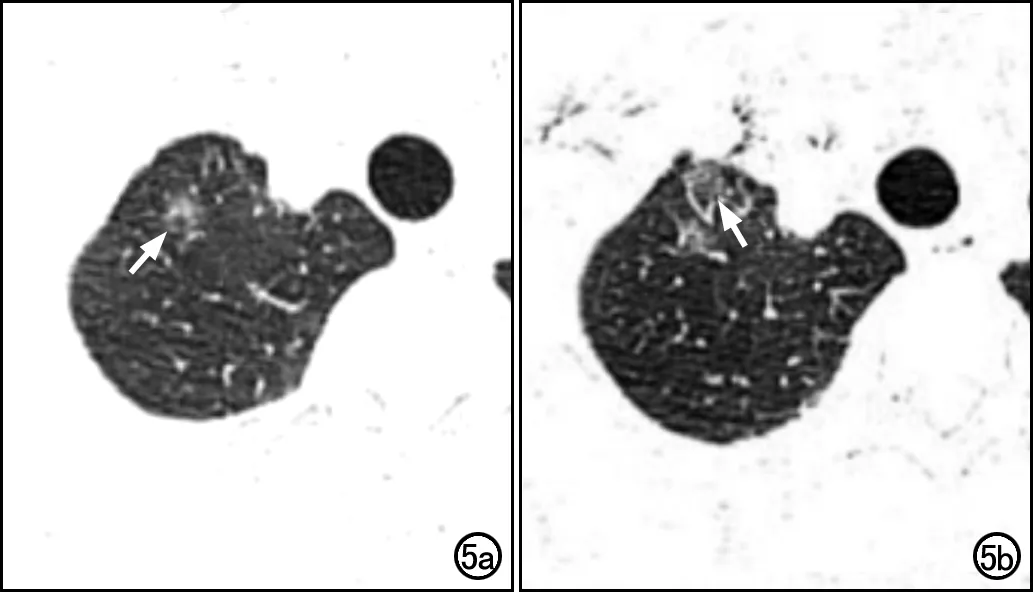
图5 患者,女性,38岁,右肺上叶磨玻璃结节。a)平扫CT图像上病灶清晰显示(箭);b)增强CT图像上,由于局部有明显的射线硬束化伪影,结节显示较模糊(箭)。
本研究存在一定的局限性:①本研究为回顾性研究,可能存在一定的选择偏倚;②样本量较小;③所有患者并不是使用同一台CT机进行扫描的,不同机型CT图像间提取的纹理参数有可能存在系统误差;④病灶边界均由放射科医师手动勾画,对病灶具体轮廓的判定受个人经验的影响;⑤患者的CT平扫和增强检查并不是在同一时间进行的,对两者的对照研究有可能存在影响。⑥除了肺腺癌,良性病变,包括局灶性炎症、水肿或出血,也可表现为GGO,本研究中仅包括确诊为肺腺癌的GGO,对包括其它类型GGO的研究将是下一步的研究重点。
总之,CT图像纹理分析技术,不管是基于平扫还是增强CT,都能较好地鉴别IA与MIA/PIL,尤其是能量和熵这2个纹理参数;从本组的初步研究结果来看,基于平扫CT图像的纹理分析效果似更好,且其获取更简单、无需使用对比剂,故认为基于平扫CT图像的纹理分析可能是一个更好的选择。

