HIFU联合清蛋白结合型紫杉醇治疗胰腺癌的临床观察
杨小琴,冉立峰,金成兵△,杨 炜,张 俊,马玉虹,周 崑,朱 辉
(1.重庆医科大学研究生院 400016;2.重庆医科大学附属第二医院肿瘤中心 400010)
胰腺癌是一种恶性程度极高、侵袭性很强的消化系统肿瘤,目前在全球范围内的发病率和病死率均呈上升趋势[1]。手术联合化疗为主的全身药物治疗是目前早期胰腺癌的最佳治疗方法。然而,多数胰腺癌临床发现时已为不可手术切除的中晚期,对于不可切除胰腺癌,多采用局部放疗联合化疗治疗,但疗效仍不满意。近年来,一种将低能量超声波体外聚焦,通过高温为主的生物学效应消融深部肿瘤的新技术——高强度聚焦超声(HIFU),已用于不可切除胰腺癌的临床治疗[2]。HIFU能有效消融局部病灶,缓解癌性疼痛[3-5]。与手术、放疗等比较,HIFU具有体外、非侵袭性、创伤小、恢复快、无放射污染等优点,可能是不可切除胰腺癌的一种有效、值得期待的微无创治疗方法。由于胰腺癌邻近器官的复杂性及侵袭性很强的特点,HIFU难以完整、超范围、彻底消融肿瘤,往往会出现肉眼或镜下残留。如何减少、灭活残留病灶是提高HIFU局部疗效、延长患者生存期的关键问题。且目前少有HIFU联合清蛋白结合型紫杉醇治疗胰腺癌的报道。为此,本研究采用HIFU联合一种新型的靶向化疗药物——清蛋白结合型紫杉醇,治疗不可切除胰腺癌,探讨其安全性及有效性,以期为不可切除胰腺癌提供一种新的、安全有效的综合治疗方法。
1 资料与方法
1.1 一般资料
选取2017年7月至2020年6月重庆医科大学附属第二医院肿瘤中心收治的不可切除胰腺癌患者48例,将其分为观察组和对照组,每组24例。纳入标准:(1)经过病理确诊为胰腺癌,或经多学科讨论符合临床诊断;(2)局部晚期或远处转移而不能手术切除;(3)体力状况(ECOG)评分0~2分;(4)胆道梗阻者有效减黄后;(5)预计生存期大于或等于3个月;(6)无重要脏器功能障碍及骨髓造血功能衰竭;(7)具有可测量的病灶;(8)无对清蛋白或紫杉醇等化疗药物过敏;(9)局部治疗区皮肤完整。排除标准:(1)超声不能清晰显示预治疗靶区;(2)颅内转移;(3)脊柱转移且合并病理性骨折;(4)肿瘤侵犯肠系膜上动脉且伴有肠道缺血性临床表现。本研究获得中国注册临床试验伦理委员会及本院伦理委员会批准(伦理审查文号:ChiECRCT20190087),所有入组患者均签署知情及治疗同意书。两组患者一般资料比较,差异均无统计学意义(P>0.05),见表1。
1.2 方法
1.2.1HIFU治疗
所有患者均接受HIFU治疗。HIFU设备是由中国重庆海扶医疗科技股份有限公司提供的JC型HIFU肿瘤治疗系统,主要包括超声发生器、聚焦超声换能器、运动系统、控制系统、B超实时引导系统。治疗参数:治疗频率 0.85 MHz,焦距135 mm,最大治疗功率400 W。治疗介质为脱气水。治疗前10 h禁食禁饮行肠道准备,治疗区皮肤脱脂脱气,完善术前常规检查。治疗中结合治疗前影像资料确定治疗体位,使用机载超声评估声通道并定位,根据病灶大小、深度、邻近脏器等情况制订治疗次数及时间,按照点-线-面-体的辐照方式对病灶实施三维立体适形消融。治疗后禁食禁饮24 h以上至患者肛门排气;常规给予抗生素预防感染、质子泵抑制剂(PPI)预防胰腺炎,并于术后1、3~5、7 d复查胰腺炎酶学监测有无胰腺炎发生。HIFU治疗后15、30 d及以后每3个月随访影像学变化,若病灶有残留,可行第2次或多次HIFU治疗。
1.2.2化疗方法
(1)观察组患者HIFU治疗后,给予清蛋白结合型紫杉醇(购自石药集团欧意药业有限公司,规格:100 mg)125 mg/m2静脉滴注30 min,于第1、8、15天应用,28 d为1个周期;联合吉西他滨(购自希腊VIanex SA Plantc公司,规格:200 mg)1 000 mg/m2静脉滴注,>30 min,于第1、8、15天应用,28 d为1个周期(n=22),或联合替吉奥(购自江苏恒瑞医药股份有限公司,规格:替加氟20 mg,吉美嘧啶5.8 mg,奥替拉西钾19.6 mg)40 mg口服,每天2次,连续服用14 d,每3周重复化疗(n=2)。(2)对照组中14例患者接受单纯HIFU治疗,10例患者在HIFU治疗后给予非清蛋白结合型紫杉醇的化疗,具体方案:吉西他滨单药(n=2)、替吉奥单药(n=4)、吉西他滨联合替吉奥(n=4),相应药物用法均同观察组。其中,输注清蛋白结合型紫杉醇均不做抗过敏预处理,化疗前常规给予5-羟色胺3受体拮抗剂预防呕吐,≥65岁患者化疗药物减少25%,化疗6~8周期,或持续至疾病进展或出现不能耐受的不良反应或拒绝继续化疗或无进展情况下任何原因死亡。
1.2.3疗效评价
(1)客观疗效:治疗后每3个月行上腹部磁共振成像(MRI)/CT增强检查,根据实体肿瘤评价标准(RECIST)1.1对肿瘤病灶进行评估,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD),以(CR+PR)/总例数×100%计算客观缓解率(ORR),以(CR+PR+SD)/总例数×100%计算疾病控制率(DCR)。胰肿瘤消融率为消融体积/治疗前病灶体积×100%。(2)记录两组患者治疗前和治疗后3个月的ECOG评分、疼痛评分、糖类抗原(CA)19-9与CA125水平变化。疼痛评分使用数字评估法(NRS)。(3)生存分析:以首次接受HIFU治疗日期为起点,以死亡日期、失访日期或随访截止日期为终点。计算两组患者中位生存期(MST)及1、3、6、12个月总生存率(OSR)。(4)不良反应:参照常见不良事件评价标准(CTCAE)5.0版进行分级。
1.3 统计学处理
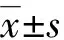

表1 两组患者一般资料比较(n=24)
2 结 果
2.1 两组患者客观疗效比较
两组均无CR病例,观察组PR 8例,SD 14例,PD 2例,ORR为33.33%,DCR为91.67%;对照组PR 6例,SD 12例,PD 6例,ORR为25.00%,DCR为75.00%,观察组的ORR、DCR均高于对照组,但差异均无统计学意义(χ2=0.403、2.400,P=0.525、0.245)。观察组胰肿瘤消融率为(98.33±22.10)%,对照组为(90.35±32.90)%,两组患者胰肿瘤消融率比较差异无统计学意义(t=-0.986,P=0.329)。
2.2 两组患者治疗前后ECOG、NRS评分比较
观察组、对照组疼痛缓解率分别为83.33%(20/24)、75.00%(18/24),两组比较差异无统计学意义(χ2=0.505,P=0.477)。治疗后3个月,两组患者ECOG、NRS评分均较治疗前明显下降(P<0.05),且观察组NRS评分明显低于对照组(t=2.323,P=0.025);而两组患者ECOG评分比较差异无统计学意义(Z=-0.876,P=0.381),见表2。
2.3 两组患者CA19-9、CA125水平比较
治疗后3个月,两组CA19-9、CA125水平均较治疗前明显下降(P<0.05),且观察组CA19-9水平明显低于对照组(Z=-2.092,P=0.036);而两组CA125水平比较差异无统计学意义(Z=-0.990,P=0.322),见表3。

表2 两组患者治疗前后ECOG、NRS评分比较(n=24,分)
2.4 两组患者MST及OSR比较
至随访结束,观察组MST较对照组明显延长(15个月vs.10个月,χ2=4.128,P=0.042)。观察组1、3、6、12个月OSR分别为100%、100%、79.17%、62.50%,对照组分别为91.67%、79.17%、66.67%、33.33%,两组患者12个月OSR比较差异有统计学意义(χ2=4.090,P=0.043)。两组患者生存曲线图见图1。

表3 两组患者CA19-9、CA125水平比较[M(P25,P75),n=24,U/mL]
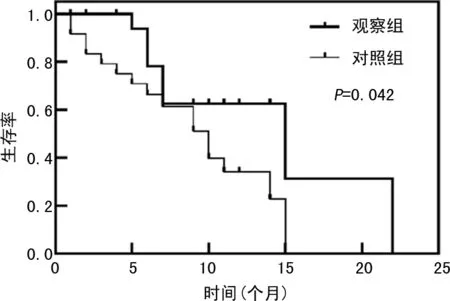
图1 两组胰腺癌患者生存曲线图
2.5 两组患者不良反应比较
HIFU治疗后两组均未出现Ⅲ~Ⅳ级不良反应。对照组与观察组患者出现的Ⅰ~Ⅱ级不良反应包括治疗区皮肤橘皮样改变(0/1)、治疗区皮下软组织水肿(14/12)、治疗区疼痛(20/21)、胰腺炎(4/2)、恶心呕吐(7/4)、腹泻(3/3)、发热(2/3)。其中随访复查胰腺炎酶学发现观察组血淀粉酶为54.00(24.00,88.00)U/L,有2例患者血淀粉酶明显升高,并发了胰腺炎,对照组血淀粉酶为48.00(28.75,77.99)U/L,4例患者血淀粉酶轻度升高,并发了胰腺炎。各不良反应比较差异均无统计学意义(P>0.05)。上述不良反应经对症处理后可逐渐恢复正常。化疗后观察组、对照组分别有24、10例患者发生常见不良反应,包括血液学毒性、消化道反应、外周感觉神经障碍、皮肤过敏、心律失常、脱发和乏力。仅在观察组发生的不良反应为外周感觉神经障碍(Ⅱ级)和心律失常(心房颤动,Ⅲ级),发生率依次为8.33%和4.17%。两组各不良反应构成比比较,差异均无统计学意义(P>0.05),见表4。
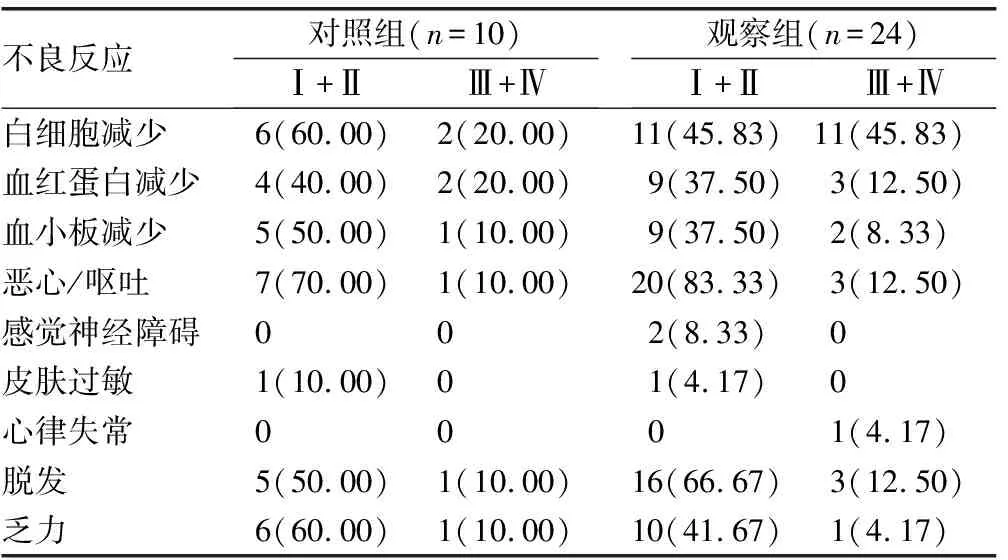
表4 两组患者化疗后不良反应比较[n(%)]
2.6 典型病例HIFU治疗前后CT图像
患者,男,50岁,胰腺体部癌HIFU术前增强CT显示,病灶不均匀强化;HIFU术后增强CT显示,病灶内血液供应消失,病灶区凝固性坏死,见图2。
箭头所指为坏死病灶。
3 讨 论
目前,手术切除依然是胰腺癌的最佳治疗方式,但胰腺癌起病隐匿,易发生早期远处转移和周围血管侵犯,大多数患者在确诊时已失去手术治疗机会。多年来不可切除胰腺癌的一线治疗方案总体疗效差强人意,迫切需要新的、有效的治疗方法致力于不可切除胰腺癌的治疗。
清蛋白结合型紫杉醇是紫杉醇和清蛋白结合成纳米级无溶剂的胶体悬浮颗粒,通过活性的gp60受体介导的跨膜转运及与富含半胱氨酸的酸性分泌蛋白(SPARC)的结合来增加紫杉醇药物蓄积。相比溶剂型紫杉醇,清蛋白结合型紫杉醇不需要助溶剂和预处理,毒性低、输注时间短[6-7]。有研究发现,清蛋白结合型紫杉醇可以使肿瘤间质耗竭、减少细胞中胞苷脱氨酶(吉西他滨代谢酶)蛋白水平,从而提高血中和组织中的化疗药物浓度、增强化疗疗效[8-9]。
HIFU治疗是一种局部消融肿瘤的非侵入性手术,基本原理是将体外低能量的超声波聚焦于体内肿瘤靶组织处产生生物学效应(热效应、空化效应、机械效应),使靶组织发生凝固性坏死,从而消融肿瘤。HIFU治疗不仅可直接破坏原发肿瘤,还可以引起肿瘤相关抗原的释放、肿瘤细胞分泌免疫抑制因子及诱导细胞毒性T淋巴细胞活性,从而激活宿主抗肿瘤免疫,增强抗肿瘤效果,还有助于控制肿瘤微转移[10]。有大量研究证实,HIFU治疗晚期胰腺癌可有效缓解疼痛、延长生存期,且具有独特的无创性、实时监控、适形消融、对周围组织血管影响小、并发症轻等优点[3-4,11-13]。尽管如此,由于胰腺癌邻近胃肠道、胆道、脊柱等重要器官和肠系膜上动脉、腹腔干等重要血管,HIFU消融过程中可能对其造成损伤,产生如胃肠道穿孔等严重并发症;且胰腺癌具有很强的神经、血管侵袭性特点,而CT、磁共振成像(MRI)等影像学难以完全发现微小的侵袭性病灶,导致HIFU难以完整、超范围、彻底消融肿瘤,往往会出现肉眼或镜下残留。因此,如何减少、灭活残留病灶,提高HIFU局部疗效、延长患者生存,是目前重要的研究热点。
为此,本研究通过联合高效的新型靶向化疗药物——清蛋白结合型紫杉醇,来增加疗效。生存分析显示,观察组MST、12个月OSR较对照组明显提高,且优于晚期胰腺癌的一线治疗[14-15]与NING等[16]报道的HIFU联合吉西他滨治疗(MST为7.4个月,6个月OSR为66.3%,12个月OSR为21.32%)。此外,治疗后两组患者的ECOG评分、疼痛程度、肿瘤标志物水平均较治疗前改善,且在疼痛程度与CA19-9下降方面观察组较对照组更明显(P<0.05)。以上结果表明,与其他联合治疗方法比较,HIFU联合含清蛋白结合型紫杉醇化疗,可能在改善患者生存、提高疼痛控制与减轻肿瘤负荷等方面更有优势。其可能机制是清蛋白结合型紫杉醇有去肿瘤间质化作用,以及HIFU治疗后改变了肿瘤局部的微环境(热消融后周边组织充血水肿更明显,血流增加,药物聚集增加),导致局部化疗药物浓度增加,化疗药物疗效增强,能更加有效杀灭残留的肿瘤病灶,增加了治疗效果,单一的HIFU治疗或HIFU联合其他药物无法实现[8,13]。具体的作用机制仍需要进一步的基础研究。
本研究中HIFU治疗后出现的不良反应均可耐受。治疗区皮下软组织水肿、疼痛可能由于声通道上的衰减能量对局部组织造成热损伤所致,出现橘皮样改变的患者考虑可能是功率过大导致(该患者HIFU治疗平均功率为400 W,治疗时间为992 s),上述不良反应经过间断冷敷、药物止痛、改善微循环即可好转。两组均出现了无症状的胰腺炎,原因可能是HIFU治疗中超声波通过正常胰腺或肿瘤热消融后的热扩散引起周边正常胰腺组织的无菌性轻微炎性反应,使得胰酶释放,进而通过周围的血管入血,导致胰酶升高。出现发热的患者均为中、低度热,无病原学证据,可能与HIFU治疗后病灶产生凝固性坏死,坏死组织产生吸收热所致。未发现消化道出血、胃肠穿孔、血管损伤等严重并发症。化疗后,观察组的Ⅲ~Ⅳ级不良反应发生率更高,但未增加危及生命的毒副反应发生率,此外,观察到有外周感觉神经障碍和心律失常这两种并发症仅发生在观察组,但发生率较低,经对症处理可缓解,不影响后续治疗。未出现因不良反应停止治疗或相关死亡者。
综上所述,HIFU联合含清蛋白结合型紫杉醇的化疗治疗不可切除胰腺癌安全可行,能明显缓解疼痛、降低肿瘤负荷、提高生存率和延长生存期,且毒副反应小。但本研究样本量少,随访时间较短,其结论尚待大样本量、足够随访时间的随机对照研究进一步验证。

