UBE2T-siRNA对乳腺癌细胞增殖、凋亡及侵袭的影响
刘丹丽,徐建峰,周欢欢,王霖玲,邵喜英△
(1.绍兴第二医院医共体总院肿瘤内科,浙江绍兴312000;2.中国科学院大学附属肿瘤医院/浙江省肿瘤医院乳腺内科,杭州 310000;3.浙江省绍兴市中医院药剂科 312000)
乳腺癌是全世界三种最常见的癌症之一,威胁女性健康[1]。有关乳腺癌发病病因尚不完全清楚,随着医学的发展,乳腺癌的预后得到了一定程度的改善,但其发病率仍然在逐年升高[2]。因此,研究可能与乳腺癌发生有关的基因,有助于解析乳腺癌的发病机制。泛素蛋白酶体系统(UPS)是真核细胞中大多数蛋白质的降解途径,与多种生物学过程和信号通路有关[3]。泛素结合酶E2T(UBE2T)是UPS系统的重要组成部分,有研究表明,UBE2T在多种肿瘤组织和细胞中存在过表达[4-5]。PEREZ-PENA等[6]研究表明,UBE2T在乳腺癌患者中存在过表达,且与乳腺癌患者的不良预后有关。然而有关UBE2T对乳腺癌细胞影响的研究较少,本研究通过体外培养乳腺癌细胞,并转染UBE2T-siRNA质粒,研究UBE2T-siRNA对乳腺癌细胞增殖、侵袭和凋亡的影响,为研究乳腺癌的发生、发展机制提供参考。
1 材料与方法
1.1 材料
1.1.1细胞
乳腺癌细胞系MDA-MB-231、MCF-7、MDA-MB-468、HCC1937及乳腺正常细胞系MCF-10A(TCHu227、SCSP-531、TCHu136、TCHu148、SCSP-575),购自中国科学院细胞库。
1.1.2试剂
RPMI 1640培养基(61870036)、胎牛血清(10099)、青霉素-链霉素(15070063)、胰蛋白酶(25200056),购自美国Gibco公司;Lipofectamine 3000试剂盒(L3000015),购自美国Invitrogen公司;RNAiso plus(9108Q)、逆转录试剂盒(RR037)、实时荧光定量试剂盒(RR820Q),购自日本TAKARA公司;单抗细胞周期蛋白D1(CyclinD1,ab16663)、β-连环蛋白(β-catenin,ab184919)、神经型钙黏附蛋白(N-cad,ab76011)、上皮型钙黏附蛋白(E-cad,ab133597)、半胱氨酸天冬氨酸蛋白酶-9(caspase-9,ab32539)、c-Myc(ab32072)、三磷酸甘油醛脱氢酶(GAPDH,ab8245),购自美国Abcam公司;四甲基偶氮唑蓝(MTT)试剂盒(ST316)、膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)细胞凋亡双染试剂盒(C1062)、辣根过氧化物酶(HRP)标记二抗(A0208)、细胞蛋白提取试剂盒(P0033)、二喹啉甲酸(BCA)蛋白定量试剂盒(P0012),购自上海碧云天生物技术公司;UBE2T mRNA、GAPDH、UBE2T-siRNA,由生工生物工程(上海)股份有限公司合成。
1.1.3仪器
多功能酶标仪(VarioskanTMLUX,美国ThermoFisher公司);实时荧光定量PCR(qRT-PCR)仪(CFX96,美国Bio-Rad公司);蛋白凝胶成像仪(Gel Doc,美国Bio-Rad公司);流式细胞仪(FACS Canto Ⅱ,美国BD公司)。
1.2 方法
1.2.1细胞培养
细胞MDA-MB-231、MCF-7、MDA-MB-468、HCC1937、MCF-10A常规复苏,加至含10%胎牛血清和1%青霉素-链霉素的RPMI 1640培养基中,37 ℃、5% CO2培养箱中培养。细胞融合度达到80%~90%时,胰蛋白酶消化,每隔2~3天进行1次细胞传代,细胞生长至稳定对数期时用于后续实验。
1.2.2细胞转染及分组
取1.2.1中处于对数生长期的细胞MDA-MB-231,胰蛋白酶消化,调整细胞浓度为5×105个/孔,接种至6孔板中,37 ℃、5% CO2培养箱中培养。细胞融合度达到60%时,倒掉培养板中培养液并加入新鲜培养基,按照Lipofectamine 3000试剂盒说明书对细胞进行转染,并将细胞分为对照组(转染试剂)、阴性转染组(转染空质粒)、UBE2T-siRNA组(转染UBE2T-siRNA质粒)。
1.2.3qRT-PCR检测细胞中UBE2T mRNA表达水平
RNAiso Plus试剂盒提取1.2.1及1.2.2中各组细胞中RNA。逆转录试剂盒对所提取的RNA逆转录成cDNA,之后进行qRT-PCR反应。反应条件:95 ℃ 预变性 60 s,95 ℃ 变性30 s,58 ℃ 退火45 s,72 ℃延伸30 s,共35个循环。以GAPDH作为内参基因,采用2-ΔΔCt方法计算各组细胞中UBE2T mRNA的相对表达水平,引物序列见表1。
1.2.4MTT法检测细胞增殖抑制率
取培养48 h后各组对数期细胞,胰蛋白酶消化,配置细胞悬液,调整细胞浓度为4×104个/mL,每孔100 μL接种至96孔板中,并设置调零孔,每组设置3个重复,37 ℃、5% CO2培养箱中培养72 h,加入20 μL终浓度为0.5 mg/mL的MTT试剂,37 ℃遮光培养4 h,弃上清液,每孔加入150 μL DMSO溶液,摇床振荡10 min,酶标仪570 nm处检测吸光度(A)值,计算细胞增殖抑制率(%)=[(对照孔A值-实验孔A值)/(对照孔A值-凋零孔A值)]×100%。
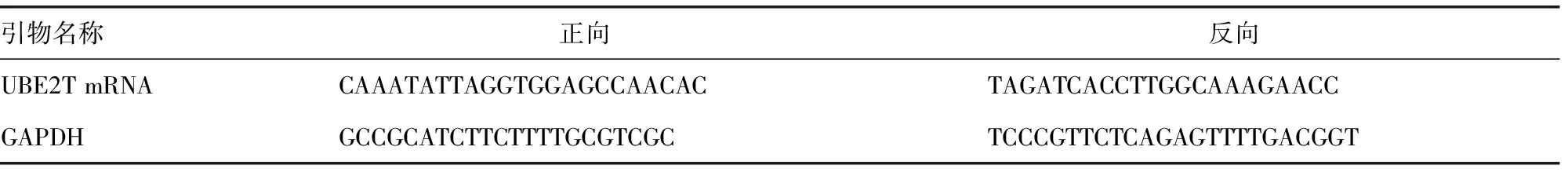
表1 引物序列(5′-3′)
1.2.5流式细胞术检测细胞周期及凋亡
取培养48 h后各组对数期细胞,胰蛋白酶消化,配置细胞悬液,调整细胞浓度为1×106个/mL,每组设置3个重复,吸取100 μL细胞悬液至新离心管中,预冷磷酸盐缓冲液(PBS)重悬细胞,加入5 μL Annexin V-FITC,轻混均匀,4 ℃遮光孵育15 min;加入碘化丙啶(PI)染液,轻混均匀,流式细胞仪观察各组细胞凋亡情况。吸取100 μL细胞悬液至离心管中,并加入预冷的75%乙醇,4 ℃静置过夜,PBS洗涤2次,加入200 μL PBS,分别加入20 μL的0.05 mg/mL的RnaseA和PI,4 ℃遮光30 min,流式细胞仪进行细胞周期数据的收集和分析。
1.2.6Transwell检测细胞侵袭情况
取转染后培养48 h后的各组细胞,胰蛋白酶消化,配置细胞悬液,调整细胞浓度为1×105个/mL,每组选取3个重复,接种于铺有Matrigel胶的Transwell小室上室,并在下室中加入600 μL含胎牛血清的RPMI 1640培养基,37 ℃培养24 h,倒掉上室培养液,用棉签擦去未迁移的细胞和多余的Matrigel胶,无水甲醇固定30 min,0.1%结晶紫溶液染色20 min,显微镜下随机选取5个视野,观察染色细胞并进行计数,计算均值。
1.2.7Western blot检测蛋白表达水平
取培养48 h后各组对数期细胞,胰蛋白酶消化,配置细胞悬液,调整细胞浓度为5×104个/孔,每组选取3个重复,接种至24孔板中,培养24 h后,弃上清液,PBS清洗细胞,重悬细胞,蛋白提取试剂盒对细胞总蛋白进行提取,BCA试剂盒测定提取总蛋白浓度,蛋白样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳结束后将蛋白转移至聚偏氟乙烯(PVDF)膜上,5%脱脂奶粉遮光封闭2 h;分别加入一抗稀释液(CyclinD1 1∶200、β-catenin 1∶1 000、N-cad 1∶1 000、E-cad 1∶5 000、caspase-9 1∶2 000、c-Myc 1∶1 000、GAPDH 1∶1 000稀释),4 ℃孵育过夜,TBST缓冲液(Tris-HCl缓冲盐溶液+Tween)洗膜3次,加入HRP标记二抗稀释液(1∶2 000),室温孵育1 h,TBST洗膜3次。蛋白凝胶成像仪分析蛋白表达水平。
1.3 统计学处理
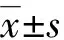
2 结 果
2.1 各组细胞中UBE2T mRNA表达水平比较
与正常乳腺细胞系MCF-10A中UBE2T mRNA表达水平(1.00)比较,乳腺癌细胞系中UBE2T mRNA表达均明显升高(P<0.05),HCC1937、MCF-7、MDA-MB-468、MDA-MB-231中UBE2T mRNA表达水平分别为1.29±0.08、1.32±0.09、1.53±0.15、1.64±0.13,其中MDA-MB-231表达水平最高,故选取乳腺癌细胞系MDA-MB-231进行后续研究。不同乳腺癌细胞系中UBE2T的表达,见图1。
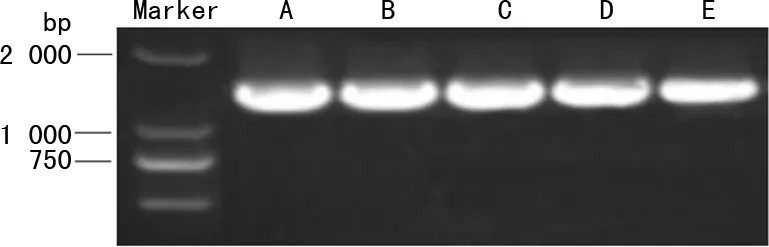
A:MDA-MB-231;B:MDA-MB-468;C:MCF-7;D:HCC1937;E:MCF-10A。
2.2 各组MDA-MB-231中UBE2T mRNA表达水平比较
对照组、阴性转染组、UBE2T-siRNA组细胞UBE2T mRNA表达水平分别为1.00、1.02±0.06、0.54±0.13,与对照组和阴性转染组比较,UBE2T-siRNA组细胞UBE2T mRNA的表达明显降低(P<0.05);各组MDA-MB-231中UBE2T的表达,见图2。
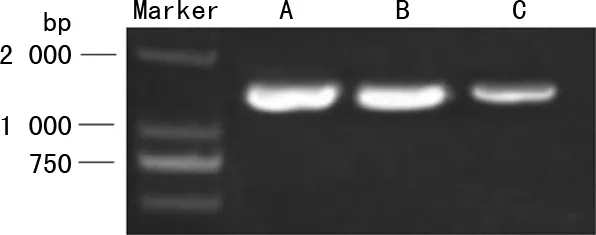
A:对照组;B:阴性转染组;C:UBE2T-siRNA组。
2.3 各组MDA-MB-231细胞增殖抑制率及凋亡率比较
与对照组和阴性转染组比较,UBE2T-siRNA组细胞增殖抑制率及凋亡率均明显升高(P<0.05);见表2、图3。

表2 各组MDA-MB-231细胞增殖抑制率及凋亡率比较
2.4 各组MDA-MB-231细胞周期百分比比较
与对照组和阴性转染组比较,UBE2T-siRNA组G0/G1期细胞百分比明显降低,G2/M期细胞百分比明显升高(P<0.05);各组细胞S期细胞百分比比较差异无统计学意义(P>0.05),见表3、图4。
2.5 各组MDA-MB-231细胞侵袭数目比较
Transwell检测各组细胞侵袭情况,对照组、阴性转染组、UBE2T-siRNA组细胞侵袭数目分别为(219.62±21.48)、(198.54±18.67)、(89.65±16.74)个,与对照组和阴性转染组比较,UBE2T-siRNA组组细胞侵袭数目明显降低(P<0.05),见图5。

表3 各组MDA-MB-231细胞周期百分比比较
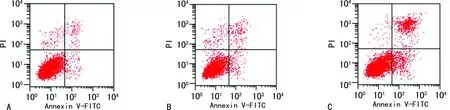
A:对照组;B:阴性转染组;C:UBE2T-siRNA组。

A:对照组;B:阴性转染组;C:UBE2T-siRNA组。

A:对照组;B:阴性转染组;C:UBE2T-siRNA组。
2.6 各组MDA-MB-231细胞增殖、凋亡及侵袭蛋白表达水平比较
与对照组和阴性转染组比较,UBE2T-siRNA组细胞蛋白CyclinD1、c-Myc、β-catenin、N-cad表达水平明显降低,E-cad、caspase-9表达水平明显升高(P<0.05),见表4、图6。
表4 各组细胞增殖、凋亡蛋白表达水平比较
续表4 各组细胞增殖、凋亡蛋白表达水平比较

A:对照组;B:阴性转染组;C:UBE2T-siRNA组。
3 讨 论
乳腺癌是威胁妇女健康的杀手,其发病涉及环境、基因、饮食习惯等多方原因。临床治疗主要通过手术、放化疗等,但不可避免使患者丧失乳房完整性,且后续治疗对身心均有不利影响,因此持续探究乳腺癌发病机制有益于丰富临床治疗方案[3]。UPS系统包括泛素(Ub)、泛素激活酶(E1)、泛素结合酶(E2)、泛素连接酶(E3),以及蛋白酶体及其底物蛋白,E1激活Ub C末端,生成硫酯连接的E1-Ub结合物,之后通过转硫反应活化的Ub与E2结合,并通过E3连接至底物蛋白上,不仅能够改变蛋白质的位置、功能,还能影响细胞周期和癌症等相关过程[7]。UBE2T属于泛素结合酶家族,是一种致癌蛋白,UBE2T能够催化Ub与蛋白底物的连接,在癌症中有重要作用[8]。本研究结果表明,乳腺癌细胞系中UBE2T mRNA明显高于正常乳腺细胞,提示UBE2T可能与乳腺癌的发生有关。4个乳腺癌细胞系中MDA-MB-231的UBE2T mRNA表达最高,因此选取MDA-MB-231进行后续实验。
LUO等[9]研究表明,UBE2T在胃癌中有关键作用,UBE2T-siRNA能够促进胃癌细胞SGC-7901的凋亡,抑制胃癌细胞的增殖、侵袭和转移,且裸鼠成瘤实验结果显示,抑制UBE2T的表达能够抑制裸鼠体内肿瘤的形成和生长。ZHENG等[10]研究结果表明,UBE2T在胰腺癌组织和细胞中的表达明显高于正常组织和细胞,且UBE2T过表达明显促进了胰腺癌细胞MIApaca-2,Bxpc-3的增殖、迁移和侵袭,而UBE2T下调抑制了胰腺癌细胞的增殖、迁移和侵袭。罗何三等[11]研究表明,乳腺癌组织中UBE2T mRNA表达明显高于正常乳腺组织,且与患者临床病理特征有关,是乳腺癌预后的不良因素,而UBE2T对乳腺癌细胞的影响还少有研究。本研究结果表明,沉默UBE2T能够抑制MDA-MB-231细胞的增殖,增加细胞凋亡率及G2/M期细胞百分比,降低G0/G1期细胞百分比,说明UBE2T可能是乳腺癌发展过程中的癌基因。LIU等[12]研究表明,抑制UBE2T的表达能够将肝癌细胞SMCC-7721和Huh-7阻滞在G2/M期,抑制细胞的增殖,猜测沉默UBE2T可能通过阻滞细胞周期抑制MDA-MB-231的增殖,具体作用机制有待进一步的研究。
caspase家族是一组存在于细胞质中的半胱氨酸蛋白酶,与真核细胞的凋亡有关。caspase-9是一种典型的凋亡蛋白[13],本研究发现,UBE2T-siRNA组细胞caspase-9表达明显升高,进一步说明沉默UBE2T能够促进MCF-10A细胞的凋亡,具体机制有待进一步研究。β-catenin是一种多功能蛋白,其异常表达会导致癌症的发生。LIU等[14]研究表明,沉默UBE2T能够抑制Wnt/β-catenin信号通路抑制非小细胞肺癌细胞A549、H1299等的增殖和侵袭。Wnt是β-catenin的主要调节器,当Wnt激活时,β-catenin在细胞质中积累,然后转移至细胞核,与T细胞因子4(TCF4)等调节因子结合,促进CyclinD1和c-Myc等蛋白的转录[15]。CyclinD1能够促进细胞周期进程,调节细胞增殖,与癌症的发生、发展有关[16]。c-Myc基因能够促进细胞分裂,使细胞无限增殖,获得永生化功能,与多种肿瘤的发生、发展有关[17-18]。本研究结果表明,UBE2T-siRNA组蛋白CyclinD1、C-Myc、β-catenin的表达明显低于对照组,猜测UBE2T可能通过调控Wnt/β-catenin信号通路,影响CyclinD1、c-Myc的表达,进而促进乳腺癌细胞的增殖,具体机制有待进一步研究。有研究表明Wnt/β-catenin信号通路通过诱导上皮间质转化(EMT)促进肿瘤转移[19]。EMT通过使癌细胞失去上皮特性和获得间充质表型,被认为是促进癌症转移的主要原因之一[20]。N-cad、E-cad是EMT途径的典型标志物。Transwell实验表明,沉默UBE2T能够抑制MDA-MB-231细胞的侵袭,且UBE2T-siRNA组细胞蛋白N-cad的表达明显低于对照组,而E-cad的表达升高,说明沉默UBE2T可能通过抑制EMT途径,抑制乳腺癌细胞的侵袭。
综上所述,沉默UBE2T的表达能够促进乳腺癌细胞的凋亡,抑制乳腺癌细胞的增殖和侵袭,可能是乳腺癌的潜在研究靶点。然而本研究仅在体外条件下,分析了UBE2T对乳腺癌细胞的生物学活性的影响,未深入研究具体机制,是本研究不足之处,下一步需查阅相关资料,进一步探讨UBE2T在乳腺癌发生、发展中的可能机制。

