KLF4通过Wnt信号通路抑制甲状腺癌细胞EMT及侵袭迁移的实验研究
陈 翔,刘利敏,张 琰,陈 勇,屈 悦,徐 宙,陆宝华
(上海市宝山区中西医结合医院甲状腺外科 201999)
甲状腺癌的发生、发展和转移是一个复杂的过程,涉及许多因素。目前关于上皮间质转化(EMT)在甲状腺癌中的研究表明,EMT参与了甲状腺癌的进展[1-2]。EMT过程涉及转录因子、生长因子、信号级联、表观遗传调控和肿瘤微环境等组成的复杂网络。据文献报道,Kruppel样因子4(KLF4)可以通过上调上皮基因表达和下调间质基因表达来调节EMT的进程[3-4]。而在恶性肿瘤中调控这些关键性分子的表达,能促进或抑制细胞的侵袭和转移[5-6]。本课题组前期报道了KLF4在甲状腺癌中的表达及对肿瘤侵袭转移的影响[7]。本研究从Wnt/β-catenin信号通路角度探讨KLF4调节甲状腺癌细胞侵袭和迁移的分子机制,以阐释对KLF4在甲状腺癌侵袭迁移过程的认识。
1 材料与方法
1.1 材料
细胞:甲状腺乳头状癌细胞株KTC1购自武汉普罗赛尔公司(CL-0649)。主要试剂及器材:DMEM培养基购自杭州四季青公司;RNA提取试剂TRIzol购自赛默飞世尔科技(中国)有限公司(15596-026);逆转录试剂盒购自南京诺唯赞生物科技股份有限公司(R101-01/02);PCR引物等由上海擎科生物公司合成;二喹啉甲酸(BCA)试剂盒购自上海碧云天公司(P0010);一抗β-catenin,基质金属蛋白酶7(MMP7)和KLF4均为兔源性单抗购自美国Abcam公司;兔源性多抗上皮型钙黏蛋白(E-cad)和神经型钙黏蛋白(N-cad)分别购自美国Affinity公司和武汉三鹰生物公司;定量PCR仪购自赛默飞世尔科技(中国)有限公司(Quant Studio 6);分光光度计购自杭州奥盛仪器有限公司(Nano-100)。
1.2 方法
1.2.1细胞培养、转染及分组
体外细胞培养密度约为80%,对数生长期消化细胞,接种至培养板,每孔密度约5×105个,培养达80%融合度。慢病毒载体的组装和测试等均由上海GenePharma公司承担。KLF4-siRNA及阴性对照siRNA引物序列为见表1。相关转染操作参阅LipofectamineTM2000说明。将KTC1细胞分成5组:(1)空白对照组,不作任何处理;(2)阴性对照组,转染LipofectamineTM2000;(3)KLF4过表达组,转染LipofectamineTM2000+KLF4;(4)siRNA-NC组,转染LipofectamineTM2000+NC-siRNA;(5)KLF4-siRNA组,转染LipofectamineTM2000+KLF4-siRNA。取5 μL脂质体融入培养液中混匀,在26 ℃下放置20 min。向每个孔中加入200 μL混合溶液,并转移到37 ℃的培养箱中48 h,获得的细胞RNA或蛋白质留待进一步检测。
1.2.2实时荧光定量PCR(qRT-PCR)检测EMT过程中Wnt通路相关基因的表达水平
从对数生长期细胞中提取总RNA后将其逆转录为cDNA,并以cDNA为模板进行PCR扩增。反应体系和反应条件见说明书。E-cad、N-cad、MMP7引物序列见表1,GAPDH为内参,绘制溶解曲线,以计算公式2-ΔΔCt算出EMT相关基因mRNA的表达水平。

表1 引物序列(5′-3′)
1.2.3Western blot检测EMT过程中Wnt通路相关蛋白的表达
提取对数生长期细胞的总蛋白并检测蛋白水平,变性后加样,每孔40 μg,十二烷基硫酸钠-聚丙烯酸酰胺凝胶电泳(SDS-PAGE),重复3次。转膜后添加一抗,然后在冰箱中-4 ℃环境下过夜。24 h后加二抗稀释,37 ℃孵育2 h,洗膜后增强化学发光法(ECL)显像并保存图像,BandScan计算图像的灰度值。
1.2.4免疫荧光检测细胞中KLF4和β-catenin的定位
制作细胞爬片并固定、穿孔,加入正常山羊血清并静置20 min,添加一抗:兔抗KLF4(工作浓度为1∶50),小鼠抗β-catenin(工作浓度5 μg/mL),放入4 ℃湿盒中静置24 h。磷酸盐缓冲液(PBS)清洗后加第二抗体,山羊抗兔IgG(Cy3标记)和山羊抗小鼠IgG[异硫氰酸荧光素(FITC)标记],工作浓度均为1∶100。添加荧光染色剂后在避光条件下进行核染,最后在荧光显微镜下分析和收集图像。
1.2.5蛋白质免疫共沉淀(Co-IP)检测KLF4和β-catenin间的蛋白质相互作用
将KTC1细胞分为3组:KLF4处理组,予以2.0 mmol/L 二硫苏糖醇(DTT)处理24 h;input阳性对照组,加入等体积的裂解液处理;IgG阴性对照组,加入等体积的IgG处理。提取并定量细胞总蛋白500 μg,加入蛋白-A/G琼脂糖珠,静置1 h时。回收上清液,添加兔抗人β-catenin或KLF4单抗(工作浓度均为1∶200),4 ℃孵育24 h。第2天,将蛋白-G琼脂糖珠加入并混合4 h。用低强度放射免疫沉淀法(RIPA)裂解液洗涤并收集琼脂糖珠;加入裂解液和蛋白上样溶液,在99 ℃加热10 min;离心后保留上清液,除去琼脂糖珠,余下步骤与常规Western blot相同。
1.2.6免疫组织化学(IHC)检测甲状腺癌组织及癌旁组织中KLF4蛋白表达
选取本院2019年7-12月甲状腺癌标本45份,均为常规行单侧腺叶+峡部切除或双侧全切+中央区淋巴结清扫。采用SP法检测KLF4的表达水平,第一抗体购自武汉博士德生物有限公司,工作浓度为1∶150。
1.3 统计学处理
2 结 果
2.1 KLF4和β-catenin在KTC1细胞质中的定位
免疫荧光检测结果显示,KLF4显示绿色荧光,β-catenin显示红色荧光,图像叠加后KLF4和β-catenin在部分KTC1细胞质中同时表达,KLF4和β-catenin有部分共定位,见图1。
2.2 各组KTC1细胞EMT过程中Wnt信号通路中相关基因和蛋白表达水平比较
qRT-PCR结果显示,KLF4过表达组E-cad mRNA表达明显高于其他组(P<0.05),N-cad 和MMP7 mRNA表达明显低于其他组(P<0.05);沉默干扰KLF4后,与其他组相比,KLF4-siRNA组中的E-cad mRNA明显降低(P<0.05),N-cad和MMP7 mRNA明显升高(P<0.05),见表2。Western blot结果显示,KLF4过表达组中E-cad表达较其他组明显升高(P<0.05),而N-cad、MMP7表达则明显低于其他组(P<0.05),显示KLF4过表达可以逆转EMT;当沉默干扰KLF4时,上皮标志物减少,间质标志物增加,见表3、图2。
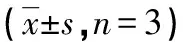
表2 各组KTC1细胞Wnt通路相关基因表达水平比较
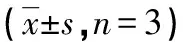
表3 各组KTC1细胞Wnt通路相关蛋白表达水平比较
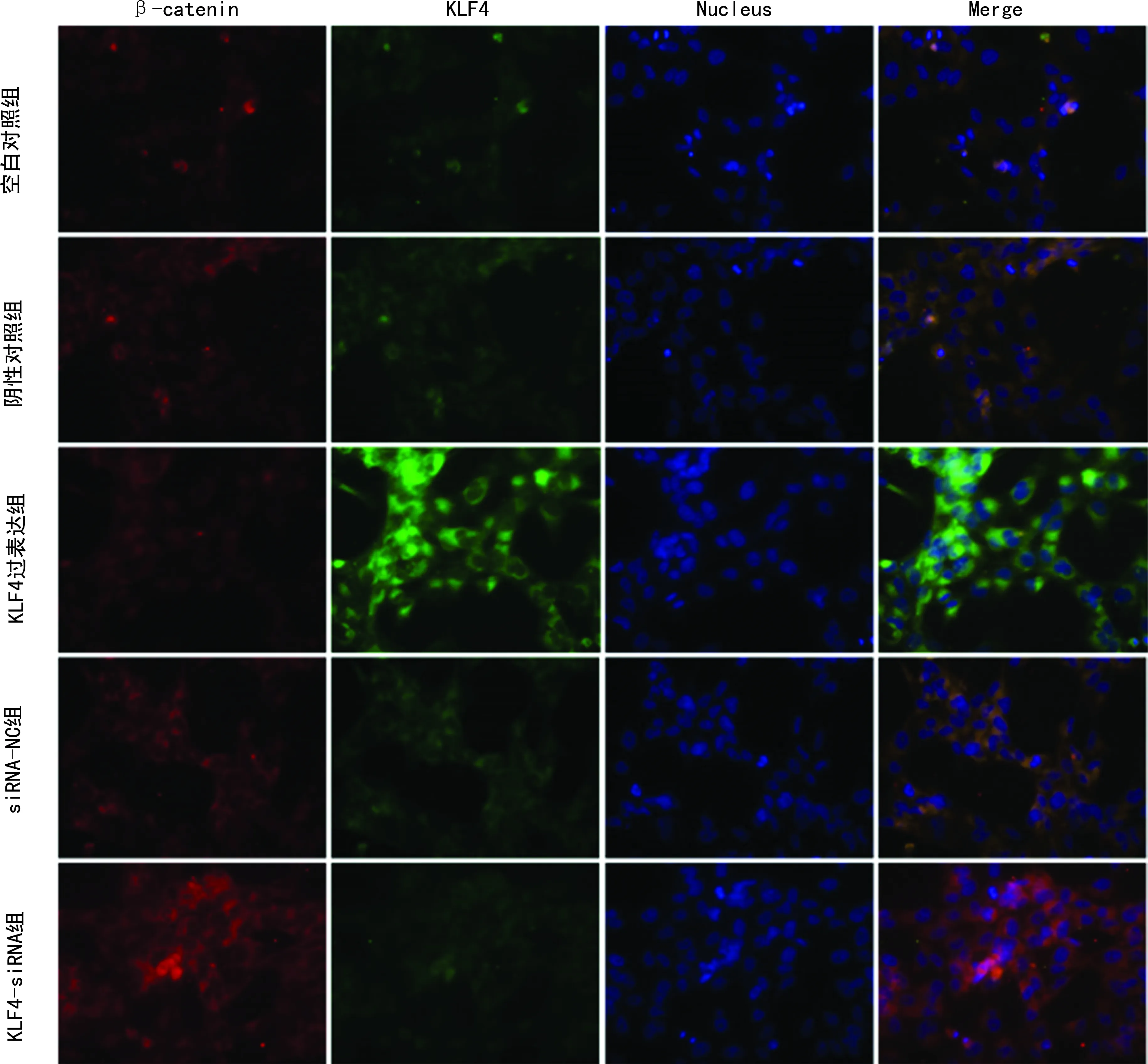
图1 各组细胞中KLF4和β-catenin蛋白表达
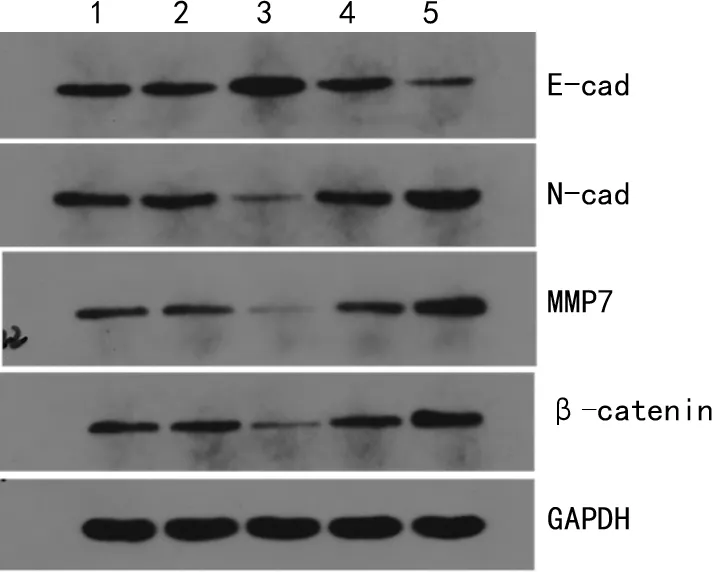
1:空白对照组;2:阴性对照组;3:KLF4过表达组;4:siRNA-NC组;5:KLF4-siRNA组。
2.3 各组KTC1细胞的迁移和侵袭能力比较
Transwell结果显示,KLF4过表达组侵袭和迁移细胞数量最低,而KLF4-siRNA组中侵袭和迁移细胞数量最高(P<0.05),见表4、图3。
2.4 KLF4和β-catenin蛋白间的相互作用
Co-IP结果显示,将KLF4抗体或β-catenin抗体进行正向或反向的Co-IP,均可以检测出KLF4与β-catenin间的相互作用,见图4。
2.5 KLF4在甲状腺癌中的表达情况
KLF4在甲状腺癌及癌旁组织中的阳性表达率分别为24.44%(11/45)和71.11%(32/45),二者比较差异有统计学意义(χ2=19.639,P<0.001)。45份标本中,伴淋巴结转移18份中KLF4表达4份阳性,而不伴淋巴结转移27份中KLF4表达15份阳性,二者比较差异有统计学意义(22.22%vs.55.56%,χ2=4.919,P=0.027)。
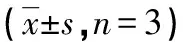
表4 各组KTC1细胞迁移和侵袭细胞数比较
图3 各组KTC1细胞迁移、侵袭情况
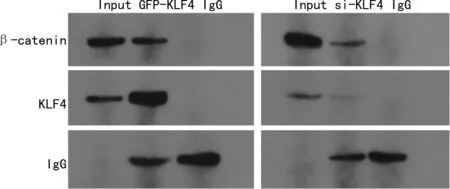
图4 KTC1细胞中KLF4和β-catenin的相互作用
3 讨 论
甲状腺癌总体预后良好,若伴有腺外侵犯和淋巴转移等重要独立预后因素,预后明显不佳[8-9]。EMT在肿瘤的侵袭、血行播散和微转移形成等过程中扮演重要角色[10]。本课题组先前的研究[7]及本次临床标本检测均表明,KLF4在甲状腺癌中低表达,并起着抑癌基因的作用。在本研究中,由于KLF4过表达处理癌细胞后,结果上皮标志物增加,间质标志物减少,并抑制了EMT过程;沉默KLF4表达后,结果却相反,从而加速了EMT的过程。通过临床标本检测发现转移淋巴结KLF4阳性率低,未转移淋巴结阳性率高,可能提示KLF4表达缺失可能促进癌细胞淋巴结转移。表明甲状腺癌中KLF4水平的升高有望在逆转EMT中发挥作用,KLF4可能通过参与甲状腺癌的EMT过程而发挥重要作用。
有研究表明,多个信号通路与EMT相关[11-13]。据文献报道,Wnt/β-catenin信号通路与甲状腺癌细胞的EMT过程密切相关,并起重要作用[14]。KLF4作为一种广泛存在于人体各种组织中的转录因子,可以参与多种细胞生物学行为的调节,并在肿瘤的抑制或发展中发挥作用[15-16],这些差异可能取决于不同的条件和细胞类型。本研究通过Co-IP证实了KLF4下游的信号分子是β-catenin;免疫荧光显示KLF4和β-catenin可以共表达。而且KLF4的过表达可降低β-catenin和N-cad蛋白的表达,增加E-cad的表达,并减弱肿瘤细胞的侵袭和迁移。表明细胞中过量的E-cad可以与游离的β-catenin结合形成结合物,这在一定程度上提高了细胞间的黏附性,而减轻了癌细胞的侵袭性[17]。体外实验表明,癌细胞中β-catenin基因的缺失会削弱细胞的侵袭性[18],推测原因是低水平的β-catenin不能与淋巴细胞增强因子/T细胞因子(TCF/LEF)转录因子有效结合。因此,本研究认为在KTC1细胞过表达KLF4之后,β-catenin表达降低,从而阻止β-catenin与TCF/LEF结合并有效地防止下游靶基因被激活。
与此同时,当KLF4在癌细胞中过表达后,MMP7低表达,这削弱了细胞迁移和侵袭的能力;而将KLF4干扰后,MMP7表达上调,肿瘤的侵袭和迁移能力得到增强。MMP7与恶性肿瘤的侵袭性生长和远处转移有关。VOKA等[19]发现,MMP7是转移性大肠癌敏感性较好的生物标志物,外周血中MMP7的水平与肝转移程度和生存预后密切相关。YUAN等[20]发现,人舌鳞状细胞癌组织中MMP7的表达明显高于非肿瘤组织,且与淋巴结转移有关;细胞试验表明MMP7能提高癌细胞的侵袭能力。本实验中,KLF4过表达可以降低细胞内β-catenin和MMP7蛋白的表达,而KLF4干扰敲除后可促进β-catenin和MMP7的上调,表明KLF4可通过Wnt信号通路调节相关下游靶基因的表达,从而影响了肿瘤的侵袭和迁移能力。
综上所述,本研究认为,在甲状腺癌中,KLF4过表达可以抑制EMT过程,影响肿瘤的侵袭和迁移,并且该过程的实现取决于Wnt信号传导通路的参与和调节。KLF4和甲状腺癌间的关系表明,KLF4可能是有前途的预后标志物,也是甲状腺癌的潜在治疗靶标。

