HIV 筛查试验与确证试验结果比较分析
郭慧娟 陈 勋 张引强 巩瑶瑶 郑 颖 王凤梅 李 琦
1.中国中医科学院西苑医院检验科,北京 100091;2.中国中医科学院西苑医院肝病科,北京 100091;3.河北北方学院医学检验系,河北张家口 075031
艾滋病即获得性免疫缺陷综合征(aquired immune deficiency syndrome,AIDS),是艾滋病病毒即人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染引起的一类疾病[1]。当前,临床上主要使用的HIV 抗体的检测方法包括筛查试验和确证试验。HIV 抗体筛查试验有快速检测法、酶联免疫吸附试验法、化学发光法等,而抗体确证试验包括免疫印迹试验(Western blot,WB)法和条带免疫试验法[2]。HIV 筛查试验是初步判断HIV 感染的常用手段[3]。筛查实验要求高灵敏度,这不可避免会造成一定的假阳性。而确证试验要求高特异性,避免假阳性的出现。所以筛查试验和确证试验相结合,既能防止阳性标本的漏检,又防止假阳性报告的出现。筛查试验采用高敏感性的试剂能够最大限度发现HIV 感染的患者或携带者,确证试验则采用高特异度的方法进一步提高阳性的正确率[4-5]。筛查试验阳性而确证试验阴性为筛查试验假阳性。目前由于筛查试验的高灵敏度,临床出现了一定数量的筛查试验假阳性的标本。本文对筛查试验和确证试验的报告进行分析,探讨HIV 筛查试验与确证试验结果的关系,初步归纳HIV 筛查假阳性的原因。
1 资料与方法
1.1 一般资料
2017—2019 年在中国医学科学院西苑医院(以下简称“我院”)进行HIV 抗体筛查试验,结果呈阳性的标本184 例。184 例标本均送至北京市海淀区疾病预防控制中心(center for disease control and prevention,CDC)进行确证试验,确证试验结果分为阴性、阳性、不确定(184 例标本中有36 例标本确证结果为“不确定”。“不确定”的标本因未全部进行跟踪随访,本研究不进行分析,主要讨论确证试验结果为“阴性”或“阳性”的标本)。确证结果为“阴性”或“阳性”的共148 例标本,其中男95 例,年龄22~90 岁,平均(56±21)岁;女53 例,年龄27~87 岁,平均(50±16)岁。
1.2 纳入标准
①研究对象为2017 年1 月至2019 年12 月在我院就诊的进行HIV 抗体筛查的中国籍患者。②所有研究对象疾病诊断明确,未诊断疾病的患者未纳入。③HIV抗体初筛阳性的标本全部送往北京市海淀区CDC 确证实验室。④根据北京市海淀区CDC 确证实验室对所送检测标本结果分为:确证阴性、确证阳性、确证不确定。
1.3 仪器与试剂
全自动免疫分析仪Roche cobas 8000 及配套罗氏HIV(四代)试剂(批号:47329401)均购自罗氏诊断产品(上海)有限公司。WB 检测仪Tecan(型号:Profi blot 48),检测试剂公司为安倍生物医学亚太私人有限公司(批号:AE9017)。
1.4 研究方法
筛查试验为HIV 抗原和抗体联合检测法。按照试剂说明书判定结果:S/CO≥1 为阳性,S/CO<1 为阴性。确证试验采用WB 检测HIV 抗体。同时符合以下2 条标准判断为阳性:①至少有2 条env 带出现,或至少1 条env 带和P24 带同时出现;②符合试剂盒提供的阳性判定标准。确证报告分为阳性、阴性和不确定。
1.5 统计学方法
采用SPSS 21.0 软件对所得数据进行统计分析。符合正态分布的计量资料以均数±标准差()表示,采用t 检验。计数资料以例数或百分比表示,采用χ2检验或Bonferroni 校正。以P <0.05 为差异有统计学意义。
2 结果
2.1 筛查阳性标本的确证结果
2017、2018、2019 年筛查阳性的标本各60、47 例和77 例。2017—2019 年HIV 筛查阳性标本的确证试验结果比较,差异有统计学意义(P <0.05)。见表1。

表1 2017—2019 年HIV 筛查阳性标本的确证试验结果(例)
2.2 HIV 确证试验阳性例数与HIV 初筛检测总标本数
2017、2018、2019 年确证阳性的标本与在我院初筛检测HIV 抗体的总标本数比较,差异无统计学意义(P >0.05)。见表2。
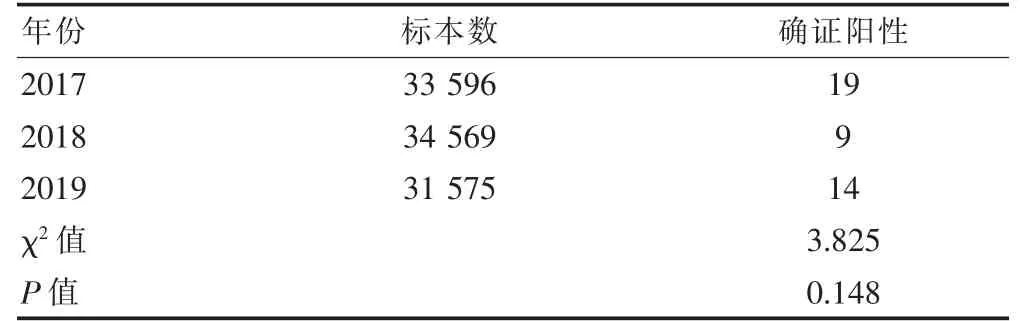
表2 2017—2019 年HIV 确证试验阳性标本与在西苑医院检测HIV 抗体总标本数(例)
2.3 假阳性标本筛查检测值分布特点
把筛查实验阳性确证实验阴性的标本定义为筛查假阳性标本,筛查假阳性标本的筛查结果由低到高分为四组,依次为1≤S/CO<10(102 例,96.23%)、10≤S/CO<50(3 例,2.83%)、50≤S/CO<100(1 例,0.94%)、S/CO≥100(0 例)。
2.4 确证试验阳性标本的筛查检测值分布
确证试验阳性标本(42 例)的筛查S/CO 分为四组,分别1≤S/CO<10(0 例)、10≤S/CO<50(4 例,9.52%)、50≤S/CO<100(3 例,7.15%)、S/CO≥100(35例,83.33%)。
2.5 不同S/CO 组阳性预测值
筛查S/CO 值升高,确证阳性预测值升高,假阳性率降低。见表3。
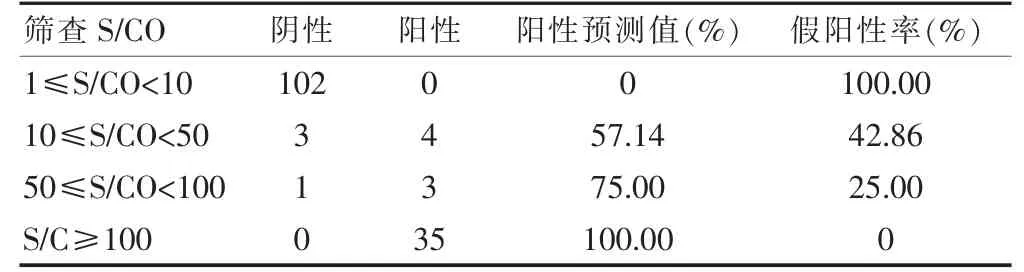
表3 筛查阳性结果与WB 结果比较
2.6 假阳性标本和确证阳性标本的筛查检测值
筛查阳性确证阴性组的筛查S/CO 为(3.41±1.50);筛查和确证皆阳性的筛查S/CO 为(478.78±56.78)。筛查和确证皆阳性的S/CO 值高于筛查阳性确证阴性组S/CO 值,差异有高度统计学意义(P <0.01)。
2.7 2017—2019 年初筛阳性确证试验阴性的病例特征
通过对假阳性患者共106 例进一步分析,2017—2019 年HIV 抗体初筛试验假阳性患者分布特点如下:感染类疾病44 例(41.50%)、心脑血管疾病21 例(19.81%)、先兆流产5 例(4.72%)、自身免疫病8 例(7.56%)、肿瘤7 例(6.60%)、肾脏功能疾病6 例(5.66%)、疱疹病毒感染皮肤病4 例(3.77%)、混合痣3 例(2.83%)、其他疾病8 例(7.55%)。
3 讨论
本研究HIV 筛查检测使用的是罗氏第四代电化学发光检测试剂。电化学发光法和罗氏HIV 第四代试剂高灵敏度叠加,使HIV 抗体检测阳性率得以极大增加[6]。HIV 四代试剂能同时检测HIV(1+2)抗体与P24 抗原。在HIV 感染的早期,通过检测血清或血浆P24 抗原,可以将检测窗口期缩短,故P24 抗原在HIV-1 型早期感染的检测中有重要价值[7]。第四代HIV 检测试剂,在固相载体上同时包被抗P24 的单克隆抗体和HIV 抗原P24,但是载体的表面积是固定的,在检测过程中,吸附到固相载体上的HIV 抗体量和HIV 抗原量均受到限制,导致HIV 抗原和HIV 抗体检测之间发生干扰现象而引起假阳性情况[8]。并且,筛查试验在要求高灵敏度的同时常常伴随着特异度下降[9],即会出现一定数量的假阳性。
2017、2018、2019 年筛查阳性标本假阳性率比较,差异有统计学意义(P <0.05),筛查假阳性率逐年增加。有研究发现,孕妇的HIV 假阳性率升高与近些年就诊者普遍进行HIV 筛查所致的筛查率升高有关[10]。2017—2019 年逐年递增的HIV 抗体筛查假阳性率可能与当前医师和患者对HIV 筛查重视程度有关。此外,2017—2019 年确证阳性的标本与在我院当年所有检测HIV 抗体的标本数比值分别是0.06%、0.03%、0.04%,各年比较,差异无统计学意义(P >0.05)。本研究HIV 抗体阳性率低于海南地区(0.22%)和广东惠州地区(0.11%)的HIV 抗体阳性率[11-12]。这可能是时间、地区和人群的不同造成的差异。
假阳性标本的筛查值集中在1≤S/CO<10,确证阳性标本的筛查值集中分布在S/CO≥100。如果患者HIV 抗体筛查检测值在1≤S/CO<10,要高度怀疑是干扰引起的假阳性。假阳性组筛查S/CO 要明显低于确证阳性组,可见即使干扰引起HIV 抗体筛查假阳性,但是S/CO 数值会在一个比较低的数值。
假阳性组分布在不同的疾病中。有很多学者认为,高浓度的异嗜性抗体与HIV 检测试剂发生非特异性交叉反应,是HIV 筛查试验出现假阳性的原因[9]。由于HIV 结构复杂,具体是何种蛋白质引起的异嗜性抗体增加,从而引起交叉反应造成筛查试验假阳性,目前还不十分明确[13]。吴志奇等[14]在HIV 诊断试剂假阳性原因分析中认为血液病、肿瘤、老年心脑血管疾病可能对HIV 抗体有影响。有报道称接受血液透析的肾功能衰竭患者体内增高的自身抗体可使HIV 检测呈假阳性[15]。此外,越来越多的研究发现自身免疫性疾病相关的自身抗体是导致HIV 筛查假阳性的原因之一[16-18]。类风湿性关节炎患者HIV 的假阳性率与类风湿因子和抗环瓜氨酸抗体的高效价相关[16,19]。有报道认为妊娠是HIV 筛查假阳性的危险因素,原因可能是由于妊娠期纤维蛋白浓度增高[20],纤维蛋白原的聚集可非特异性地结合试剂中的HIV 抗体,干扰HIV筛查检测结果[21-23]。同时,由于孕妇体内存在其他抗体的干扰,导致HIV 抗体检测也可能出现假阳性[24-25]。报道显示,肝病、病毒感染会引起HIV 抗体确证检测出现不确定性[26-27]。还有报道银屑病也会导致HIV 筛查出现假阳性[17]。
综上所述,HIV 筛查试验受到多种干扰因素的影响,易出现假阳性结果。如果临床患者出现较低数值的S/CO,应怀疑是否存在干扰因素,在确证结果之前,对患者做好沟通和解释工作,减轻患者的心理压力和负担。

