解毒通络调肝方对INS-1细胞糖毒性的保护作用研究
张琦 靳雯棋 张乃文 安珊 徐慧琛 朴春丽
目前,中国糖尿病的发病率飞速增长,根据最新全国流行病学调查报告,其形势不容乐观,成年人患病人数约为1.298亿[1]。因此防治糖尿病刻不容缓。糖尿病及其并发症的发生皆与β细胞数量减少及功能损伤直接相关[2],长时间暴露在高糖之下会诱发β细胞凋亡[3]。目前越来越多的研究表明,内质网应激与胰岛β细胞的功能和数量密切相关[4]。胰岛β细胞具有高度发达的内质网,而内质网膜上有3种跨膜蛋白,即:阻抗性激酶lα(inositol-requiring enzyme 1α,IRE1α)、双链RNA依赖性蛋白激酶样内质网激酶(protein kinase R -like endoplasmic reticulum kinase,PERK)和活化的转录因子6(activating transcription factor 6,ATF6)[5],这3种跨膜蛋白是能引起未折叠蛋白反应的效应蛋白[6]。当机体处于高糖环境时,内质网未折叠或错误折叠蛋白增多,导致其功能紊乱,即而发生未折叠蛋白反应。当未折叠蛋白质在内质网中积累时,IRE1α、ATF6、PERK 3条信号通路就会被激活,从而介导胰岛细胞的损伤[7]。因此,在治疗2型糖尿病(type 2 diabetes mellitus,T2DM)时,从调控内质网应激方面入手将会成为一个新的治疗方向。
糖尿病属于中医“消渴”范畴,其发生发展与肝脏关系密切,“从肝论治”已成为中医治疗糖尿病的重要理论依据之一[8]。解毒通络调肝方是基于“毒损肝络”理论确立治疗T2DM的有效方剂,在前期的大量临床试验中验证[9-10],解毒通络调肝方对T2DM及其并发症的患者治疗效果明显,具有促进糖脂代谢、缓解临床症状的作用。前期基础实验研究证明解毒通络调肝方可改善糖脂代谢及胰岛素抵抗,抑制其胰腺组织细胞凋亡[11-12]。本研究采用体外培养的大鼠胰岛β细胞株[大鼠胰岛细胞瘤细胞(islet cell tumor cell,INS-1)],观察解毒通络调肝方对高糖诱导的INS-1细胞损伤和对胰岛β细胞保护的影响,并从内质网应激角度探究其可能机制。
1 材料与方法
1.1 细胞与药物
INS-1细胞购于中国科学院上海生命科学研究院细胞资源中心。将细胞株培养于含10%的1640 培养基中,在37℃,95%湿度,5%CO2培养箱中培养。采用对数生长期细胞进行后续实验。
解毒通络调肝方,药物组成:黄连 15 g、榛花10 g、酒大黄 6 g、黄芪15 g、丹参15 g、柴胡10 g,粉碎后加水3次,每次煮沸1小时,调节pH值为7,过滤2次,浓缩至2 g/mL,微孔膜过滤。在精制药液中加入10%甘露醇,并将溶液的pH值调节至6~7,在-50℃下预冻4小时,在-20℃下升华14小时,在30℃下干燥10小时,获得的冻干样品。之后将药物冻干粉溶于1640培养基中,按照中药冻干粉终浓度分为低剂量组50 μg/mL、中剂量组100 μg/mL、高剂量组200 μg/mL,由广州中医药大学深圳医院(福田)制剂室提供,4℃保存。
1.2 主要试剂
1640 培养基及胎牛血清,Gibco 公司;大鼠胰岛素Elisa试剂盒购,罗氏生物科技有限公司;噻唑蓝(MTT),Sigma公司;反转录试剂盒及RT-PCR 试剂盒,天根生物公司;引物,上海生物工程技术服务公司;GAPDH、IRE1α、ATF6、PERK抗体以及羊抗兔、羊抗鼠,美国CST中国公司。
1.3 主要仪器与设备
二氧化碳细胞培养箱,美国Thermo公司;超净工作台,山东博科生物产业有限公司;离心机,德国Eppendorf公司;倒置显微镜,日本尼康公司;电泳仪、PCR仪、转膜仪,美国Bio-Rad公司;Infinite 200 PRO 酶标仪,瑞士Tecan公司;化学发光仪,GENE公司。
1.4 分析解毒通络调肝方中化合物的理化性质
药物的化学和分子性质主要由分子量(molecular weight,MW)、口服生物利用度(oral bioavailability,OB)、药物相似性(drug similarity,DL)、氢键供体原子数(number of hydrogen bond donor atoms,Hdon)、氢键受体原子数(number of hydrogen bond acceptor atoms,Hacc)和辛醇-水分配系数(octanol-water partition coefficient,LogP)决定[5]。因此从TCMSP数据库中提取其参数,并分析各成分的性质。
1.5 细胞培养与分组
将INS-1细胞培养于含10%胎牛血清的1640培养液中,置于37℃、5% CO2饱和湿度培养箱中,待细胞生长至近融合时,通过胰蛋白酶消化细胞,1∶3传代,并用于后续实验。关于细胞分组,取对数期生长的INS-1细胞,用胰酶消化后,制备单细胞悬液,将其接种于新的培养板,24小时后弃培养液,细胞分为对照组、高糖诱导的模型组、解毒通络调肝方不同浓度治疗组(50 μg/mL、100 μg/mL、200 μg/mL),每组设置3个复孔。孵育24小时后收集,检测各项指标待用。
1.6 MTT法检测细胞的存活率
将对照组、解毒通络调肝方组(50、100、200 μg/mL)的细胞,以1×104/孔接种于96孔培养板,培养24小时,弃去培养板中的上清,每孔加入100 μL浓度为0.5 mg/mL的MTT溶液后,避光培养4小时,将MTT溶液弃去后,向每孔加入DMSO(150 μL/孔),振荡5分钟后用酶联免疫检测仪测定490 nm处的吸光值,经过计算即可得到细胞存活率。
1.7 胰岛细胞功能相关基因mRNA表达水平检测
采用Trizol 试剂提取各组细胞中总RNA。然后用Infinite 200 PRO 酶标仪测量RNA的纯度和完整性。使用PrimeScript RT试剂盒将2 μg总RNA逆转录成cDNA。RT-PCR采用SYBR Green PCR主混合物和Bio-Rad CFX96实时PCR检测系统进行。热循环条件包括40个循环:在95℃下变10秒,在60℃下退火10秒,在72℃下延15秒。对每个基因的PCR产物进行了相对定量分析,计算每个PCR产物条带强度与GAPDH强度的相对比率。引物序列见表1。
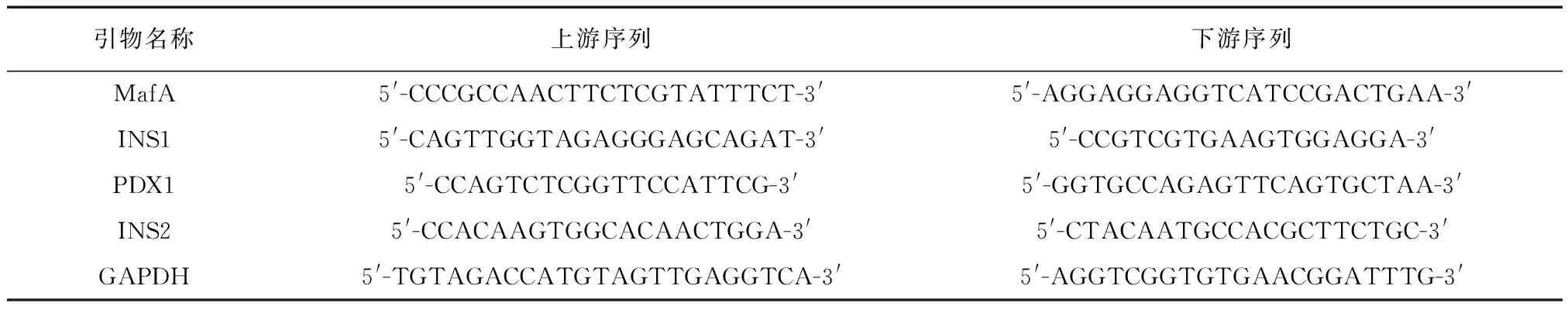
表1 引物序列
1.8 葡萄糖刺激胰岛素分泌实验
除对照组以外,其余各组细胞更换含20 mM的高糖培养基,PBS清洗,加500 μL无糖的 KRB Buffer 孵育1小时。弃掉上清,加500 μL含5 mmol/L(低糖)或20 mmol/L(高糖)葡萄糖的KRB Buffer,继续孵育1小时之后,收集上清液,利用ELISA试剂盒检测,按照说明书具体操作步骤绘制标准曲线,于酶标仪450 nm读值,并将所得的吸光度值分别代入标准曲线的直线方程,计算各组细胞上清液中胰岛素水平。
1.9 内质网应激相关蛋白表达水平检测
用Western blot法分别检测ATF6、PERK和IRE1α蛋白在各组细胞中的表达情况。收集分组培养后的细胞,用4℃预冷的裂解液裂解细胞10分钟,用BCA蛋白定量试剂盒测试浓度,将其蛋白变性,而后SDA-PAGE电泳,电泳后蛋白质转膜,膜转至封闭液中1小时。一抗用封闭液1∶1000稀释,后于4℃摇床孵育过夜。然后TBST漂洗5次,每次3分钟,清洗后,二抗室温孵育1小时,TBST再次漂洗5次,每次3分钟。在膜表面均匀滴加化学发光液(A液∶B液为1∶1),避光反应1~2分钟。曝光显影,采集图像。通过软件分析蛋白表达水平。
1.10统计学处理
2 结果
2.1 解毒通络调肝方组分分析
从TCMSP数据库中总结并可视化了解毒通络调肝方中潜在成分MW、LogP、Hdon、Hacc、OB和DL的性质。值得注意的是,解毒通络调肝方中每种草药的潜在化合物的物理和化学性质是一致的。如图1所示,潜在成分的分子量集中在100~1000之间,这些活性成分的LogP范围为-3~11。对于DL和OB,课题组发现DL和OB分别集中在0.1~0.9和10~90之间。Hacc和Hdon均小于13。总的来说,解毒通络调肝方的这些活性成分是具有小分子量和亲水性的复杂化合物。

图1 解毒通络调肝方中每种草药的化合物的理化性质
2.2 解毒通络调肝方对INS-1细胞存活率的影响
采用MTT法检测不同浓度的解毒通络调肝方对INS-1细胞存活率的影响。如表2所示,与对照组相比,不同浓度的解毒通络调肝方的细胞存活率不具有统计学差异(P>0.05),说明不同浓度的解毒通络调肝方(50、100、200 μg/mL)对INS-1细胞存活率无明显影响。
表2 不同浓度的解毒通络调肝方对INS-1细胞存活率的影响
2.3 解毒通络调肝方对INS-1细胞的胰岛素分泌功能的影响
利用GSIS方法对INS-1细胞的胰岛素分泌量进行检测。结果显示,在高糖刺激下,模型组的胰岛素分泌水平较对照组下降了50%左右,且具有显著性差异(P<0.01)。用解毒通络调肝方处理后,INS-1细胞的胰岛素分泌增加,与模型组相比分别增加了24.7%、35.17%、49.1%。实验结果表明不同浓度的解毒通络调肝方均能增加INS-1细胞的胰岛素分泌量, 且随着解毒通络调肝方浓度的增大,呈现出一定的剂量依赖性。见表3。
表3 解毒通络调肝方对INS-1细胞胰岛素分泌功能的影响
2.4 解毒通络调肝方对INS-1细胞中INS1、INS2、PDX1、MafA mRNA表达的影响
通过检测胰岛素合成相关基因的表达发现,模型组INS-1细胞中INS1、INS2、PDX1、MafA 的mRNA 与空白组相比,表达水平降低,差异有统计学意义(P<0.01);不同浓度的解毒通络调肝方显著抑制INS1、INS2、PDX1、MafA的mRNA的降低,差异有统计学意义(P<0.01),而且随着解毒通络调肝方浓度的增加,其作用效果愈加明显。说明解毒通络调肝方是通过提高胰岛素合成相关基因的表达,来增加胰岛素的分泌。见表4。
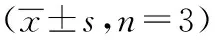
表4 解毒通络调肝方对INS-1细胞中INS1、INS2、PDX1、MafA mRNA表达的影响
2.5 解毒通络调肝方对INS-1细胞PERK、ATF6、IRE1α蛋白表达的影响
与空白组比较,模型组细胞中IRE1α、PERK以及ATF-6的蛋白水平显著升高,差异有统计学意义(P<0.01),提示在高糖诱导下,内质网应激信号通路被异常激活。与模型组相比,不同浓度的解毒通络调肝方组中的IRE1α、ATF6以及PERK的蛋白水平表达呈剂量依赖性下降,差异有统计学意义(P<0.05,P<0.01),表明解毒通络调肝方能抑制INS-1细胞中内质网应激相关蛋白的表达,缓解内质网应激。见图2、表5。
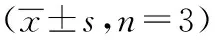
表5 解毒通络调肝方对INS-1细胞PERK、ATF6、IRE1α蛋白表达的影响

注:A:空白组;B:模型组;C:中药低剂量组;D:中药中剂量组;E:中药高剂量组。
3 讨论
T2DM发病率呈逐年上升的趋势,其发病可影响患者的生活质量[14],其中高血糖是糖尿病的主要临床表现之一。当长期血糖升高,即发生葡萄糖毒性,胰岛素的合成增加,造成合成与折叠的不平衡,可诱发内质网应激[15],胰岛β细胞则会受到不可逆的损伤,启动凋亡程序,造成β细胞绝对数量减少[16]。胰岛β细胞是机体唯一可以合成并分泌胰岛素的细胞,促进胰岛素合成与分泌是增强胰岛β细胞功能的主要作用方式。因此,抑制高糖诱导的胰岛β细胞损伤和胰岛素抵抗是防治T2DM的有效途径之一。
《金匮要略·心典》曰:“毒,邪气蕴结不解之谓。”糖尿病属中医“消渴”范畴,其发生同样离不开“毒”[17],消渴患者过食肥甘厚味,体内水谷精微物质过盛产生“糖毒”“脂毒”等。“毒”与“络”关系密切,经络是毒邪传变之通道,藏身之府第。《灵枢·本脏》言:“肝脆则善病消瘅易伤。”肝主疏泄,调畅气机,调节全身气血津液的输布及经络的调达,与糖尿病的发生也有着密切的关系[18]。“毒损肝络”使气血逆流,引发气血津液的运化失常,导致水谷精微生成、输布和排泄出现障碍,继而发生消渴。该理论的生物学内涵不仅包含痰、湿、浊、瘀等“宏观之毒”,其深层机制还更应侧重于在组织细胞层面上对“微观之毒”的研究。课题组认为“微观之毒”可能与细胞器损伤及细胞功能结构紊乱导致的内质网应激、细胞损伤等密切相关,基于以上学说,提出的解毒通络调肝法是治疗“毒损肝络”引起的消渴病的有效治疗方法,并创制解毒通络调肝方用于治疗T2DM,全方共奏清热祛浊,化瘀通络,解毒调肝,畅达气机,推陈出新之功,探索“毒邪”理论中“微观之毒”清除的生物学内涵。现代药理研究表明,方中多味药具有降糖、降脂、减脂、抗炎的功效[19-20]。以上皆为运用解毒通络调肝方从“毒损肝络”角度来论治糖尿病提供了理论依据。
解毒通络调肝方出自“毒损络脉”理论,是临床治疗T2DM的有效方剂,但解毒通络调肝方对胰岛β细胞功能的保护作用机制尚未阐明。胰岛受损会导致胰岛细胞的功能紊乱,从而影响胰岛素的正常分泌。PDX1促进胚胎期胰芽形成,MafA促进β细胞最终成熟,对胰岛的发育有着重要的影响[21]。INS1、INS2 基因编码前胰岛素原,与体内胰岛素的浓度密切相关[22]。本研究通过检测与胰岛细胞功能相关的关键基因(PDX1、MafA、INS1、INS2)的mRNA的表达水平和GSIS实验,结果表明,高糖可以抑制胰岛素的分泌,而解毒通络调肝方能够有效的提高胰岛素的分泌量,进而能够改善高糖诱导的β细胞功能。内质网应激则是细胞正常生理状态及病理状态下常会遭遇到的重要负性事件,已被广泛认为是诱导细胞损伤的重要内源性信号途径之一[23]。内质网应激一方面可减少细胞内转录因子表达、前胰岛素生物合成加工的速度,降低胰岛素的合成与分泌能力;另一方面可抑制β细胞增殖并促进其凋亡直接减少β细胞的数量,最终导致机体胰岛素分泌不足[24]。本研究表明,高糖环境能够激活内质网应激相关的蛋白质(IRE1α、ATF6、PERK)过度表达,引起INS-1细胞的凋亡和功能紊乱,而解毒通络调肝方能够使内质网应激相关的蛋白质的表达水平下调,并与模型组有统计学差异。说明解毒通络调肝方能够抑制内质网的过度激活,进而促进INS-1细胞的存活。
综上,解毒通络调肝方是通过调节肝之疏泄,疏通气血经络,排除“糖毒”,使脏腑功能平衡以治疗T2DM,且其作用机制是提高胰岛素合成相关基因的表达,促进INS-1细胞的胰岛素分泌,降低内质网应激,以恢复细胞内稳态平衡,减少糖毒性对β细胞损伤。为深入了解内质网应激与糖脂代谢紊乱的机制关联提供了新的线索,从而使该途径成为T2DM的潜在治疗靶标,为防治T2DM的有效途径和策略提供理论基础和实验依据,至于内质网应激介导的具体相关信号通路有待后续进一步实验验证。

