小鼠肝炎病毒感染对shh等基因改造小鼠生殖性能的影响及其相应净化方案
关升起*
(苏州大学实验动物中心 江苏·苏州 215123)
小鼠肝炎病毒(Mousehepatitisvirus,MHV)属于冠状病毒科,冠状病毒属,为单股RNA病毒,是已知冠状病毒中体积最大的一个。其病毒粒子呈球形,外有囊膜,外包膜突起呈放射状排列。根据不同的感染嗜性,小鼠常可分为呼吸株和嗜肠株两型,其中,嗜肠株极少扩散至其他组织,而呼吸株可在肝脏与神经系统中复制。多数情况下,MHV呈隐性感染,但在应激因素刺激下,可引发严重肝炎及神经症状,并发展成为急性致死性疾病[1]。
目前,国内外均鲜见关于MHV感染影响生殖系统功能的报道,但经过连续8年对苏州大学外来隔离检疫及委托人工辅助生殖小鼠的情况进行分析,发现MHV感染显著影响部分基因改造小鼠的生殖系统功能。由于MHV可通过胎盘将病毒从母体向胎鼠垂直传播,本研究利用小鼠受精3.5天前胚胎外层完整的透明带的屏障作用,对患病小鼠采用体外受精+胚胎移植的方法进行净化。结果表明,净化得到的小鼠,其生殖系统功能可恢复至与同背景野生型的平均水平。
1 材料与方法
1.1 实验动物
委托我中心进行隔离检疫及净化保种的基因修饰实验小鼠;购自上海斯莱克实验动物有限公司的ICR雄鼠、C57BL/6J供卵小鼠、ICR代孕雌鼠。
1.2 主要试剂
孕马血清促性腺激素(PMSG)和绒毛膜促性腺激素(HCG)购自宁波三生;自配输卵管液培养试剂(HTF);Mouse hepatitis virus (MHV)Elisa kit试剂盒购自XpressBio公司。
1.3 主要仪器
二氧化碳培养箱(Thermo)、体视显微镜(OLYMPUS)、倒置荧光显微镜(OLYMPUS)、相位差显微镜(Leica)、生物显微镜温控仪(南京凯尔)、冰箱(海尔)、精密电子天平(上海舜宇)。
1.4 方法
1.4.1 结扎雄鼠
ICR雄鼠按照0.6mL/20g体重的剂量腹腔注射1.2%三溴乙醇进行麻醉。待小鼠进入深度麻醉状态,固定四肢,仰卧位腹部剃毛,在小鼠双股近心端高点连线于腹中线两侧对称剪开1cm切口;找到包裹睾丸的脂肪团,将脂肪团和睾丸一起拉出腹腔;依睾丸位置,找到输精管,用红外线加热器加热弯口镊至发红,烧灼切断输精管;将输精管、睾丸还纳腹腔;依次缝合小鼠的肌层和表皮。将缝合好的小鼠放在待苏醒笼盒中,笼盒下以温控仪37℃加热,等待小鼠复苏。小鼠完成结扎后,单独饲养1个月后方可使用。
1.4.2 供卵鼠的激素处理
本实验采用胚胎发育的二细胞期进行移植。鉴于二细胞胚胎移植的实验周期为5天,本研究选择在每周的第一天,即周一开始实验。周一的17:00,选3-5周健康同背景野生型雌鼠,腹腔注射5IUPMSG;周三17:00,对已注射过PMSG的雌鼠,腹腔注射5IU HCG。
1.4.3 精卵体外受精
(1)周四8:00,取待净化雄鼠,按照0.6mL/20g体重的剂量腹腔注射1.2%三溴乙醇麻醉;仰卧位腹部剃毛,在小鼠双股近心端高点连线于腹中线两侧对称剪开1cm切口;剪下附睾尾,放入装有300 LHTF试剂的0.5mL EP管中。
(2)超净台内打开EP管,取出附睾尾;将附睾尾放置在高压灭菌过的滤纸上,吸取附着的液体、血液和脂肪;左手以显微镊夹起附睾尾,右手以显微镊紧靠左手显微镊夹取附睾尾的位置夹紧,左右手交替重复操作使附睾尾缓缓绷紧;以耳用探针挑破绷紧的附睾尾外壁,使小鼠精子涌出并在附睾尾外壁形成白色突起;更换新的显微镊小心夹取突出附睾尾外壁的顶端精子,放入已经 CO2平衡过的HTF液滴,将装有HTF液滴的平皿放入CO2培养箱中温育,30min后取出,检查精子质量。
(3)周四8:00,取注射过PMSG及HCG的供卵雌鼠安乐死;仰卧位,剪开小鼠腹腔,找到小鼠子宫,再沿着子宫找到两侧的卵巢和输卵管;在保证输卵管膨大部完整的情况下,剪下输卵管,并置于灭菌滤纸上吸干附着于上的血液、脂肪和组织液。
(4)将输卵管置于已经过CO2平衡过的HTF液滴的矿物油保护层中,剥开膨大部,挑出带有卵丘细胞的小鼠卵细胞团,放入HTF液滴中。
(5)使用移液器,从检查过小鼠精子质量的液滴边缘处,吸取6 L小鼠精子,加入小鼠卵细胞的HTF液滴中,然后,将载有液滴的平皿放入CO2培养箱中温育6小时。
1.4.4 胚胎移植
小鼠精子与卵子混合温育6小时后,取出载有HTF液滴的平皿,置于显微镜下,挑选排出第二极体或形成雄原核的受精卵,以口吸管移入新的HTF液滴,置于CO2培养箱中温育至次日8:00。
次日8:00,即周五8:00,从CO2培养箱中取出装有受精卵的HTF液滴,挑选并计数二细胞数量。麻醉准备好的与结扎雄鼠合笼的见栓假孕雌鼠,侧卧位,暴露并固定卵巢和输卵管,将发育至二细胞的受精卵,经输卵管伞部注入小鼠输卵管的膨大部。逐层缝合,将小鼠放入置于37℃热台上的小鼠笼盒中,护理小鼠,直至小鼠苏醒。
1.4.5 小鼠肝炎病毒的检测及净化评判标准
净化得到的F1代小鼠发育至5周龄时,每胎随机选取F1代小鼠1-2只与代孕雌鼠一同使用ELISA法检测小鼠肝炎病毒。若检测鼠体仍有肝炎病毒存在,则判定净化结果为不合格,重新净化;若鼠体无肝炎病毒,保留小鼠并扩繁,待F2代小鼠发育至5周龄时,随机选取F2代小鼠再次检测,若仍合格,则认为净化成功。
2 结果
2.1 小鼠肝炎病毒感染整体呈现增长趋势
对2012年至2019年送我中心隔离检疫小鼠及此期间委托我中心进行生物净化小鼠的鼠肝炎病毒患病情况进行分析,发现小鼠肝炎病毒病整体呈现上升趋势,如图1(由于疫情影响,2020年送我中心隔离检疫小鼠与委托净化小鼠的数量都大幅减少,故未将2020年的数据加入统计)。

图1:2012至2019年苏州大学实验动物中心外源动物感染小鼠肝炎病毒与接收净化情况
2.2 小鼠肝炎病毒感染导致小鼠精子质量的下降
通过对不同小鼠的精子进行比较,发现感染小鼠肝炎病毒的基因改造小鼠,其精子受精能力显著下降,如图2。其在体外受精6h时排出第二极体与形成雄原核(图2B、2E)的数量明显少于相同背景健康的 C57BL/6J野生型(WT)小鼠(图2A,1号为第二极体排出阶段,2号为雄原核形成阶段),在体外受精24h时二细胞(图2D、2F)占比也明显少于相同背景健康的C57BL/6J野生型(WT)小鼠(图2C)。
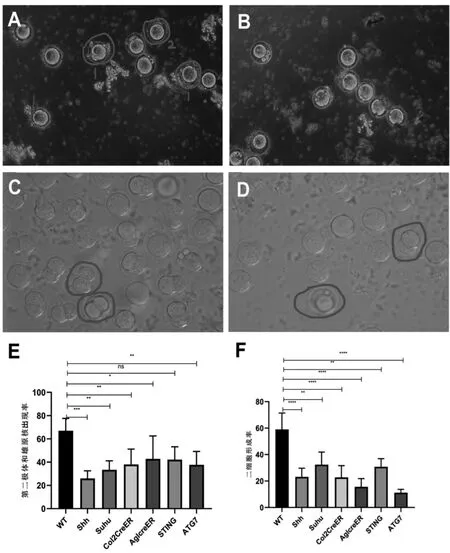
图2:患病基因改造小鼠精子的精卵结合率情况
2.3 小鼠肝炎病毒感染导致小鼠繁殖周期延长
通过对净化前后小鼠的繁殖周期进行对比,发现感染小鼠肝炎病毒的小鼠,其繁殖周期明显延长;而净化后的小鼠,其繁殖周期可恢复至同环境同背景的健康C57BL/6J野生型小鼠(WT)水平,如图3。

图3:小鼠净化前后繁殖周期对比
2.4 小鼠肝炎病毒感染导致小鼠每胎产仔数减少
通过对净化前后小鼠的每胎产仔数进行对比,发现感染小鼠肝炎病毒的小鼠,其每胎产仔数明显减少;而净化后的小鼠,其每胎产仔数可恢复至同背景的健康C57BL/6J野生型小鼠(WT)水平,如图4。

图4:小鼠净化前后每胎产仔数对比
2.5 小鼠肝炎病毒感染导致小鼠的每胎离乳数减少
通过对净化前后小鼠的每胎离乳数进行对比,发现感染小鼠肝炎病毒的小鼠,其每胎离乳数明显降低;而净化后的小鼠,其每胎离乳数可恢复至同背景的健康C57BL/6J野生型小鼠(WT)水平,如图5。

图5:小鼠净化前后每胎离乳数对比
3 讨论
根据以往的报道,小鼠肝炎病毒(MHV)可引起脑膜脑炎、脊髓炎、肝炎、视神经炎,可引发视神经轴突丢失和脱髓鞘[3,4]。目前,此病毒常分为呼吸株(respiratory MHV strain)和嗜肠株(enterotropicMHVstrain)。呼吸株 MHV,即,MHV-1、MHV-2、MHV-3、MHV-JHM(MHV-4)、MHVA59,和MHV-S毒株,最初在鼻呼吸和嗅觉上皮中复制,随后可传播至肺、肝、骨髓、脑、淋巴组织和生殖系统器官,并在其中复制。嗜肠株,即MHV-D、MHV-DVIM、MHVY,和MHV-RI毒株,主要感染肠道,偶尔可扩散到肝脏,淋巴组织和脾脏[5,6]。呼吸株和嗜肠株的小鼠肝炎病毒在多数情况下均呈隐性感染;少数情况下,MHV在应激因素刺激也可导致急性致死性疾病,在临床上通常可分为急性肝炎型和神经型。
目前,虽然有MHV可感染生殖细胞的报道,但有关小鼠肝炎病毒影响小鼠生殖繁育能力的报道尚鲜有见到。
本研究根据连续8年对 MHV单一感染小鼠进行比较,分析发现MHV很可能也会对某些基因改造小鼠的繁殖性能产生显著影响。如:相比于同背景健康C57BL/6J野生型小鼠(WT)繁殖周期的66.09±18.39天,MHV感染后的基因改造小鼠的繁殖周期延长至110.78±23.97天。而相比于同背景健康C57BL/6J野生型小鼠(WT)平均每胎产仔5.45±1.29只,MHV感染后的基因改造小鼠的每胎产仔数仅为2.00±1.20只。
导致患病小鼠繁殖周期延长的原因,可能是此株MHV入侵神经系统使雄鼠性欲降低(这种推测通过小鼠合笼后雌鼠的阴道栓和阴道涂片进行分析,但目前此部分的数据并不完整,无法进行分析)。而导致患病小鼠平均每胎产仔数下降的原因,很可能是由于此株MHV感染降低了雄性小鼠的精子质量。研究通过对比 WT小鼠与患病小鼠精子体外受精6小时有效受精卵占比和体外受精24小时二细胞占比,发现患病小鼠6小时有效受精卵占比和体外受精24小时二细胞占比,均明显(平均百分比分别为 36.48±12.53%和 21.02±9.57%)低于 WT 小鼠的66.94±11.91%和59.08±7.32%。这说明,至少在精子的体外受精能力方面,患病雄性小鼠已经出现了显著的下降。
至于同背景健康C57BL/6J野生型小鼠(WT)平均每胎离乳小鼠4.73±1.49只,患病小鼠的平均每胎离乳数仅为1.09±1.57只(个体差异巨大导致标准差大于平均值)的情况,则很可能是MHV对哺乳期仔鼠的致死作用所导致的。
同时,研究也发现,以体外受精+胚胎移植的方式对患病小鼠进行净化是有效的。根据比较净化前后的基因改造小鼠的繁殖能力,发现净化后的小鼠,其平均繁殖周期可由患病中的110.78±23.97天缩短至65.89±23.33天,平均每胎胎产仔数可由患病中的 2.00±1.20只提高至5.24±1.56只,平均离乳数可由患病中的1.09±1.57只提高至 5.08±1.41只。
综上,虽然MHV对生殖系统的具体致病机理尚不清楚,但研究发现,其对小鼠精子受精率的阻碍作用是显著的。这可能意味着MHV出现了新的病毒株,也可能意味着已发现的MHV毒株,在感染部分基因改造小鼠后,可使其产生显著的生殖功能抑制。
下一步研究,将对致生殖能力下降的病毒株进行完整测序,以判断其是否发生了变异,并加强MHV对更多不同实验小鼠的研究。

