暗场光散射技术在肿瘤标志物检测中的应用
郑向江 赵泽娟 满 意 霍孟田 杨 萍
(山东省肿瘤标志物检测技术重点实验室,临沂大学 化学化工学院,山东 临沂 276005)
近年来,暗场光散射技术极大地吸引了人们的兴趣,被广泛应用于探测化学反应[1-2],实时光学传感[3],金属离子的高灵敏度定量[4],单细胞水平的成像等[5]领域。暗场光散射技术主要基于等离子探针的局域表面共振效应的原理(如图1),利用暗视野显微镜(Dark field microscope,DFM)能够有效地捕捉探针的散射光信息,一方面靶引发纳米颗粒的聚集,引起散射光颜色的改变,可以对特征光点进行计数,建立起与靶标浓度相关的工作曲线,用来对肿瘤标志物靶标进行定量检测;另一方面与靶标相关的纳米颗粒微环境的改变,会影响散射光谱的变化,特别是强度的改变和峰位置的偏移。分析肿瘤标志物靶标与散射光谱变化的关系,也可以达到检测靶标的目的。[6-8]暗场光散射技术具有非常突出的优点:暗场光散射成像无背景干扰,靶标的细微结构可以突出显示在成像中,适合颗粒、细胞等小尺度界面的观测;常用的探针主要是贵金属纳米颗粒,光学性质非常优良,所处环境的轻微改变都能引起等离子光谱强度或者峰位置的改变,有利于对靶标的分析检测。
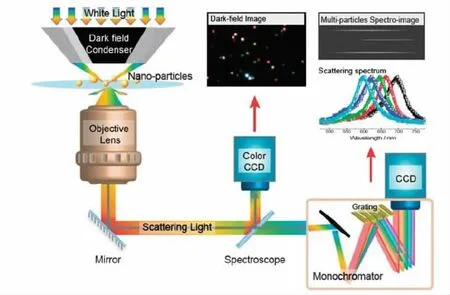
图1 暗场散射成像技术原理图Fig.1 Schematic diagram of dark field light scattering technology[6]
肿瘤标志物是一类能够反映肿瘤的存在和生长的物质,是由肿瘤细胞或者肿瘤组织表达合成的,或是机体在肿瘤发生和增殖过程中对肿瘤反应增加的物质。高特异性、高灵敏度检测肿瘤标志物是实现肿瘤早期诊断的重要手段。本文主要研究暗场光散射技术在肿瘤标志物检测中的应用,特别是检测脱氧核糖核酸(DNA)、微小核糖核酸(miRNA)、甲胎蛋白、癌胚抗原等肿瘤标志物,并对基于暗场光散射技术的检测方法的下一步发展进行展望。
1 暗场光散射技术在DNA检测中的应用
DNA是生物体内一类携带遗传信息的生物大分子。四种不同碱基的排布序列使DNA成为遗传信息的载体,来指导合成生物体内的蛋白质。Bu等人通过两条互补的DNA单链,诱导胶体金的聚集沉淀,通过暗场显微镜成像来定量DNA,检测限为100 fM。[9]Guo等人设计了一种Y型DNA双链结构的比色传感器,诱导胶体金二聚物的形成,可以控制粒子间的距离和粒子聚集的尺寸,大大提高了稳定性。与传统的比色方法相比,检测的动态范围增加了2个数量级,检测限增加了10000倍。[10]在此工作基础上,Li等改进了Y型结构的比色传感器设计,用低成本的单链DNA代替昂贵的2-硫乙醚乙酸在材料表面形成致密层,用来不对称修饰其他的单链DNA以形成Y型结构传感器,引发胶体金二聚体的形成(如图2)。[11]在暗场显微镜下,使用金纳米颗粒计数法对靶DNA进行定量,检测限为43 aM,其灵敏度比传统比色方法大大提高。同样采用胶体金计数法,Li等人设计了一种非放大三明治方法对核酸进行检测,结合磁分离技术,检测限甚至可以达到10-15 M。[12]Chen等人设计了一种新的比色方法,利用杂交链式反应形成的DNA双链引发胶体金的聚集,利用暗场显微镜计数定量检测靶DNA。[13]
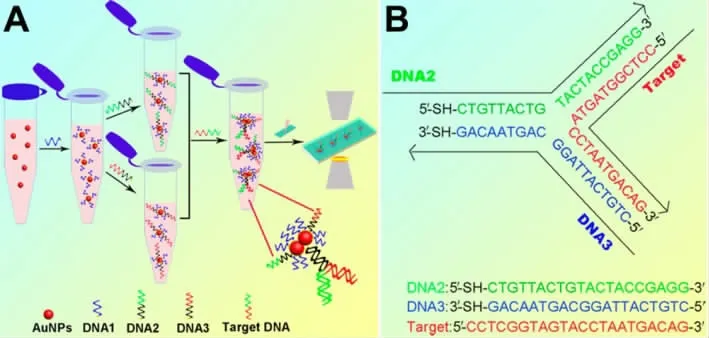
图2 基于Y型结构探针设计暗场检测DNAFig.2 Detection of DNA based on Y-typestructure probe[11]
2 暗场光散射技术在miRNA检测中的应用
微小核糖核酸(miRNA)是一类长度约19-25个核苷酸的非编码RNA。研究表明,miRNA在肿瘤细胞和正常细胞中的表达存在着明显的差异,大部分的miRNA基因位于与肿瘤形成相关的基因位点上,由此表明miRNA可能在肿瘤的发生或者生长阶段发挥关键作用。比如:miR-21在胃癌等恶性肿瘤中表达丰富;miR-17-92在小细胞肺癌生长过程中起关键的作用;miR-122a常见于正常的肝脏组织中,但是在肝癌中的表达明显降低等。
Hwu等人发展了一种基于暗场微井的方法来检测缓冲溶液和细胞裂解液中的miRNA,高通量传感,能够即时检测。[14]Xu等人发展了一种基于催化发卡组装、杂交链式反应和金—银纳米探针刻蚀的高灵敏度方法来检测miRNA-141。miRNA-141能够引发催化发卡组装和杂交链式反应,促使模拟辣根过氧化物酶的形成,能够使双氧水分解为羟基自由基,来刻蚀金纳米颗粒的银壳。由此产生的表面等离子体吸附和散射效应可以用于miRNA-141的定量依据,检测限低至50 aM。[15]Zhou等人发展了一种新的颜色分析方法来区分单个金纳米颗粒,极大地改进了图像的颜色分辨率和检测的灵敏度,用来检测与肝肿瘤细胞相关的miRNA。[16]Long等人设计了一个单细胞中同时进行miRNA-21靶向成像和光热治疗的体系。如图3,miRNA-21诱导金纳米颗粒聚集,在暗场显微镜下成像,并且吸收峰移至近红外光区。近红外光照射杀死MCF-7癌细胞。[17]
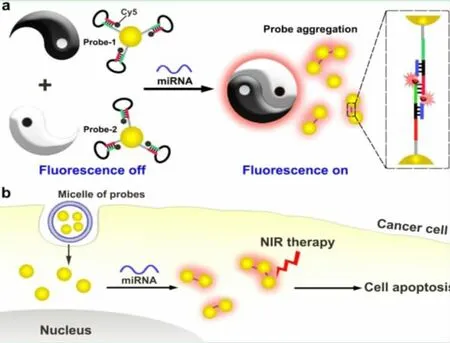
图3 (a)miRNA-21诱导金纳米颗粒聚集和荧光开关;(b)miRNA-21原位成像和miRNA靶向近红外治疗
3 暗场光散射技术在蛋白类标志物检测中的应用
常见的属于蛋白类的肿瘤标志物有癌胚抗原、核仁素、甲胎蛋白、碱性磷酸酶、p53蛋白等。
癌胚抗原(carcinoembryonic antigen,CEA)是一种适用范围广泛的肿瘤标志物,主要位于内胚层分化的恶性肿瘤细胞表面。CEA虽然不能作为肿瘤诊断的特征参数,但具有较高的临床意义。甲胎蛋白(alpha fetoprotein,AFP)是一种单一的糖蛋白,在正常情况下由胎儿的卵黄囊及肝细胞合成。一般情况下,正常人的甲胎蛋白值不会升高,但肝癌患者的甲胎蛋白值往往是显著升高的,所以临床上常用AFP来进行肝癌的早期筛查。前列腺特异抗原(prostate specific antigen,PSA)是前列腺上皮细胞分泌的一种蛋白。正常人血清中含量极微。在肿瘤或者炎症的情况下,前列腺的结构受到破坏,导致血液中的PSA升高,可用于前列腺癌的诊疗监测。
Ma等人基于三明治免疫分析方法,设计了两种纳米探针,同时对AFP和CEA进行暗视野成像(如图4)。AFP抗体结合的金纳米颗粒和CEA结合的银纳米颗粒在暗视野显微镜下显示不同的颜色,因此可以利用计数法对AFP和CEA进行同时定量。分析表明,两种靶标在一定浓度范围内(0.5-10 ng/mL)相互没有干扰,表明了双靶同时灵敏检测的实用性[18]。Poon等基于贵金属纳米粒子间的等离子体耦合效应,设计了一种简单而有效的肿瘤标志物定量检测的方法。[19]将金纳米颗粒和银纳米颗粒作为捕获探针和信号探针,分别修饰了一级抗体和二级抗体。在相应靶存在下,能够形成夹心结构的免疫复合物,大大增强了散射强度。用暗场显微镜光谱系统测定粒子的强度变化,来确定肿瘤标志物的浓度。测定了三种类型的标志物,包括CEA、AFP和PSA,测定的检测限分别为7.0 pM、3.3 pM和5.9 pM,0到300 pM范围内存在线性关系。与传统检测方法进行数据对比,呈现了较好的一致性。Wu等人也发展了一种检测肿瘤标志物的方法。设计使用链霉亲合素功能化的磁珠和二抗功能化的金纳米颗粒作为低成本和通用的免疫平台。PSA、CEA和AFP的检测限分别为1.0、5.0和1.0 ng/mL。[20]
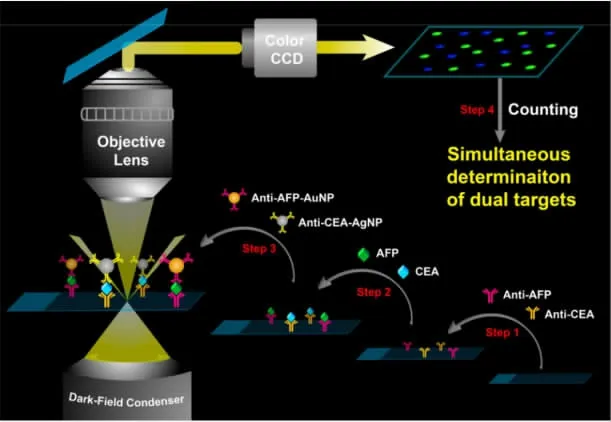
图4 在DFM下同时测定AFP和CEA的原理图Fig.4 Schematic diagram of simultaneousdetermination of AFPand CEA[18]
核仁素(nucleolin,NCL)是在核仁中高度表达的一种蛋白,参与很多生物学过程,并能够与多种致癌基因作用,从而影响细胞的生长和增殖等。核仁素作为一种肿瘤标志物,能够在多种癌细胞表面选择性表达,可以作为脂蛋白、细胞因子等的受体。因此,对核仁素进行靶向和成像,是一种诊断恶性肿瘤的重要手段。Liu等人利用硒纳米颗粒,设计了一种新型散射纳米探针,将适配体修饰到硒纳米颗粒上,能够精确靶向核仁素高表达的Hep-2细胞,进行暗视野成像(如图5)。[21]
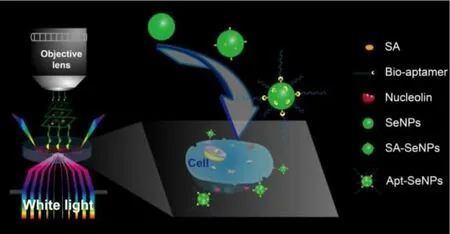
图5 应用核仁素适体-硒纳米颗粒进行暗场成像Fig.5 Dark field imaging of nucleolin aptamer-selenium nanoparticles[21]
肿瘤坏死因子(Tumor necrosis factor-α,TNF-α)是一种主要由巨噬细胞产生的能够抑制或者杀伤肿瘤的细胞因子,能够造成肿瘤组织的出血性坏死。TNF-α的检测,对于判断体内是否有肿瘤有很好的帮助。Ju等人利用3D加强的暗场超分辨显微镜和双编码等离子纳米传感方法检测TNF-α。[22]TNF-α可以在单分子水平上进行免疫靶向,而且通过测定阵列芯片上的散射信号进行定量分析。该方法检测限为65 zM(1.14 ag/mL),线性范围为65 zM-2.08 pM(1.14 ag/mL-36.4 pg/mL)。人表皮生长因子受体-2(human growth factor receptor-2,HER2)是一种存在于乳腺癌细胞表面的蛋白质,不但是乳腺癌诊断及临床治疗检测的重要的标志物,而且是靶向药物治疗乳腺癌的一个重要靶点。Guo等人设计了点击反应促使修饰有HER2的适体的金纳米粒子聚集,并使细胞表面的HER2蛋白原位暗场成像。[23]癌抗原125(CA125)是一种存在于卵巢肿瘤的上皮细胞内的糖蛋白,通常作为卵巢上皮癌的肿瘤标志物。Ju等人利用双模式暗场显微镜检测CA125。[24]胶体银标记的CA125在金纳米点上进行免疫反应,基于暗场图像,数字相机和EMCCD分别进行定性和定量分析,发展的免疫传感器展示了低的检测限(4 U/mL)和宽的动态监测范围(4 U/mL-80 U/mL)。
p53蛋白是一种肿瘤抑制蛋白。野生型p53蛋白(WTp53)含有中心特异性DNA结合结构域,能够绑定一个共识位点的双链DNA。在大多数类型的癌细胞中,p53基因的广泛变异导致其中心DNA结合域发生变化,失去与DNA的结合能力。突变型p53蛋白(MUp53)的异常表达已被认为是致癌的重要刺激作用。因此,检测和区分WTp53和MUp53对于癌症的诊断具有重要意义。Qian等设计了一种双靶向纳米囊泡用于细胞内WTp53和MUp53的原位成像。[25]囊泡包覆的等离子金纳米粒子用DNA双链功能化,荧光素标记的MUp53抗体偶联到纳米囊泡的表面。进入细胞以后,释放的金纳米离子通过识别WTp53和双链DNA团聚。可以用暗视野显微镜观察纳米探针的颜色变化,定性描述细胞内WTp53蛋白的分布情况,通过荧光素标记的MUp53抗体和MUp53免疫识别,进行MUp53的定位。这样通过一步孵育的方法实现细胞内WTp53和MUp53的原位成像。
4 暗场光散射技术在胞外囊泡检测中的应用
胞外囊泡(Extracellular vesicles,EVs)在大部分生物流体中都大量存在,被认为是一类潜在的生物标志物。但是大部分的分析都要求分离和纯化步骤,耗费时间和人力。Amrollahi等人发展了一种远场纳米等离子体加强的散射方法对EVs进行免分离表征。[26]EVs首先被癌症选择性抗体进行捕获,然后与偶联EVs表面CD9蛋白的抗体的金纳米棒进行杂交,最后用暗视野显微镜进行成像并进行定量。结果显示(如图6),用暗场光散射技术检测上皮细胞黏附因子(epithelial cell adhesion molecule,EpCAM)时,可以实现与酶联免疫测定相同的效果。通过分析血清样品中的上皮细胞黏附因子的表达,可以实现早期胰腺导管腺癌患者与健康者的区分。肿瘤细胞来源的外泌体(tumor-derived exosome,TEX)是细胞外囊泡其中的一种类型,因其含有蛋白、核酸等多种具有生物学活性的物质,可参与细胞间的通讯及物质交换等过程,促进肿瘤的生长。[27]Wan等人发展了一种快速检测TEX的方法。[28]TEX首先被外泌体特异性抗体捕获在载玻片表面,再与纳米粒子偶联的与疾病相关的抗体探针杂交,靶向的外泌体数量应用暗场显微镜成像来定量。
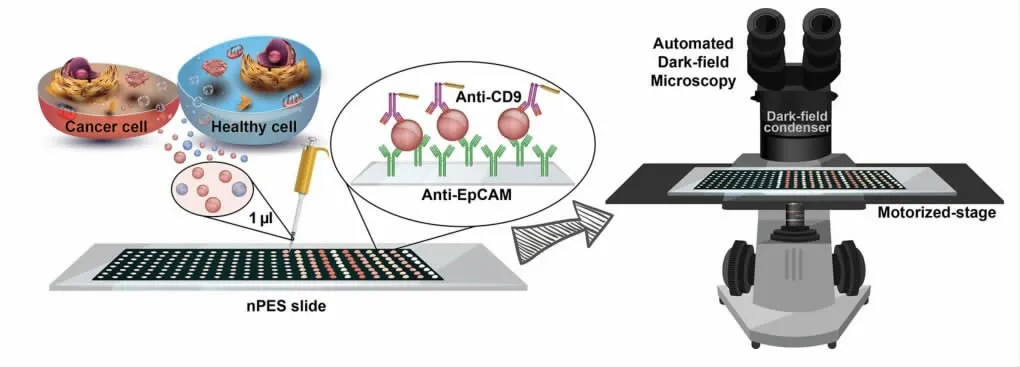
图6 用暗视野显微镜测定EpCAM原理图Fig.6 Schematic diagram of EpCAM detection with DFM[26]
5 结语
本文研究了利用暗场光散射方法检测DNA、miRNA、蛋白类标志物及细胞外囊泡等肿瘤标志物的研究进展。利用暗场光散射技术检测肿瘤标志物具有背景值低、灵敏度高等优点,应用范围广。但是也存在需要改进的地方,比如等离子共振探针目前限于金、银、硒等材料,需要探索性能更好的材料;单个颗粒的性质研究不够完善,需要深入机理研究;大量数据处理限于个人经验,需要借助于大数据技术,快速准确地提取单颗粒光谱所携带的信息;需要发展更加即时快捷的检测手段,并应用于临床检验中;对细胞内肿瘤标志物进行的定量研究较少,需要克服遇到的困难,建立新的方法,提升检测水平。暗场光散射技术在肿瘤标志物检测方面具有巨大的发展潜力。相信随着仪器技术的进步和检测方法的提升,未来将会更加广泛地应用于快速简单的临床检验,为肿瘤的早期发现、早期治疗提供重要的分析手段。

