QuEChERS-dSPE-UPLC-MS/MS法筛查动物源性食品中9种兽药残留
◎ 周瑞铮,林秋凤,易华娟,张树权,陈锦杭,蔡润南
(东莞市食品药品检验所,广东 东莞 523808)
肉类和肉制品在人们饮食中扮演了重要的角色。预计未来10年,全球肉类产量和人均肉类摄入量将会持续增加,猪肉和鸡肉消费量将大幅上升,占全球肉类利用率的36%和35%,其次是牛肉(22%)和羊肉(4%)[1]。我国肉类及其制品消耗占比较大,兽药的滥用也逐渐发展为不能忽视的食品安全问题。通过对动物源食品不合格项目分析,发现畜禽肉中氯霉素、恩诺沙星等兽药违规使用问题较为突出[2],水产制品中孔雀石绿滥用较多。动物源性产品兽药残留问题关乎公众健康,如氯霉素抑制人体骨髓造血机能,产生粒细胞缺乏症、再生障碍性贫血等毒副作用[3-5],沙星类药物会损害胃肠功能及中枢神经,影响儿童软骨生长发育[6-8],β-受体激动剂影响人体血液循环,使中枢神经系统缺血和心肾功能损害[9-11],孔雀石绿及其代谢物则具有致癌、致畸等毒副作用[12-14]。如今,兽药残留问题已成为全球的焦点,大多数国家和地区加强了对动物源性产品中兽药残留的监管,并制订了相关法规制度。我国在2019年发布的《食品安全国家标准 食品中兽药最大残留限量》(GB 31650—2019)规定喹诺酮类兽药最高残留限量(Maximum Residue Limit, MRL)为100 μg·kg-1,整顿办函〔2010〕50号、整顿办函〔2011〕1号、农业农村部公告第250号中规定不得使用克伦特罗、莱克多巴胺、沙丁胺醇、氯霉素、孔雀石绿。这些常见兽药残留项目检验方法有液相色谱法、液相色谱质谱联用法等[15-18],现行的检验标准有GB/T 21312—2007、GB/T 19857—2005、GB/T22338—2008和GB/T 22286—2008,但这些标准前处理步骤相对复杂,检验效能较低,为降低检验成本,提高检验效率,设计一种高效、简洁、灵敏度高、可同一时间检验多种类别兽药的方法十分必要。QuEChERS方法具有操作简便、快速高效、成本低廉等特点[19-22],结合超高效液相色谱-串联质谱法,能同时检测多种兽药残留,节省大量时间及实验成本,便于在食品检测机构进行样品初步筛查。本文建立了动物源食品中常见的4大类(恩诺沙星、环丙沙星、氟甲喹、孔雀石绿、隐色孔雀石绿、克伦特罗、莱克多巴胺、沙丁胺醇和氯霉素)共9种兽药残留的QuEChERS检测方法,满足实际工作的需要。
1 材料与方法
1.1 材料与试剂
试验材料:新鲜肉类(畜肉,禽肉,水产品)、加工肉制品(腌制品,酱卤肉),来自东莞市学校食堂及肉制品生产厂家。
试剂:甲醇、乙腈、正己烷(色谱纯,德国默克公司);甲酸、乙酸铵(色谱纯,中国天津市科密欧化学试剂有限公司);CNW dSPE兽药提取包、净化管(上海安谱实验科技股份有限公司)。
标准物质:氯霉素(中国计量科学研究院);氯霉素-D5、恩诺沙星、氟甲喹、沙丁胺醇、盐酸克伦特罗、莱克多巴胺(北京曼哈格生物科技有限公司);环丙沙星、孔雀石绿草酸盐、隐色孔雀石绿(德国Dr.Ehrenstorfer公司);孔雀石绿-D5、隐色孔雀石绿-D6、克伦特罗-D9(德国Witegar公司);沙丁胺醇-D3(加拿大CDN公司)。
1.2 仪器与设备
LC30AD超高效液相色谱仪(日本岛津公司);SCIEX 5500质谱联用仪(配ESI离子源,美国AB公司);CPA225D电子分析天平(感量0.000 01 g,德国赛多利斯);BSA223S电子分析天平(感量0.001 g,德国赛多利斯);3K 15离心机(9 500 r·min-1,德国SIGMA);超纯水机(Milli-Q Reference,德国默克)。
1.3 试验方法
1.3.1 标准溶液的制备
分别精密称取适量氯霉素、孔雀石绿、隐色孔雀石绿,使用乙腈溶解并定容,恩诺沙星、环丙沙星、氟甲喹、克伦特罗、沙丁胺醇、莱克多巴胺使用甲醇溶解并定容,制成浓度为1.0 mg·mL-1的标准储备液,储于-20 ℃。临用时,用体积分数为50%乙腈水溶液稀释至孔雀石绿、氯霉素、β-受体激动剂质量浓度为10.0 ng·mL-1,喹诺酮质量浓度为200.0 ng·mL-1的混合标准工作液。
分别精密称取适量氯霉素-D5、孔雀石绿-D5、隐色孔雀石绿-D6使用乙腈溶解并定容,克伦特罗-D9、沙丁胺醇-D3使用甲醇溶解并定容,孔雀石绿-D5、隐色孔雀石绿-D6、克伦特罗-D9、沙丁胺醇-D3定容至100 μg·mL-1,氯霉素-D5定容至1.00 μg·mL-1,制成单一内标储备溶液。临用时,用50%乙腈水稀释至氯霉素-D5、孔雀石绿-D5及隐色孔雀石绿-D6质量浓度为100 ng·mL-1,β-受体激动剂类质量浓度为10.0 ng·mL-1的混合内标工作溶液。
1.3.2 样品溶液的制备
(1)提取。称取粉碎试样约2 g(精确到0.01 g)于50 mL聚丙烯离心管中,加入1袋兽药提取盐包,50 μL混合内标物工作溶液,加入15 mL 1%甲酸乙腈后剧烈振摇,使样品分散,涡旋5 min,超声10 min,8 000 r·min-1离心5 min,重复提取2次,合并两次提取液备用。
(2)净化。将提取液转移至兽药净化管,涡旋5 min,8 500 r·min-1离心5 min,转移上清液至100 mL棕色鸡心瓶,40 ℃水浴减压旋蒸至近干,加入1 mL 50%乙腈水复溶,过0.22 μm有机滤膜后,供液相-质谱测定。
1.3.3 色谱及质谱条件
(1)色谱条件。色谱柱:Boston, Green ODSAQ C18(2.1 mm×100 mm,3.5 μm);流速:0.2 mL·min-1;进样体积:2.0 μL;柱温:35 ℃;流动相A:甲醇,流动相B:0.1%甲酸-1 mmol·L-1乙酸铵,洗脱梯度见表1。
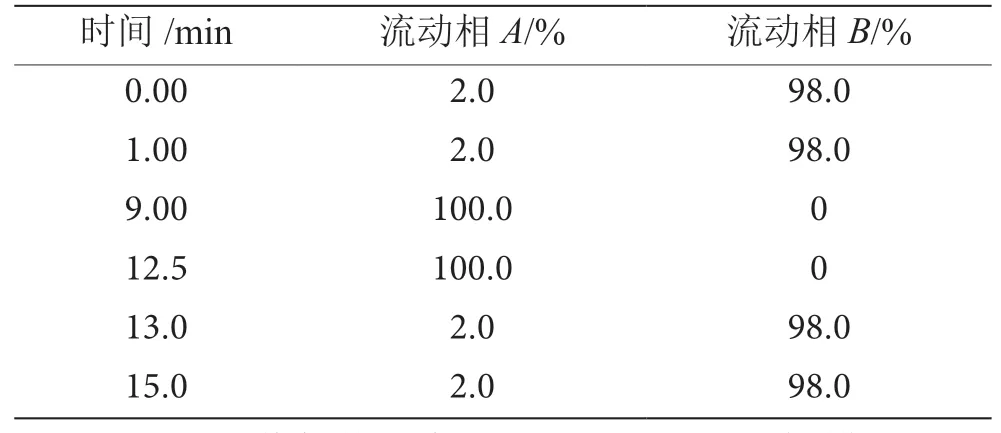
表1 液相洗脱梯度表
(2)质谱条件。离子源:H-ESI;扫描模式:正负离子同时扫描;检测方式:多反应监测(MRM);雾化气(GS1):379.2 kPa(氮气);辅助气(GS2):379.2 kPa(氮气);气帘气(CUR):206.8 kPa(氮气);喷雾电压(IS):5 500 V、-4 500 V;去溶剂温度(TEM):350 ℃;碰撞气(CAD):55.16 kPa(氮气)。离子对优化结果见表2。

表2 定性离子、定量离子、碰撞能量、去簇电压表
2 结果与分析
2.1 样品提取溶剂的优化
本文中涉及的兽药包含氟喹诺酮类、三苯甲烷类、β-受体激动剂类和氯霉素类,乙腈对上述几类兽药均有较好的提取效果,还可以有效去除蛋白,是较为理想的溶剂,但有研究表明氟喹诺酮类具有酸碱两性性质,在酸性或碱性条件下的提取效率更高,因此对乙腈、0.1%甲酸-乙腈,1%甲酸-乙腈进行比较[22]。3种提取溶剂的回收率结果如图1所示,综合考虑认为1%甲酸-乙腈对各组分的提取效果均较好,最终选择1%甲酸-乙腈作为提取溶剂。
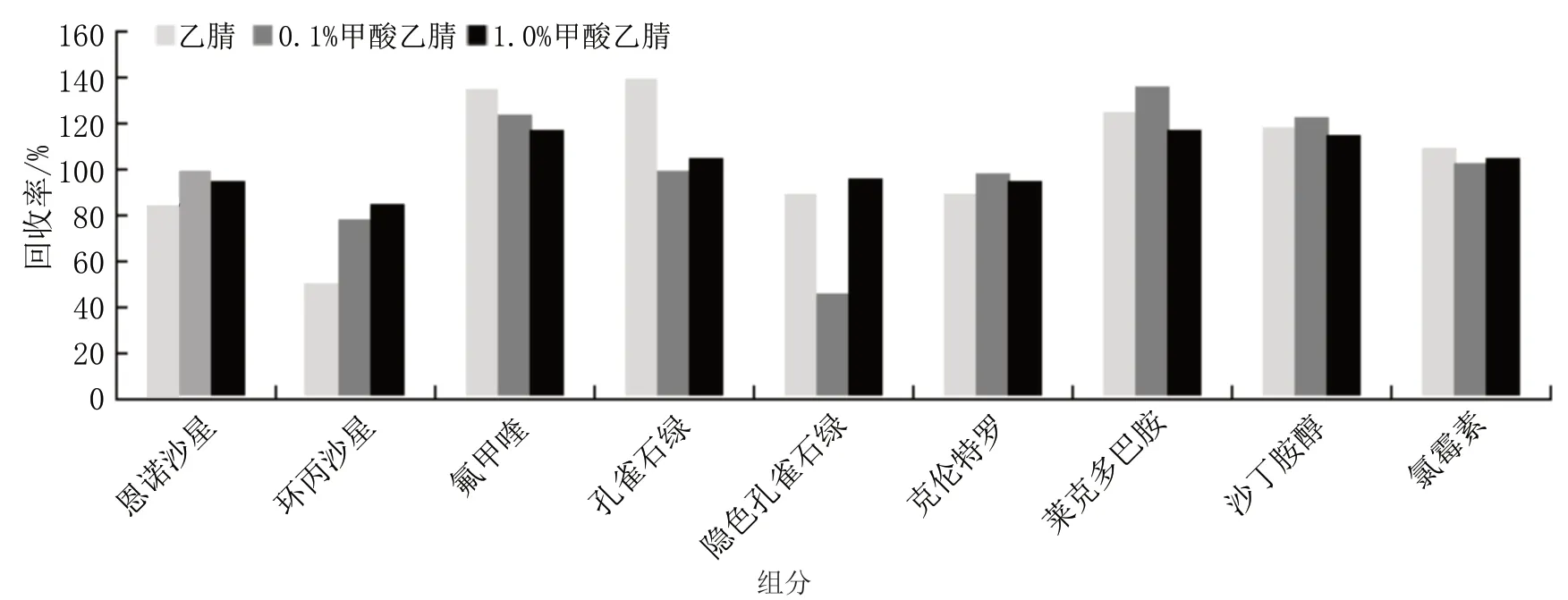
图1 不同提取溶剂回收率对比图
2.2 流动相的优化
为了缩短检测时间,优化色谱峰形,本研究对常用的流动相体系进行了比较。文献报道显示[23-25],动物源性食品兽药残留常用甲醇/水、乙腈/水体系作为流动相进行检测。本研究对这两个体系分别进行试验,比较在乙腈/水体系和甲醇/水体系对9种兽药、5种内标物化合物的分离效果、峰型的影响。乙腈-水体系大部分物质出峰时间集中在4~7 min,个别在9 min左右;甲醇-水体系则更加分散,3~9 min均有物质出峰,分离效果更好。但在不添加缓冲盐和调节pH的甲醇-水和乙腈-水体系下,部分组分的峰形较差,出现拖尾等情况。经试验,添加0.1%甲酸和1 mmol·L-1乙酸铵有利于提高分离度,对检测组分的峰形有明显改善。因此,选用甲醇、0.1%甲酸-1 mmol·L-1乙酸铵作为流动相。
2.3 线性关系、回收率、精密度
如表3所示,各组分在0.1~100 ng·mL-1浓度范围内线性良好,相关系数均大于0.998。以定性离子的3倍信噪比(S/N=3)对应的检测限为检出限(Limit of Detection,LOD),测定各组分的检出限。本研究以检出限的1、5、10倍作为加标水平,对空白猪肉基质进行加标,每个水平分别进行6次平行试验,如表3所示,各组分的检出限在0.1~2.0 ng·mL-1,满足国家标准的检测需求。各组分的平均加标回收率为69.2%~115.4%,相对标准偏差为0.9%~12.7%,该方法回收率、精密度均符合《实验室质量控制规范 食品理化检验》(GB/T 27404—2008)附录F的检测方法确认的技术要求[16]。
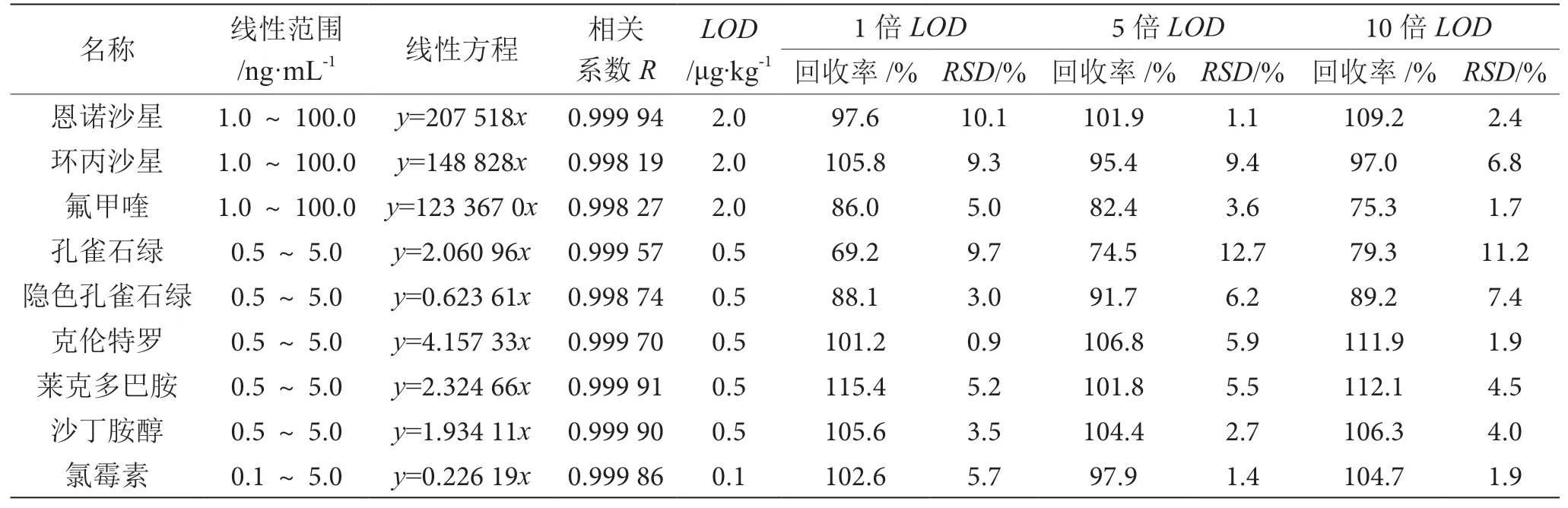
表3 线性范围、线性方程、相关系数、检出限、回收率表
2.4 实际样品测定结果
运用本研究建立的方法与标准方法进行结果比对
(GB/T 21312—2007、GB/T 22286—2008、GB/T 19857—2005、GB/T 22338—2008),结果表明,大部分组分的QuEChERS方法与标准测定方法结果偏差在20%~30%,而莱克多巴胺的检测结果相对标准方法则相对较低,推测是因为样品处理时没有进行酶解,而莱克多巴胺与蛋白结合较为牢固。如果检验过程中对样品进行酶解,则需要较长的时间,效率低下不利于大批量筛查工作。现今检测仪器的灵敏度较高,即便只能提取部分莱克多巴胺,依然能满足日常筛查的需求,因此,本方法适合动物源性食品中兽药残留的初步筛查。
3 结论
本研究建立了QuEChERS-超高效液相色谱-串联质谱法筛查动物源性食品中恩诺沙星、环丙沙星、氟甲喹、孔雀石绿、隐色孔雀石绿、克伦特罗、沙丁胺醇、莱克多巴胺、氯霉素共计9种兽药残留情况的分析方法,以1%甲酸乙腈作为溶剂,涡旋、超声进行提取,QuEChERS净化后旋蒸浓缩,50%乙腈-水复溶。各组分在0.1~100 ng·mL-1浓度范围内线性良好,相关系数R均大于0.998,平均加标回收率在69.2%~115.4%,相对平均偏差为0.9%~12.7%,重复性好。该方法可以实现高通量处理,大大提高工作效率,为食品安全日常监管提供了有效保障。

