水分及混合接菌对杜鹃光合特性的影响
郭 垚,欧 静,李林盼
(贵州大学林学院,贵州 贵阳 550025)
水因子是限制植物分布地域与生长状况的主要因素[1],在植物的生长过程中起到至关重要的作用。在土壤缺水环境下,植物光合作用会受到抑制。杜鹃(Rhododendron simsiiPlanch)又常被人们称为“花中西施”,在园林应用和观赏方面具有较高的价值[2]。菌根是指土壤中某些真菌与植物根的共生体,能够有效地增加植物的抗逆性,主要分为外生菌根(Ectomycorrhizae,ECM)和内生菌根(Endomy⁃corrhizaes,ENM)两大类。菌丝与杜鹃花科植物形成的菌丝节结构为杜鹃花类菌根(Ericoid mycorrhizas,ERM)[3],属于内生菌根。目前,关于杜鹃花类菌根光合特性的研究有桃叶杜鹃(Rhododendron annaeFranch)[4],华 顶 杜 鹃(Rhododendron huadingense)[5]等,但关于菌根真菌对杜鹃光合特性的影响却鲜见报道。马尾松能与外生菌根(Ectomycorrhiza,ECM)形成外生菌根共生体[6]。自然环境中杜鹃花群落和马尾松林群落能营造别具一格针叶树种-杜鹃花模式的乔灌木混交林群落景观[7]。目前对马尾松-杜鹃群落的研究很少将真菌接种到杜鹃苗根系来探讨真菌对杜鹃光合特性的影响。因此,本试验从野外群落杜鹃根系分离出菌根真菌进行培养,并按照菌根丰富度筛选出4种菌根真菌菌株与1种马尾松外生菌根菌株对杜鹃苗进行混合接菌,研究杜鹃菌根苗在不同水分梯度下光合特性的变化。
1 材料与方法
1.1 试验材料
供试内生菌株为自贵州省贵阳市乌当区及孟关镇野外马尾松-杜鹃群落中杜鹃根系分离纯化而得的内生菌株,编号为LL03(Ascomycota子囊菌门)、LL16(Ascomycota子囊菌门)、MG17(Basidiomy⁃cota担子菌纲)、MG27(Leotiomycetes锤舌菌纲),由上海派森诺生物科技股份有限公司鉴定[8]。供试外生菌株为美味牛肝菌(Boletusedulis)于市场购买。
供试杜鹃苗为一年生无菌扦插苗,基质为腐殖土+珍珠岩+黄壤(1:1:2)用高温高压法(121℃,0.1 MPa)灭菌120 min后备用,塑料花盆规格为上口径(16 cm)×下口径(11 cm)×高(14 cm)。
1.2 试验方法
1.2.1 菌株培育及菌剂制备
首先是菌株活化,在PDA(马铃薯葡萄糖琼脂)培养基上对试验所用的4个内生菌菌株进行活化,放入25℃人工气候箱内暗培养;其次是扩繁,待其长满菌丝后,再在PDA液体培养基上接种已活化的菌株进行扩繁;最后是菌剂备用,将上个步骤中的PDA液体培养基放于28℃摇床上振荡并进行十五天的暗培养后,打碎制作成液体菌剂备用。同时将美味牛肝菌子实体Boletusedulis打成匀浆状备用。
1.2.2 试验设计
接菌设置3个接菌处理,分别为CK处理(接种无菌株液体培养基)、D处理(ERM菌株混合接菌)、DM处理(ECM+ERM菌株混合接菌)。用医用注射器装取10 ml菌剂施入杜鹃苗根系周围土壤,于2018年7月20日第一次施入菌液,接着每隔7 d施入1次菌液,连续施入3次结束。
水分处理即轻度水湿W1(85%~95%)、正常水分W(75%~80%)、轻度干旱T1(60%~65%)、中度干旱T2(50%~45%)和重度干旱T3(35%~40%)。注:百分比为土壤含水量与田间最大持水量的比率。于2019年6月至7月进行水分胁迫实验,每处理15盆,每盆1株,各处理重复3次,共675株苗。每天傍晚17点至18点通过称重法(电子称质感0.1 g)补充白天散失水分,让土壤相对含水量保持相对稳定,在处理30 d后对各项指标进行随机取样检测。
1.3 指标测定
菌根侵染率测定采用醋酸墨水染色法[9];采集不同处理杜鹃植株顶部向下第4、第5片成熟功能叶片进行混合取样后,叶绿素采用熊庆娥方法测定[10];光合特征参数利用CI-340手持式光合作用测定系统测定;叶绿素荧光动力学参数参照王好运测定方法测定[11]。
1.4 数据处理
数据统计和绘图用WPS,统计分析用SPSS 21.0,各处理间的差异性采用单因素方差分析和Duncan多重比较法。
2 结果与分析
2.1 混合接菌处理杜鹃苗根系菌根侵染率
将菌株活化扩繁后,对一年生杜鹃苗进行接种处理,常规养护培育后进行侵染率测定。从图1可见,不同混合菌剂接种处理对杜鹃幼苗根系侵染率呈显著差异。CK处理侵染率为7.11%,D处理侵染率为32.3%,DM处理侵染率为51.2%,可见接种混合菌剂能成功侵染杜鹃根系,不同混合菌剂对杜鹃根系侵染程度不一样。

图1 接种不同混合菌剂杜鹃苗侵染率Fig.1 Mycorrhizal colonsation of different compound strains inoculation of R.simsii Planch
2.2 不同水分梯度下接种混合菌剂对杜鹃苗叶绿素含量的影响
由图2~3可知,同一水分梯度下,D、DM处理叶绿素a、b含量均高于CK组,差异极显著(P<0.01),DM与D处理,无显著差异差异(P>0.05)。与正常供水相比,轻度水湿条件下,CK处理叶绿素a、b含量下降,D、DM处理叶绿素a、b含量则呈上升变化;随着土壤水分含量降低的加剧,CK组叶绿素a、b含量逐步下降,在T3时最低;接菌处理与之相反,杜鹃叶片叶绿素a、b含量的变化趋势为先上升后下降,在T2处理下叶绿素a、b含量最高。在水分胁迫下,接菌处理能显著增加杜鹃叶片叶绿素a、b含量且适度干旱能提高叶片叶绿素含量。

图2 不同水分梯度下杜鹃菌根苗叶片叶绿素a含量Fig.2 The chlorophyll a content of R.simsii Planch for inocula⁃tion treatment under different water gradients
从图4~5可以看出,CK处理杜鹃叶片叶绿素总量在轻度水湿下呈下降变化,D、DM处理出现上升趋势。随着土壤水分的减少,CK处理杜鹃叶片叶绿素总含量逐渐降低,而D、DM处理则先升高后降低,在T2下达到最高。同一水分梯度下,DM、D处理杜鹃叶片叶绿素总含量均高于CK,差异极显著(P<0.01)。各水分梯度下杜鹃叶片叶绿素a/b比值CK处理均大于接菌处理,在W和W1条件下CK与D、DM处理差异极显著(P<0.01),在T1、T2和T3条件下差异显著(P<0.05),D、DM之间差异不显著。可见,接菌能增加杜鹃叶绿素的积累,T2水分条件下接菌苗叶绿素含量最高。
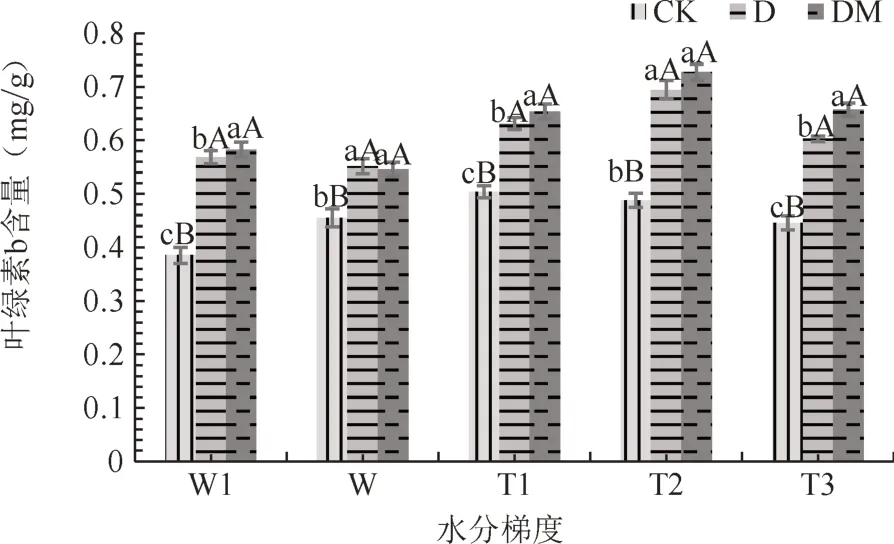
图3 不同水分梯度下杜鹃菌根苗叶片叶绿素b含量Fig.3 Thechlorophyll b content of R.simsii for inoculation treatment under different water gradients
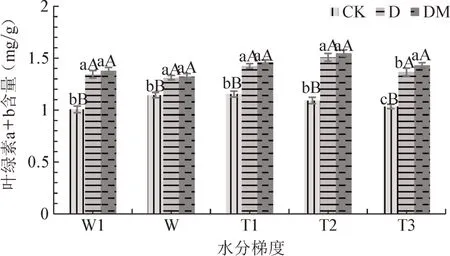
图4 不同水分梯度下杜鹃菌根苗叶片叶绿素a+b含量Fig.4 Thechlorophyll a+b content of R.simsii Planch for inoc⁃ulation treatment under different water gradients
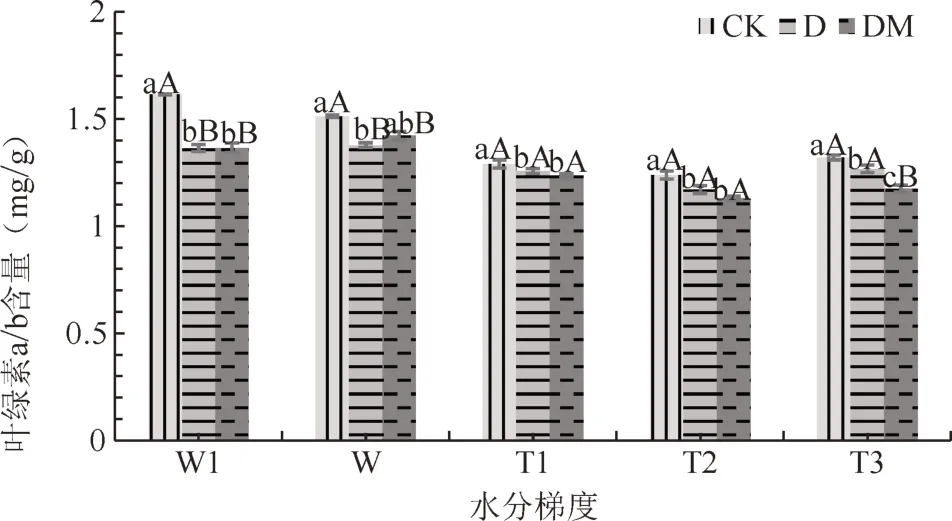
图5 不同水分梯度下杜鹃菌根苗叶片叶绿素a/b比值Fig.5 The chlorophyll a/b of R.simsii Planchfor inoculation treatment under different water gradients
2.3 不同水分梯度下接种混合菌剂对杜鹃苗光合特征参数的影响
从图6可以看出,同一水分条件下,接种处理的杜鹃叶片净光合速率均高于CK,差异极显著(P<0.01)。其中D、DM处理间在W、T2水分下差异不显著(P>0.05),在T1水分梯度下差异显著(P<0.05),在W1、T1处理下差异极显著(P<0.01)。与正常供水相比,T1水分下杜鹃叶片净光合速率均呈下降变化;随着土壤水分含量的降低,CK处理杜鹃叶片净光合速率呈下降变化,在T3水分下达到最低;接菌处理呈先升高后下降变化,以DM处理在T2水分下杜鹃叶片Pn值最大,达1.33 mmol·m-2·s。
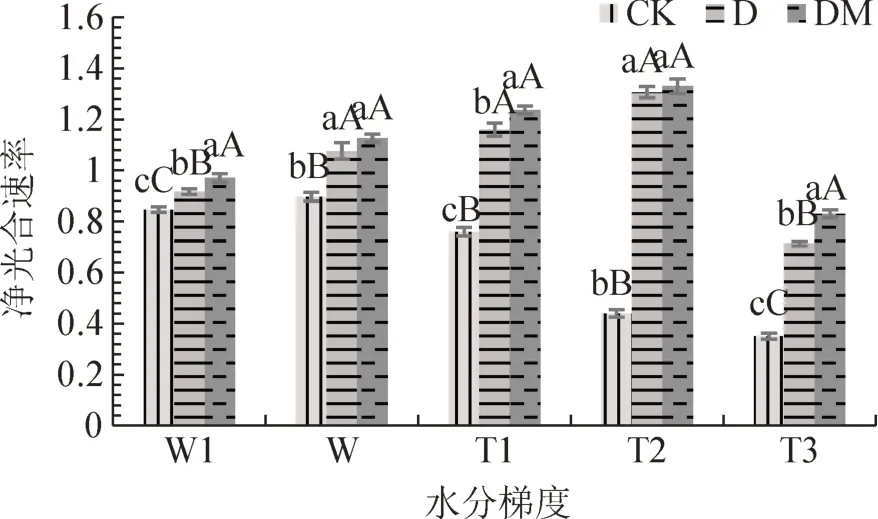
图6 不同水分梯度下杜鹃菌根苗叶片净光合速率Fig.6 The net Photosynthesis rate of R.simsii Planch for inoc⁃ulation treatment under different water gradients
从图7可以看出,同一水分梯度下,各处理的杜鹃叶片气孔导度值均为DM>D>CK,三者之间差异显著。W1水分梯度下,杜鹃叶片气孔导度出现轻微下降,降幅为CK(10.70%)>D(8.51%)>DM(1.3%);随着土壤水分含量的减少,各处理杜鹃叶片气孔导度逐渐下降,其降幅依次为CK(51.04%)>D(39.04%)>DM(38.12%)。
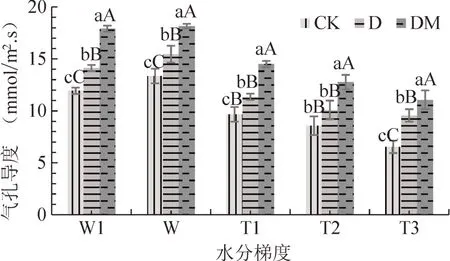
图7 不同水分梯度下杜鹃菌根苗叶片气孔导度Fig.7 The stomatal conductancen of R.simsii Planch for inocu⁃lation treatment under different water gradients
从图8可以看出,不同水分梯度下,接菌处理杜鹃叶片蒸腾速率均为DM>D>CK,且各处理间差异极显著。杜鹃叶片蒸腾速率的变化与气孔导度的变化趋于一致,即在W1水分处理下降低;在土壤水分缺失条件下,随着干旱胁迫程度的加剧呈降低变化,降幅依次为CK(48.19%)>D(31.20%)>DM(22.15%)。
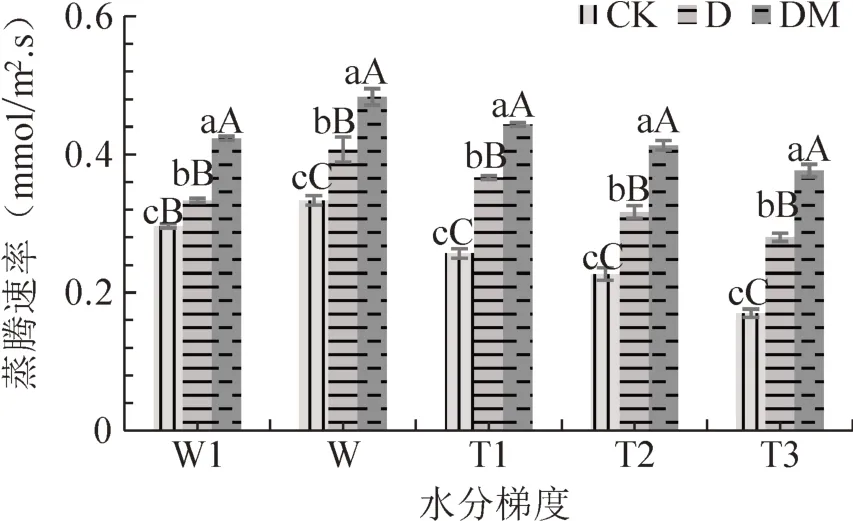
图8 不同水分梯度下接种菌根真菌杜鹃蒸腾速率Fig.8 The transpiration rate of R.simsii Planch for inoculation treatment under different water gradients
从图9可以看出,在各水分梯度下,CK杜鹃叶片胞间CO2浓度均为最高值,依次为437.7、439、459.57、477、488。W1水分条件下,CK、D、DM杜鹃叶片处理胞间CO2浓度与正常供水相比胞间CO2浓度均上升,CK及D处理差异极显著,DM处理差异显著。与正常供水相比,随着土壤水分含量的降低,CK处理胞间CO2浓度呈上升趋势,在T3水分下达到最大值;D、DM处理则先下降后升高,在T2水分下达到最低值;各接菌处理杜鹃叶片胞间CO2浓度均为CK>D>DM。
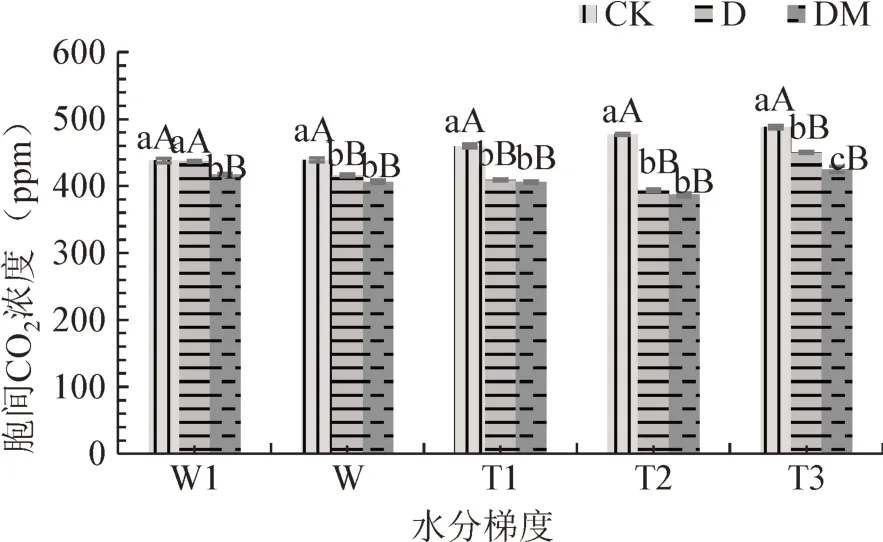
图9 不同水分梯度下接种菌根苗叶片胞间CO2浓度Fig.9 Intercellular CO2 concentration in leaves of R.simsii Planch for inoculation treatment under different water gradients
2.4 不同水分梯度下接种混合菌剂对杜鹃苗叶绿素荧光参数的影响
由表1可知,在W水分条件下,接菌处理的杜鹃叶片Fo、Fm值均大于CK处理,依次为DM>D>CK各处理间差异极显著。相较于W水分处理,W1水分梯度下的Fm值均有所下降,CK处理杜鹃叶片Fo值上升,D、DM处理呈下降变化。与W水分处理相比,随着土壤水分含量的减少CK处理Fo值持续增长,在T3达到最高值234,D、DM处理则先下降,在T2水分下分别达到最低值176、186,后在T3水分下增加分别达到最高值213、236,增幅依次为CK(22.51%)>D(4.92%)>DM(3.06%)。
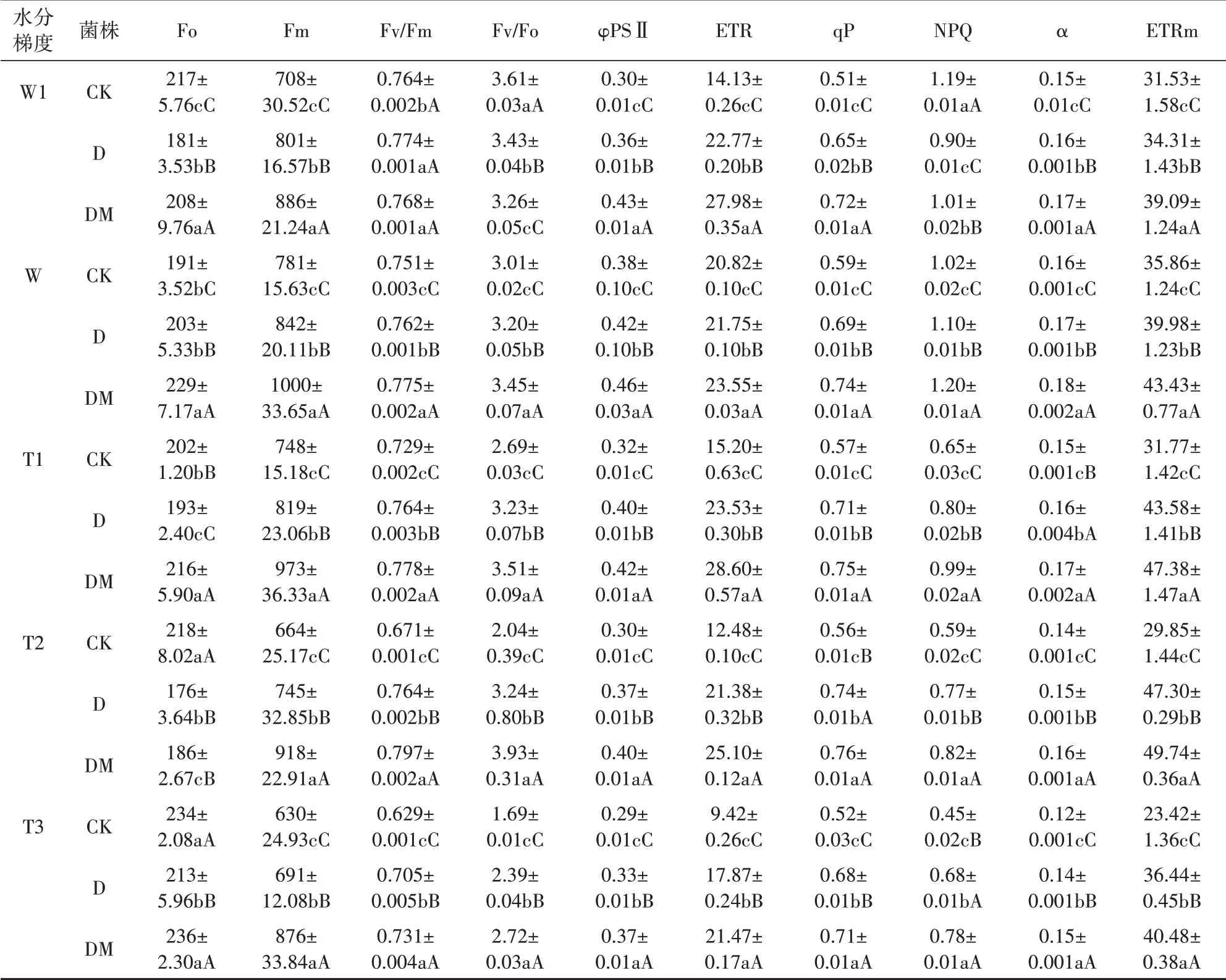
表1 不同水分梯度对杜鹃接菌苗叶绿素荧光参数的影响Table 1 Effects of different water gradients on chlorophyll fluorescence parameters of R.simsii Planch inoculated seedlings
同一水分条件下,接菌杜鹃苗Fv/Fm均高于CK,且差异极显著。除W1水分下D处理Fv/Fm略大于DM处理外(差异不显著,P>0.05),其他水分条件下均为DM>D>CK。与W水分处理相比,W1水分条件下CK、D处理Fv/Fm轻微上升,而DM处理基本没有变化。随着干旱程度的加大CK处理Fv/Fm持续下降,而D、DM处理则先上升后下降,其降幅依次为CK(16.24%)>D(7.48%)>DM(5.68%)。由表1可知,除W1水分处理外,各处理Fv/Fo值为CK(3.61)>D(3.43)>DM(3.26)外,其余水分梯度下均为DM>D>CK。随着土壤水分的减少,CK处理Fv/Fo持续下降,而D、DM处理先上升后下降。
同一水分条件下,各处理PSⅡ值均为DM>D>CK,差异极显著。相较于W水分,在W1条件下,各处理PSⅡ均有不同程度的下降,降幅依次为CK(21.05%)>D(14.29%)>DM(6.52%)。随着干旱胁迫的加剧,各处理PSⅡ均持续下降,降幅依次为CK(23.68%)>D(21.43%)>DM(19.57%)。相较于W水分条件,CK处理在轻度水湿及干旱条件下ETR值均呈下降趋势;而D、DM处理呈上升的变化趋势,并在干旱条件下则先上升后下降,在T2处理下达到最高值。
与W水分条件下相比,在W1水分梯度下,各处理qP值均下降,降幅为CK(13.56%)>D(5.78%)>DM(2.70%)。在干旱条件下,随着胁迫的加重CK处理qP值持续下降,而D、DM处理先上升后下降。且在同一水分梯度下接菌处理qP值均大于CK处理,且均为DM>D>CK,差异极显著(除T2水分下DM与D处理差异显著外)。轻度水分条件下水分处理下CK处理NPQ呈上升趋势,D、DM则出现不同幅度下降,D接菌处理降幅(18.18%)大于DM接菌处理降幅(15.83%)。随着干旱程度的增加,各处理杜鹃叶片NPQ均出现不同程度的下降降幅为CK(57.84%)>D(38.18%)>DM(35.00%),且除W1水分条件下NPQ值大小CK>DM>D外,其余水分下均为DM>D>CK,差异极显著。
相同水分梯度下,各处理杜鹃叶片ETRm、α数值均为DM>D>CK,差异极显著。W1水分梯度下ETRm、α数值均下降,在土壤水分缺失条件下随着干旱程度的加剧,3个处理的杜鹃叶片α数值持续下降,而ETRm的变化则为CK持续下降,D、DM先升高后下降,在T2水分下达到最大值。
3 结论与讨论
植物进行光合作用能力可通过叶绿素含量变化来反映。本研究结果表明,接菌处理杜鹃叶片叶绿素a、b及a+b含量均高于CK,与谌端玉等人研究结果一致[4]。相较于W水分条件,在W1水分条件及土壤缺水条件下,CK处理杜鹃叶片叶绿素a、b及叶绿素总量呈下降变化,而D、DM处理则先升高后下降,在T2处理下达到最高值,这说明在适度缺水环境,菌根苗反而能合成更多的叶绿素来提高杜鹃苗的光合能力,这与何兴元等人研究结果相似[12]。张明生等以甘薯为研究对象,得出植物抗旱性越强叶绿素a/b比值下降的程度越高[13]的结论。本研究表明各水分条件下,接菌处理的杜鹃叶片叶绿素a/b比值低于CK处理,且CK>D>DM,说明接菌苗的叶绿素b对水分变化比叶绿素a敏感,且接菌苗更能适应缺水环境,这与龙海燕等人的研究结果一致[14]。本研究结果表明,对杜鹃幼苗接种菌根真菌能明显减轻干旱对杜鹃幼苗叶片叶绿素合成的抑制作用,其中DM处理的效果好于D处理,且以T2水分条件下最为明显。
本研究结果表明,W1水分处理降低了杜鹃净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr),但接种菌根真菌能增强蒸腾速率来抵抗水湿胁迫的伤害,并且本研究亦证实接种菌根真菌可以提高杜鹃光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)。然而随着胁迫程度的提高,菌处理杜鹃叶片Pn先升高在T2水分下达到最高值,后在T3处理下下降,而CK处理则持续下降,表明接菌处理在适度干旱条件下对杜鹃的作用更为重要,这与田帅等研究得出在水分胁迫时接种AMF可提高刺槐的光合作用水平的结论相似[15]。
叶绿素荧光参数是反应植物抗逆性的重要指标[16],能更内在地反映水分胁迫对植物光系统Ⅱ的影响。在水分胁迫环境中,初始荧光(Fo)升高,植物叶片PSⅡ反应中心遭到破坏[17]。本研究中,W1水分处理下,CK处理Fo明显升高,而接菌处理呈下降趋势;W水分梯度下,接菌处理Fo大于CK处理,在T1、T2水分下,接菌处理Fo呈下降变化,在T3下上升,而CK一直呈上升趋势。这说明在适度胁迫时,接菌处理对杜鹃PSⅡ反应中心具有一定保护作用。在水湿及缺水环境下各处理杜鹃叶片Fm均呈下降趋势,说明水分胁迫降低了杜鹃PSⅡ反应中心原初电子受体QA的还原能力,电子传递活性降低[18]。接菌处理Fm值显著高于CK处理,且DM处理始终大于D处理,缺水环境下,DM处理Fm降幅最小,CK处理降幅最大,说明接菌能提升杜鹃叶片PSⅡ反应中心原初电子受体QA的还原能力,增加其水分胁迫环境的适应能力。
Fv/Fm和Fv/Fo也与植物叶片PSⅡ反应中心的活性密切相关[19],当植物受到胁迫时,Fv/Fm值呈降低变化[20]。本研究中,接菌处理Fv/Fm显著高于CK处理,且在W1水分处理及干旱胁迫下CK处理杜鹃叶片Fv/Fm下降,而接菌处理则先上升后下降,可能是因为适度土壤干旱环境下接菌处理能够明显使杜鹃PSⅡ反应中心潜在活力得到提高同时提升PSⅡ反应中心原初光能转换效率。
本研究中,W1水分梯度下,各处理qP值下降,CK处理NPQ上升,而两个接菌处理NPQ也呈下降变化。在土壤缺水环境下,CK处理中qP值持续下降,接菌处理则先上升后下降,三个处理中的NPQ则都下降,各水分下接菌处理NPQ显著高于CK处理。这可能是由于水分环境胁迫压力让杜鹃光能用于光化学反应的部分减少,使于PSⅡ反应中心的光化学活性降低造成光能过剩,导致qP下降[21]。但接菌处理的杜鹃通过提高NPQ及时消耗掉过剩的光能来减缓胁迫环境对自身的伤害。同时,接菌苗最大电子传递速率(ETRmax)及光能利用效率(α)、均显著高于CK处理,且接菌处理在T2水分处理下ETRm值达到最高,这可能是因为接菌苗会通过提高电子传递速率来响应能量过多耗散带来的影响,增强其水分利用[19]。综上所述,混合接菌能够显著提高杜鹃叶片叶绿素含量、光合参数以及叶绿素荧光参数,增强了杜鹃在水分胁迫下的光合作用。在水分胁迫环境下,接种DM相较于D和CK最能显著提高杜鹃苗的光合能力,且以中度干旱下最为明显。

