肾纤维化相关关键候选基因的生物信息学筛选*
杨洁珂,李健春,林 晓,王人可,樊均明,2,王 丽△
1.西南医科大学附属中医医院 中西医结合研究中心(泸州 646000); 2.成都医学院(成都 610500)
肾脏纤维化是多种慢性肾脏病(chronic kidney disease, CKD)的最终病理转归,也是CKD 进展为终末期肾病(end-stage renal disease, ESRD) 的关键环节。近年来,围绕肾纤维化发生的机制研究较多,包括发现其与炎症、巨噬细胞转分化和促纤维化通路(如TGF-β1/Smad3、Wnt/β-catenin等的异常活化有关[1-2],但确切机制尚不清楚。目前,临床上虽可采用血液净化手段缓解病情,但血透费用昂贵,给患者家庭带来沉重的经济负担,且血透只能暂时延缓病情,故对于抗肾纤维化方法的研究已成为关系国民健康及社会经济发展的重要议题[3]。
生物信息学是一个将计算和分析工具应用于捕获、分析和解释大量生物数据的全新科学领域。近年来,生物信息学分析在生命科学领域得到了广泛的应用,高通量测序可同时提供各实验组中数千个基因的表达水平,直接获取基因分子水平的信息。基于生物信息学的微阵列和高通量测序已被广泛用于预测各种疾病的潜在治疗靶点[4]。本研究拟采用生物信息学方法,对单侧输尿管梗阻(unilateral ureteral obstruction, UUO) 小鼠模型的基因表达谱数据进行分析,同时构建UUO 3 d急性肾损伤(acute kidney injury,AKI)和UUO 7 d CKD模型,并验证生物信息分析筛选出的与肾纤维化相关的核心基因,以期建立一种基于生物信息学分析筛选肾纤维化关键候选基因的方法,为CKD发病机制和抗纤维化治疗靶点的研究提供新思路。
1 材料与方法
1.1 主要仪器与试剂
仪器:Light CyclerR480Ⅱ PCR仪(Roche,瑞士);ECL凝胶成像系统(BIO-RAD,美国);VS120虚拟滑动显微镜(Olympus,日本)。试剂:Trizol (invitrogen,美国,15596018);逆转录试剂盒KitHiScript©Ⅲ RT SuperMix for qPCR(+gDNA wiper) (Vazyme,中国,7E34219);尿素氮、血清肌酐定量试剂盒(南京建成, C013-2-1, C011-2-1);HE染色试剂盒(Beyotime,中国,C0105);Masson 三色染色液(Baso,中国,BA-4079B);山羊抗小鼠IgG 抗体(北京中杉金桥, SP-9002); RELB、υCAM1、Pdlim1抗小鼠单克隆单抗(Santa cruz,美国,sc-393084、 sc-13160、 sc-48366)。
1.2 测序数据预处理及动物造模
从GEO数据库(https://www.ncbi.nlm.nil.gov/geo/)下载序列号为GSE79443的基因表达谱,由Arvaniti等[5]提交,实验平台基于GPL13112 Illumina HiSeq 2000(Mus musculus)平台。GSE79443数据集包括假手术组样本(4个),UUO组样本(结扎2 d和8 d各3个)。将下载的原始转录组高通量测序数据(GSE79443)转为fastq文件进行质控,以确保测序数据适合进一步分析。使用STAR软件将fastq文件转为sam文件,samtools将sam文件转为bam文件,随后利用feature Counts软件将bam文件转count文件,以便用于后续差异表达基因分析。
同时,构建UUO动物模型对差异基因生物信息学筛选结果进行体内验证。购买SPF级C57BL/6J雄性小鼠21只,8 周龄,体重均 20 g,购自成都达硕实验动物有限公司[SCXK(川) 2015-030],饲养于西南医科大学动物实验中心[SYXK(川) 2018-065]。小鼠饲养于恒温 20 ℃~22 ℃,湿度50%~60%环境中,每日光照、黑暗各12 h交替处理,适应性饲养1周后构建动物模型,随机分为假手术组、UUO 3 d组和UUO 7 d组。模型组予以右侧输尿管结扎,手术后3、7 d收集血清、肾脏进行后续实验。所有操作均符合实验动物伦理学要求(审批号: 2019DW083),实验过程实行 3R 原则。
1.3 差异表达基因筛选
将预处理完成的counts数据运用boxplot绘制箱型图分析数据质量分布,DESeq2归一化后进行差异基因分析, 设置P<0.01 和|log2FC|≥1,并使用Pheatmap软件绘制热图。利用基因的表达计数文件对数据进行成组对比分析,org.Hs.eg.db程序包和GENECODE 提供的注释文件对筛选出来的差异表达基因进行注释。其筛选的条件设定为|log2Fold Change|>1、FDR<0.01 时,选取UUO 2 d和UUO 8 d相较于假手术表达的差异基因用于后续分析。
1.4 差异表达基因集富集分析(gene set enrichment analysis,GSEA)
利用GSEA对基因集进行信号通路富集分析,对本研究中筛选的与肾纤维化密切相关的基因模块进行注释,探索模块基因所参与的信号通路。
1.5 加权基因共表达网络分析(weighted gene co-expression network analysis, WGCNA)
WGCNA不仅可进一步用于构建基因网络,还可以检测基因模块并识别模块内的中心参与者(即中枢基因)[6]。对筛选出的差异表达基因作WGCNA,构建共表达模块,分析并寻找与肾纤维化密切相关的关键基因模块。进一步使用Cytoscape 3.5.2 的插件cytohubba将各关键模块连接度最高的前 20个基因制作蛋白相互作用网络图。
1.6 血清生化检测和病理染色观察
小鼠心脏采血后于4 ℃静置过夜,随后以3 000 r/min,离心半径8.4 cm,离心15 min,吸取上层血清。准备好收集的血清,按照操作说明书分别检测血清肌酐、尿素氮。新鲜肾脏组织经过固定、脱水、包埋切片后,置于65 ℃烤箱烤片2 h,予以二甲苯脱蜡,梯度酒精复水。予以苏木素滴染2 min,自来水冲洗;伊红浸染1 min,自来水冲洗后行HE染色;予铁苏木素滴染5 min,自来水冲洗,丽春红染色2 min,冲洗后予以磷酸钼、苯胺蓝复染,冰醋酸冲洗行Masson染色;脱水透明封片后,置于光镜下观察肾脏和肠道的结构改变及肾脏纤维沉积情况。
1.7 Real-time PCR检测差异基因表达水平
收集肾组织后,用Trizol法提取组织总 RNA。酶标仪检测所得总RNA的纯度和浓度,再用逆转录试剂盒合成cDNA,最后进行Real-time PCR反应(表1)。设计反应条件为95 ℃ 10 min,40 个扩增循环(95 ℃ 15 s,55 ℃ 15 s,72 ℃ 30 s)。每个样本重复测量3次,使用GAPDH作为内部对照。采用2-△△Ct法分析目的基因相对表达量。

表1 Real-time PCR所用引物序列
1.8 蛋白质印迹技术检测蛋白水平
各组分别取适量肾脏皮质于RIPA蛋白裂解液和PMSF混合液中裂解25 min提取总蛋白,考马斯亮蓝法定量蛋白浓度,加Loading Buffer煮沸后上样,SDS-PAGE凝胶电泳分离转移至PVDF膜,5% BSA室温封闭1 h,加入相应的一抗RELB/υCAM1/Pdlim1 (1∶1 000)、GAPDH (1∶50 000)于4 ℃摇床过夜,次日加相应的HRP偶联的二抗 (1∶2 000)于室温孵育1 h,滴加ECL发光液于Bio-rad凝胶成像系统成像。以Image J软件分析条带灰度值,并计算目的蛋白与内参蛋白GAPDH的相对表达量。
1.9 免疫组织化学法检测核心基因表达
取新鲜组织固定脱水、包埋、切片,脱蜡复水后放入pH 6.0的柠檬酸缓冲液中微波抗原修复,自然冷却至室温,用3%过氧化氢孵育10 min,PBS 洗涤3次,5 min/次。滴加5% BSA 封闭15 min,滴加一抗,4 ℃湿盒孵育过夜。次日PBS 洗涤3次,5 min/次,滴加辣根过氧化物酶标记的二抗,室温孵育1 h,PBS 洗涤 3 次,5 min /次,DAB 显色,镜下控制显色时间,蒸馏水冲洗终止反应。染核、水洗、脱水、透明、封片后置于光镜下观察抗原沉积情况。
1.10 统计学方法

2 结果
2.1 筛选差异表达基因
对从GEO数据库下载的原始数据进行质控后绘制箱型图(图1A),由此可看出各样本数据质量分布均匀,9个样本中位数均约在同一水平,且各组数据的分布紧密程度类似,均无溢出值,表示此原始数据质量尚可。将各样本基因表达情况绘制成热图(图1B),可见组内各样本同种基因表达趋势一致,组间基因表达差异有统计学意义(P<0.05)。进一步两两组间分析可见,假手术组、模型组间基因表达差异有统计学意义(P<0.05),UUO 2 d和UUO 8 d组间部分基因比较,差异有统计学意义(P<0.05)(图1C)。进而选取两个模型组间存在差异表达,并与假手术组亦存在差异表达的1 503个基因用于后续分析(图1D)。

图1 原始数据的预处理和初筛
2.2 加权分析及中枢基因网络图的构建
利用WGCNA进行一步法网络系统聚类树的构建,采用动态剪切法,将高度低于0.25的基因模块进行合并,在排除代表未能分配到任何1个已知模块中的灰色基因模块后,共得到 4 个基因共表达模块(图2A)。其中碧绿色模块和蓝色模块与肾纤维化相关性最高,分别从碧绿色模块和蓝色模块中各挑选出连接度最高的前10个基因,绘制相互作用网络图(图2B~C),提示这些基因在纤维化的疾病进程中可能扮演着重要的角色。

图2 差异表达基因的聚类树及中枢基因相互作用网络图
2.3 差异表达基因的通路聚集
GSEA分析可用来评估已预先定义的基因集中的基因其在与表型相关度排行表中的分布趋势,通过对初步筛选出来的差异表达基因进行信号通路分析发现:多个信号通路被激活,包括JAK-STAT3/上皮细胞转分化/TNF等信号通路(图3A)。其中,这些基因最主要富集在上皮细胞转分化与炎症应答信号通路,差异有统计学意义(P<0.05)(图3B~C);同时也发现,仅有少量信号通路被抑制(如氧化磷酸化信号通路),提示这些基因主要参与介导炎症反应和纤维化的形成。

图3 差异表达基因的GSEA分析
2.4 小鼠肾功能的改变和病理损伤程度
与假手术组相比,模型组的血淸肌酐、尿素氮均明显升高,UUO 3 d组肌酐升高较UUO 7 d组明显,考虑3 d为急性损伤而7 d已迁延至CKD,差异有统计学意义(P<0.05)(图4A~B);肾脏的HE染色结果显示,与假手术组相比,模型组肾小球明显萎缩硬化,肾小管扩张明显,伴随肾小管上皮细胞坏死脱落,且UUO 7 d组较UUO 3 d组损伤程度更重,肾小管明显扩张。Masson三色染色结果显示,与假手术组相比,模型组间质蓝染明显,提示发生了纤维化,且随着模型时间延长纤维化程度加重,提示UUO 3 d模拟的是AKI,而UUO 7 d更贴近CKD表现(图4C)。

图4 小鼠生化指标和肾脏病理水平
2.5 核心基因表达水平验证
通过进一步查阅相关资料和文献筛选出Pdlim1、Arld5a、mlkl、IFR1、RELB、υCAM1 6个与纤维化进程关系更为密切的基因。通过Real-time PCR检测假手术组和UUO组(3、7 d)小鼠肾脏中该6种基因的相对表达情况。结果显示,与假手术组相比,模型组这些基因表达均出现增高,且随着模型严重程度的加重呈现明显上调,与生物信息学分析预测的结果相一致。其中RELB、υCAM1、Pdlim1的表达量升高最为明显,差异有统计学意义(P<0.05)(图5A)。进一步对这3个分子进行蛋白水平的检测,蛋白质印迹技术结果显示,RELB、υCAM1、Pdlim1表达量随模型时间的延长表达量明显上升,差异有统计学意义(P<0.05)(图5B~E);免疫组织化学法染色观察亦有同样的发现,模型组均较假手术组表达量高,主要沉积在肾小管间质及部分细胞核内,且随着模型严重程度的上升,3个分子的表达均呈现明显上调(图5F)。由此推测,RELB、υCAM1、Pdlim1 3种核心基因的表达与肾纤维化的严重程度呈正相关。
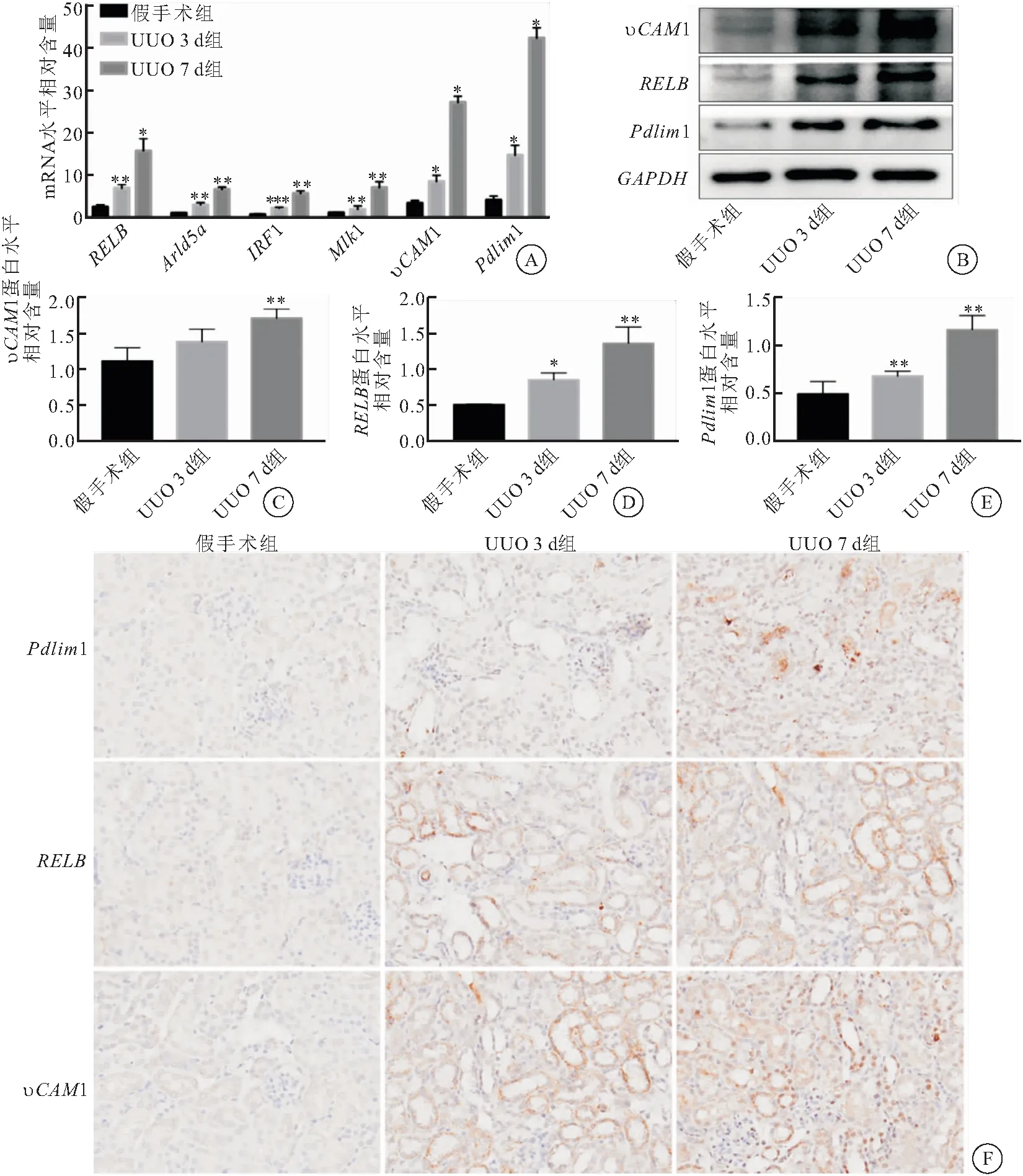
图5 核心基因的表达验证
3 讨论
CKD发病机制较复杂,但最终都将发展为ESRD,且均伴随不同程度的肾纤维化,二者有密不可分的联系[7-8]。肾脏纤维化主要表现为肾小球硬化、肾小管萎缩和扩张、肾小管间质纤维化等[9]。由于间质内的细胞外基质积聚和肾小管萎缩是进行性肾病的常见组织病理学特征,故UUO常作为CKD病理生理学研究模型[10]。本研究通过利用生物信息学分析了2 d和8 d的UUO差异表达的基因,即代表着从AKI进展至CKD过程中差异表达的基因。
首先对差异基因进行GSEA分析发现,差异基因主要富集在上皮细胞转分化与炎症应答信号通路。大量研究[9]表明,肾小管间质纤维化是CKD形成的最重要的驱动因素之一。肾损伤发生后,肾小管上皮细胞产生各种生物活性分子,并通过上皮-间质转化(EMT)驱动间质性炎症和纤维化,进一步加重肾脏损伤。有研究[11]报道,过度的免疫炎症应答可导致CKD的发生并促进病程向ESRD的发展。浸润的白细胞可通过损伤肾实质细胞或通过分泌大量趋化因子和细胞因子,上调炎症级联反应,加重肾损伤,促进肾纤维化的形成[12-13],这与本研究通过GSEA分析的结果一致。
本研究分析了WGCNA,并对聚类树中的20个中枢基因进行文献检索,从而筛选出RELB、υCAM1、Mlkl、Pdlim1、IRF1、Arld5a中枢基因作进一步研究。通过Real-time PCR检测发现,RELB、υCAM1和Pdlim1基因的表达上调明显。研究[14]表明,RELB可活化诱导一系列下游靶基因的表达,并参与肿瘤细胞增殖、血管生成、细胞侵袭和EMT,其作为NF-κB的亚基,在NF-κB的替代途径中起着重要作用。有研究[15]明确指出,RELB可防御肺部疾病诱导的炎症,而炎症又与纤维化的形成有着密切关系。υCAM1编码由细胞因子活化的内皮细胞表达的细胞表面唾液酸糖蛋白,介导白细胞-内皮细胞粘附和信号转导。据研究[16]报道,υCAM1的表达增加可导致肾脏持续炎症,最终诱导纤维化的形成。Pdlim1最为特殊,它是与细胞骨架相关的细胞质蛋白,可参与成纤维细胞中应力纤维的组装、拆卸和定向。有研究[17-18]发现,Pdlim1可抑制结直肠癌细胞的EMT和转移,且敲低后可以逆转巨噬细胞中磷酸化p65表达的减少和炎性细胞因子的分泌。但这与在生物信息学分析和肾脏组织中检测的表达趋势相反,未来将进一步对Pdlim1在肾脏中发挥的作用进行研究。
综上所述,本研究通过生物信息学分析和小鼠体内验证,初步筛选到一些新的关键候选基因(RELB、υCAM1、Pdlim1),为肾脏纤维化的干预治疗提供新的理论依据。但后续仍需进一步通过体内外研究揭示这些基因的生物学功能以及在CKD疾病进程中的具体作用机制。

