甲状腺乳头状癌患者术前炎症标志物与预后的相关性研究*
李 杨,唐 悦,邓 显,李 旭,郑成万,杨 辉
西南医科大学附属医院 甲状腺外科(泸州 646000)
甲状腺癌(thyroid cancer,TC)是最常见的内分泌恶性肿瘤之一,而甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是TC的主要类型[1]。年龄、肿瘤大小、甲状腺体外侵袭和淋巴结转移率等多种临床特征,已被应用于甲状腺肿瘤的临床病理分期系统(tumor node metastasis,TNM),以预测TC复发率[2]。由于TNM分期系统仍不能完全筛选出术后需要辅以I131放射性治疗的高危TC患者,因此有必要使用更多简单易行的生物标记物来制定更精确的治疗策略。
研究[3-7]表明,慢性炎症与包括TC在内的多种恶性肿瘤的不良预后有关。一些炎症标志物,如淋巴细胞与单核细胞比值(lymphocyte to monocyte ratio,LMR)、中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、血小板与淋巴细胞比值(platelet to lymphocyte ratio,PLR)等与乳腺癌、卵巢癌、胃癌、结直肠癌和食管癌等的不良预后有关[8]。在分化型TC中,研究[9-10]提示,NLR可能与TC患者术后的无病生存率有关,但是此类炎症标记物对TC的临床影响仍不甚明确。因此,本研究拟探究术前外周血中LMR、NLR及其他临床病理资料与PTC预后之间的相互关系,评估其在临床实践中的应用价值。
1 资料与方法
1.1 临床资料
选取2013年7月至2019年10月于西南医科大学附属医院行PTC根治性切除手术(即甲状腺双侧叶全切除+中央区淋巴结清扫或颈侧区淋巴结清扫术)的408例患者为研究对象。纳入标准:1)初诊且为首次行PTC根治性切除手术;2)术后病理诊断证实为PTC;3)术前CT扫描提示无远处转移迹象;4)术后未辅以I131放射治疗;5)未合并其他恶性肿瘤。排除标准:1)术前有明显炎症或感染;2)术前接受过放、化疗等;3)术前及术后病理资料不完整;4)合并糖尿病、严重肝功能异常及血液系统疾病等。本研究获医院伦理委员审批同意。
1.2 观察指标
纳入患者的外周血标本均在术前1周内采集,包括血常规和甲状腺球蛋白(thyroglobulin,Tg)。根据白细胞(white blood cell,WBC)、中性粒细胞(heutropenia,Neut)等血细胞数量计算患者的NLR、LMR及PLR值。术后病理诊断由本院病理科2名病理学专家同时进行。根据TC诊疗规范(2018年版)[11],以术后病理诊断为依据进行分期。在本研究中,将转移的淋巴结数目与切除的总淋巴结数的比值作为淋巴结转移率(node density,ND),根据术后5年内复发的ROC曲线,计算出ND截断值。
1.3 随访情况
以患者术后第1天为随访起点,随访截止日期为2019年10月10日。随访策略为手术后前3个月,每个月随访1次,以后1年内每3个月随访1次,1年后每6个月随访1次。术后第1天开始至疾病复发之日或末次随访时间定义为患者术后无复发生存时间,以月为单位。所有患者随访时间为1~60个月,中位随访时间为38个月。随访过程中失访或发生特殊事件(如发生意外或其他疾病而死亡等)的病例未纳入本研究中。
1.4 统计学方法
采用SPSS 22.0、GraphPad Prism 8.2统计软件进行数据分析,定性资料以例数(%)表示,组间比较采用2检验。ROC曲线用于确定连续变量最佳截断值的选取。利用最佳截断值将患者分为两组,以评估预后的意义。使用Kaplan-Meier曲线估算术后无复发生存时间(relapse-free survival time,RFS),以Log-rank检验进行单因素分析,多因素分析采用Cox比例风险回归模型进行,以确定影响预后的独立危险因素。检验水准α除特别说明外均设定为0.05。
2 结果
2.1 研究对象基本特征及5年RFS的单因素分析
纳入的408例患者中,男、女分别占21%和79%。根据术后5年复发的ROC曲线计算得出,115例(28%)患者显示ND≥0.36。单因素分析显示,肿瘤大小、TNM分期、ND、甲状腺腺体外侵袭、临床病理分期、术前Tg水平、外周Neut计数、NLR和LMR是术后5年RFS的影响因素(表1)。
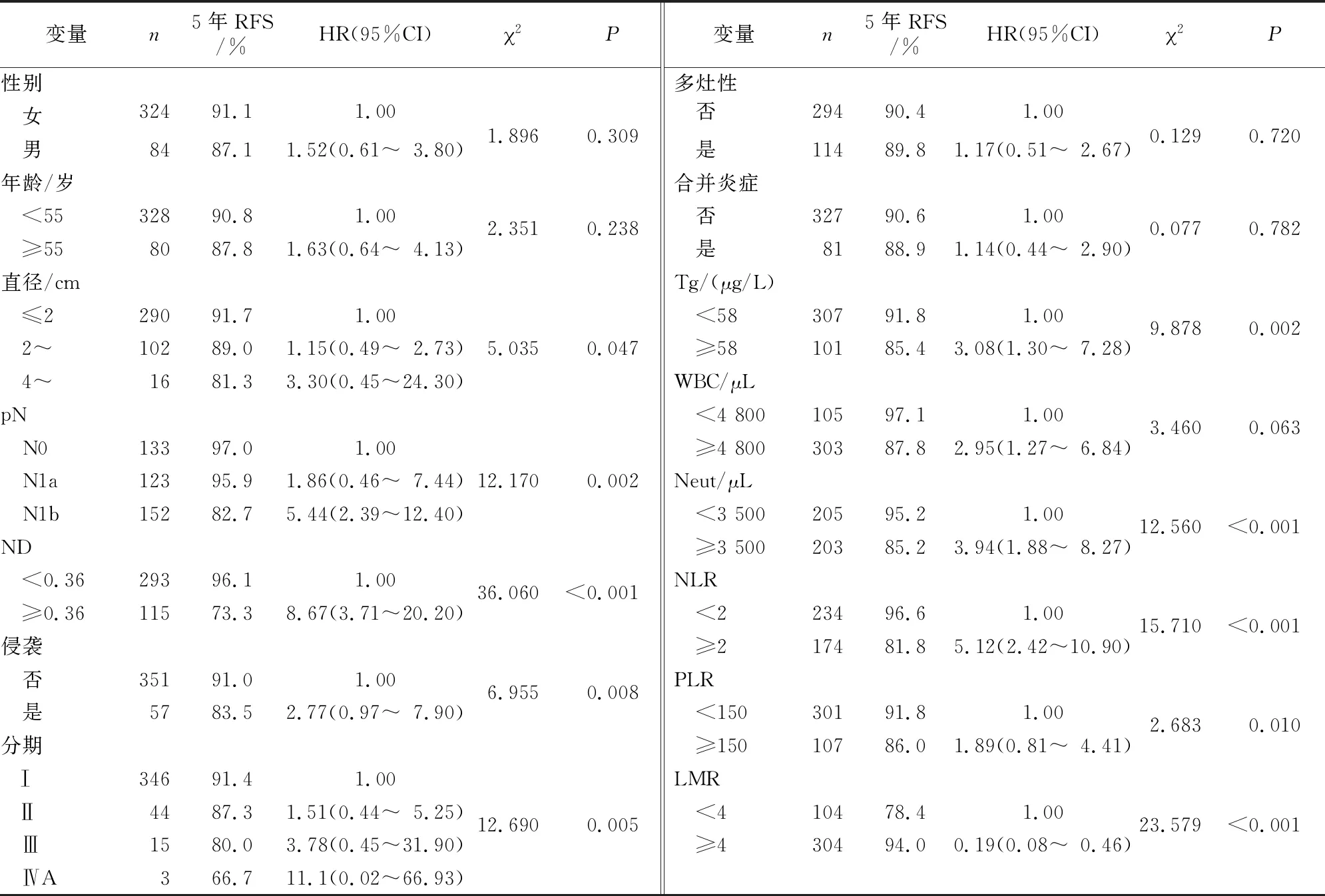
表1 研究对象的基本特征及5年RFS的单因素分析
2.2 PTC根治性切除术患者的预后分析
5年内复发的PTC患者呈现较低的LMR和较高的NLR分布(P<0.001)。使用ROC曲线分析计算出用于预测疾病复发的LMR、NLR的最佳截断值,临界值LMR=4、NLR=2预测患者的复发率,其灵敏度分别为60.71%、78.57%,特异性分别为82.63%、62.11%,AUC分别为0.765、0.729(图1)。
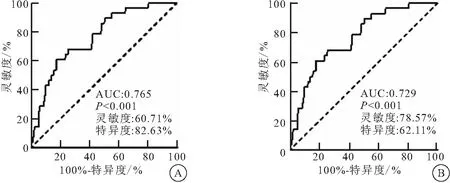
图1 预测疾病复发的ROC曲线
在Kaplan-Meier曲线中,LMR<4的PTC患者5年RFS为78.4%、NLR≥2的PTC患者5年RFS为81.8%,LMR≥4、NLR<2的PTC患者术后5年RFS分别为94.0%和96.6%。以上结果表明,LMR<4、NLR≥2的PTC患者预后较差(P<0.001)(图2)。

图2 预测患者术后5年RFS的Kaplan-Meier曲线
在多因素预后分析中,LMR、NLR和ND是影响PTC患者预后的独立危险因素(P<0.05)(表2)。

表2 PTC根治性切除术患者的多因素分析
根据LMR、NLR和ND因素,将患者分为3组:A组(0或1个因素为阳性)、B组(2个因素为阳性)、C组(3个因素均为阳性)(表3)。与A组(5年RFS 95.6%)和B组(5年RFS 81.4%,HR 3.61)相比,C组的远期预后(5年RFS 49.6%,HR 22.5)明显较差(P<0.05)(图3)。

表3 3组患者的预后分析

图3 3组术后5年RFS的Kaplan-Meier曲线
3 讨论
TC的发生发展与肿瘤浸润WBC的密度和类型存在相关性[12-13],不同类型的WBC在TC中的作用不同[14]。髓样来源的抑制细胞(myeloid derived suppressor cell,MDSC)是表型异质且尚未完全成熟的髓样细胞[15]。MDSCs在健康群体中很少见,但在恶性肿瘤患者中却常见升高,显示出强大的免疫抑制潜力[16],并与恶性肿瘤的不良预后相关。与良性结节或其他非癌性甲状腺疾病相比,TC患者术前循环MDSC的水平有明显升高[17-18]。MDSCs通过抑制T细胞和自然杀伤细胞的抗肿瘤活性来促进免疫逃逸[19]。MDSCs还通过加速上皮-间质转化和间充质-上皮转化参与血源性传播[20]。因此,外周循环中的MDSCs与各种恶性肿瘤的临床晚期和远处转移相关[21]。目前,TC患者的预后仍比较难预测[22]。研究[23]表明,外周血中NLR与肿瘤直径和复发风险呈正关。此外,在甲状腺恶性肿瘤中,Neut密度与肿瘤大小相关[24],这可能是由于代表全身炎症反应的Neut释放炎症因子、血小板释放血管生成因子等,能促进恶性肿瘤的发生和进展[25-27]。其中,NLR、PLR和LMR被认为可能与恶性肿瘤患者术后存活率有关[28]。
已有研究[25-28]表明,NLR、LMR、PLR的高低可能与多种恶性肿瘤患者预后有关。尽管如此,但有关分化型TC与此类炎症标志物的关系目前仍没有一致结论。Chen等[29]研究表明,NLR降低是预测复发的独立危险因素,提示分化型TC患者预后较差。然而Kim等[30]研究发现,尽管在不同的研究中NLR存在不同的截断值,但较高的NLR预示分化型TC患者预后较差。史巧静等[31]研究发现,TNM分期、PLR、NLR均是影响PTC患者预后的独立危险因素。本研究结果表明,高ND、高NLR及低LMR均为预测PTC患者预后的独立危险因素;同时具有高NLR、低LMR及高ND特征患者术后5年RFS明显降低,提示预后更差。这一结果提示,若将NLR、LMR以及ND 3个因素联合应用评估预后,将具有一定的临床实用价值。本研究结果显示,高NLR(≥2)、低LMR(<4)的患者5年RFS较对照组差。恶性肿瘤患者的预后不仅取决于肿瘤微环境及其生物学特征,还取决于宿主相关因素。与恶性肿瘤有关的全身慢性炎症性反应是决定恶性肿瘤发生、进展和患者术后无复发生存时间的重要因素[32-33],然而有关慢性炎症与PTC患者的预后关系仍需更多的相关性研究加以验证。根据国际抗癌联盟TNM对PTC患者术后进行的TNM虽然可作为判断预后的一项生物学行为,但不能反应慢性炎症与恶性肿瘤之间的关联[34]。本研究对PTC患者术前NLR、LMR与预后的相关性进行了分析,其指标获得具有快速、廉价、可重复等优势,其在临床实践中的应用价值较高。
综上所述,本研究结果显示,高ND、高NLR及低LMR均为预测PTC患者预后的独立危险因素;同时具有高NLR、低LMR及高ND特征患者术后5年RFS明显降低,预后更差。因此ND、NLR、LMR联合应用可作为评估患者预后的指标,对临床工作具有一定的指导意义。本研究为在同一家机构进行的一项回顾性研究,存在一定局限性和选择偏倚。目前在国内外的研究中,对于NLR、LMR的最佳临界值选取尚无定论,故后续仍需进一步的大样本、多中心、前瞻性研究对本研究结果加以验证。

