非洲堇叶片试管快繁体系技术研究
李佳蔓, 曹昆彬, 黄振, 陈炙, 郭洪英
四川省林业科学研究院, 四川 成都 610081
非洲堇又名非洲紫罗兰,拉丁学名:Saintpaulia ionanthaWendl.,为苦苣苔科非洲堇属植物,多年生常绿草本。非洲堇为聚伞花序、腋生、花序高出叶丛、每个花茎上1朵或数朵并生、花冠平展[1]。花瓣类型有单瓣、半重瓣、重瓣、皱瓣等,花型有花边型、三色堇型、星型、斑纹型、波浪型、胡蜂花型、钟花型、管花型等,花色几乎包含了除大红和黄色外的各种颜色[2-4]。非洲堇栽培条件简单,室内具有散射光的窗边,适宜人居住的空调环境等即可满足其生长需要,而且只要养护得当,一年四季均可开花,是优良的窗台、案头点缀花卉,被誉为“室内花卉皇后”[5-6]。另外,其品类繁多,至2005年,美国非洲紫罗兰协会正式登记的非洲堇品种已超过9 500种,而未登记或未命名的估计在20 000种以上[2]。我国于20世纪80年代开始从美国和荷兰引种非洲堇试管苗,目前少数中外合资园艺公司仅有小批量的生产,栽培尚不普遍,但发展前景依然很好。
研究拟针对非洲堇某些新奇品种开展组织培养技术研究,开发非洲堇新奇品种高效组培再生技术体系,快速繁殖优良品种,为非洲堇新奇品种的规模化生产奠定基础。
1 材料与方法
1.1 材料来源
研究材料购买于正规种苗公司,共13个品种,材料背景清晰(见表1)。

表1 非洲堇外植体来源信息Tab.1 Source information of Saintpaulia explants
1.2 方法
(1)外植体选择
选择颜色深绿、形态饱满的非洲堇植株中部完整叶片作为外植体材料,用毛刷轻刷以除去杂质,流水冲洗3~5 min,捞出置于平盘中,用吸水滤纸吸干表面水分。
(2)消毒处理
在超净工作台上消毒清洗后(消毒处理方案见表2),用无菌吸水滤纸吸干表面水分,切分成1 cm2左右大小方块,接种于附加蔗糖浓度为30 g·L-1、卡拉胶浓度6.5 g·L-1的MS培养基上。每个消毒处理接种10个方块(每瓶一个外植体),实验重复3次。光照强度2000 Lux~3000 Lux,培养温度25±3℃(如无特殊说明,培养条件下同)。第5天开始记录污染率、褐化率,到第15天,统计整个过程的污染率、褐化率,计算无菌外植体获得率。
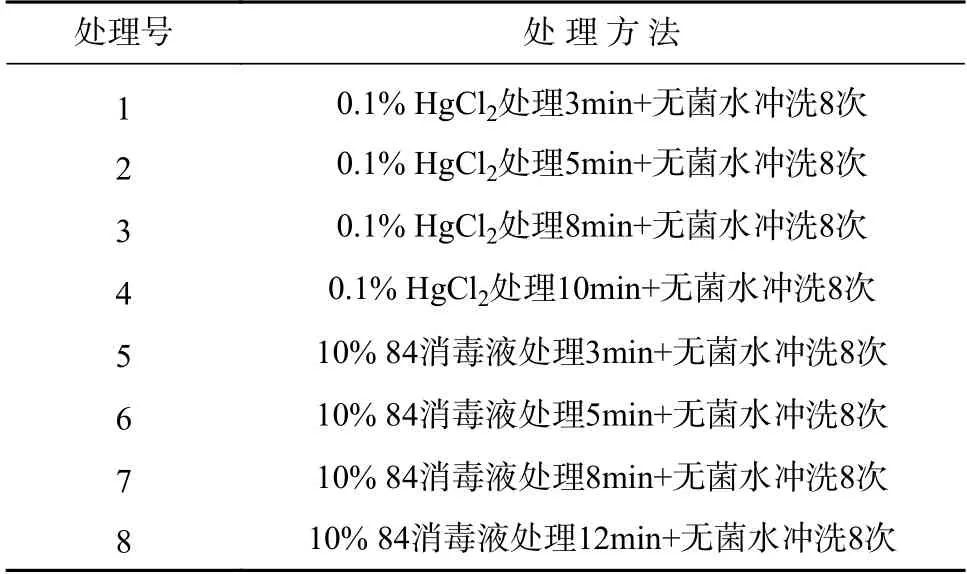
表2 非洲堇外植体消毒方案Tab.2 Sterilization plan for Saintpaulia explants
(3)愈伤出芽诱导与增殖培养基筛选
无菌外植体转接到诱导培养基上进行愈伤诱导和不定芽诱导,培养30d后,统计愈伤诱导率和不定芽诱导率,计算单个外植体平均出芽个数和正常不定芽率。以期筛选最佳愈伤出芽诱导培养基。
将诱导培养基中获得的正常不定芽分成单株或3~4个芽为一丛,接种于含有6-BA、NAA、IBA不同浓度配比的MS培养基中进行增殖培养,采用3因素3水平的L9(3)4正交试验设计,用以筛选较佳的非洲堇增殖培养基配方,设计及结果见表5、表6。25~30天继代1次,连续培养3代,统计有效增殖芽数,计算有效增殖系数。
(4)生根培养
以大量元素减半的MS培养基(以下简称1/2MS)为非洲堇生根培养的基本培养基,蔗糖减半,添加不同浓度配比的IBA和NAA,预设IBA浓度分别为0.5、1.0、1.5 mg·L-1,NAA浓 度 分 别 为0.02、0.05、0.08 mg·L-1,采用完全试验设计,以期筛选出较佳的非洲堇生根培养基激素浓度配比。选取有效不定芽接种于生根培养基中,15天后统计生根率及根系长势。
1.3 数据统计
所得数据采用Excel 2015和SPSS 21.0软件进行处理分析,Origin 2019进行绘图。
污染率(%)=污染的外植体数/接种外植体总数×100%;
褐化率(%)=褐化的外植体数/无菌外植体总数×100%;
无菌外植体获得率(%)=1-污染率-褐化率-致死率;
愈伤诱导率(%)=诱导出愈伤的无菌外植体数/接种无菌外植体总数×100%;
不定芽诱导率(%)=发生不定芽的无菌外植体数量/接种无菌外植体总数×100%;
单个外植体不定芽平均发生个数=不定芽总数/发生不定芽外植体数;
正常不定芽率(%)=正常不定芽数/不定芽总数×100%;
有效增殖系数=有效不定芽总数/接种不定芽数;
有效不定芽:即培养一个周期后,完整叶心四周均匀着生着形态完整的叶片不少于5片。
畸形不定芽:叶心无发育或发育不全、叶片发育不全等的非正常不定芽。
2 结果与分析
2.1 消毒效果与无菌外植体获得
两种消毒剂对非洲堇外植体的消毒效果随作用时间推移变化趋势大致相同,均为先升高后降低的趋势,并且两种消毒剂均能对非洲堇外植体起到较好的消毒作用,0.1% HgCl2作用5 min和10% 84(有效成分NaClO,有效含氯量8 000~10 500 mg/L)作用8 min,无菌外植体获得率分别为67.9%和72.8%。消毒剂作用时间过短达不到消毒效果,过长使外植体组织受到破坏失去活性,致死率增加(见图1)。

图1 不同消毒方案的消毒效果Fig.1 Disinfection effect of different sterilization plan
其中,处理7较适合非洲堇外植体消毒,13个品种均获得了无菌外植体,但同种消毒方式对不同品种非洲堇外植体的消毒效果呈现极显著差异,消毒效果最好的品种为莓果泡芙,获得率78.93%;其次为魔法悬垂,获得率76.65%,消毒效果最差的为品种为暗恋,获得率仅为48.82%(见表3)。
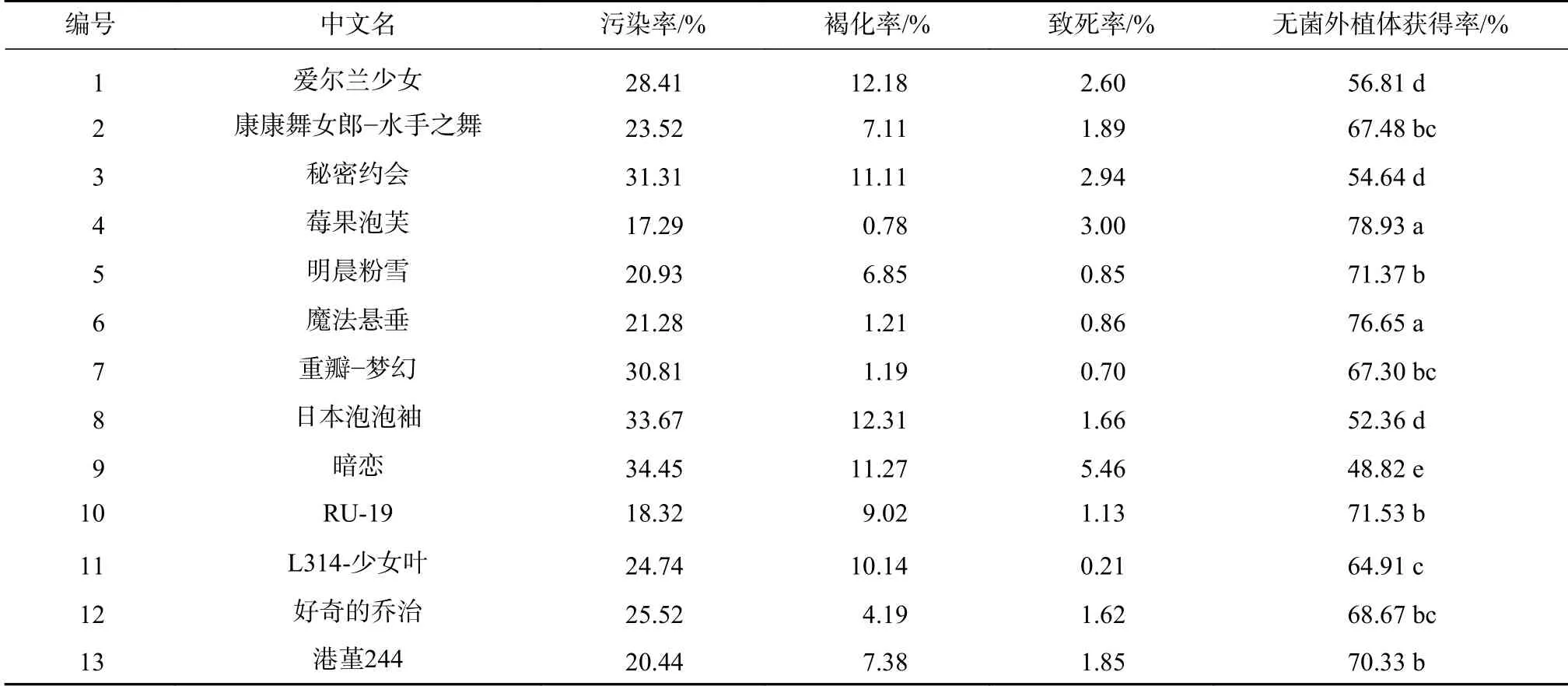
表3 无菌外植体获得Tab.3 Acquisition of sterile explants
2.2 愈伤出芽诱导培养
非洲堇愈伤出芽诱导实验方差分析结果表明(见表4):在不同激素浓度配比的诱导培养基上,非洲堇无菌外植体的愈伤诱导率(A)、不定芽诱导率(B)、单个外植体不定芽平均发生个数(C)、有效不定芽率(D)均存在极显著差异(P<0.01),表明6-BA和NAA是非洲堇愈伤诱导的2个关键因子。
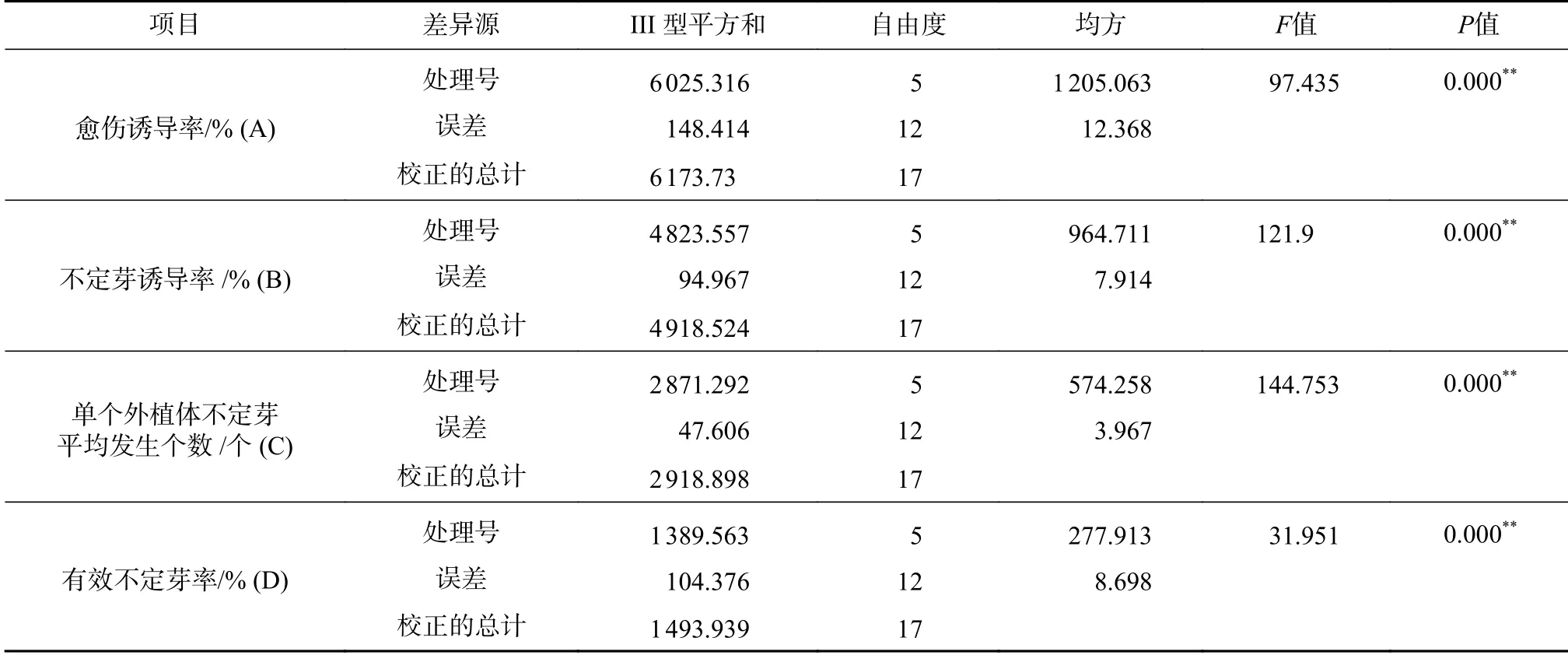
表4 非洲堇愈伤出芽诱导方差分析Tab.4 Variance analysis of callus bud induction of Saintpaulia ionantha
诱导实验Duncan法多重比较结果表明(见表5):随着6-BA浓度增高,A、B、C三个指标随之增高,而指标D则呈现先增高后降低的趋势;当NAA浓度升高时(处理5、7、8),指标A、B、C随之升高,但差异不显著,指标D逐渐降低且差异极显著,这主要由于激素浓度过高,畸形芽发生比例上升,畸形芽上升个数和不定芽上升个数的比值增大。当6-BA≥0.15 mg·L-1、NAA≥0.1 mg·L-1时,单个外植体不定芽发生个数在15~50个间,平均在25.4~3.65个间,正常芽发生个数在8~32个间,平均在13.5~20.1个间,当6-BA为0.15 mg·L-1、NAA为0.1 mg·L-1时(处 理4),A为65.9%,B为58.0%,此处理条件下,不定芽发生时间大致相同,生长较为一致,且C为25.42%,D达78.9%,平均正常芽个数20.1个(见图2A)。

表5 非洲堇愈伤出芽诱导Tab.5 Callus bud induction of Saintpaulia ionantha
因此认为,处理4为较好的非洲堇诱导培养激素组合,即MS+蔗糖30 g·L-1+卡拉胶6.5 g·L-1+6-BA 0.15 mg·L-1+NAA 0.1 mg·L-1为非洲堇较佳的诱导培养基配方。
2.3 继代增殖培养
正交试验方差分析(见表6)可知,影响因子中,6-BA浓度对非洲堇有效增殖系数(D)具有显著影响(P<0.05),NAA、IBA浓度对非洲堇增殖系数影响不显著(P>0.01),极差分析(见表7)表明:3个因素的主次关系为:甲>乙>丙,即6-BA>NAA>IBA,且6-BA对非洲堇增殖系数的影响是后两者的近3倍。Duncan法多重比较结果显示,非洲堇继代增殖培养的最佳激素配比为甲2乙2丙3,及6-BA、NAA、IBA分别为0.2、0.1、0.15 mg·L-1平均有效增殖系数可达6.43(见图2B)。
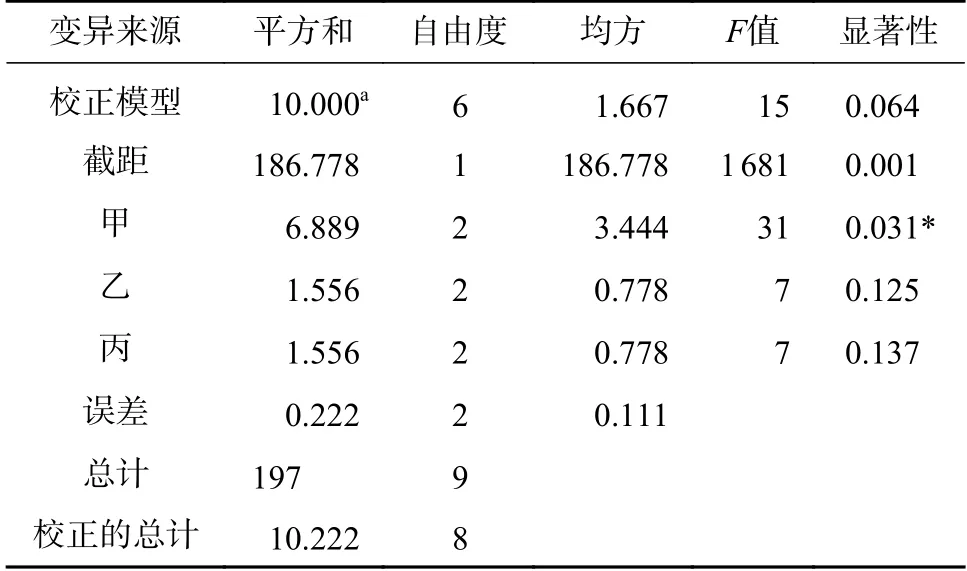
表6 方差分析结果Tab.6 Results of ANOVA analysis
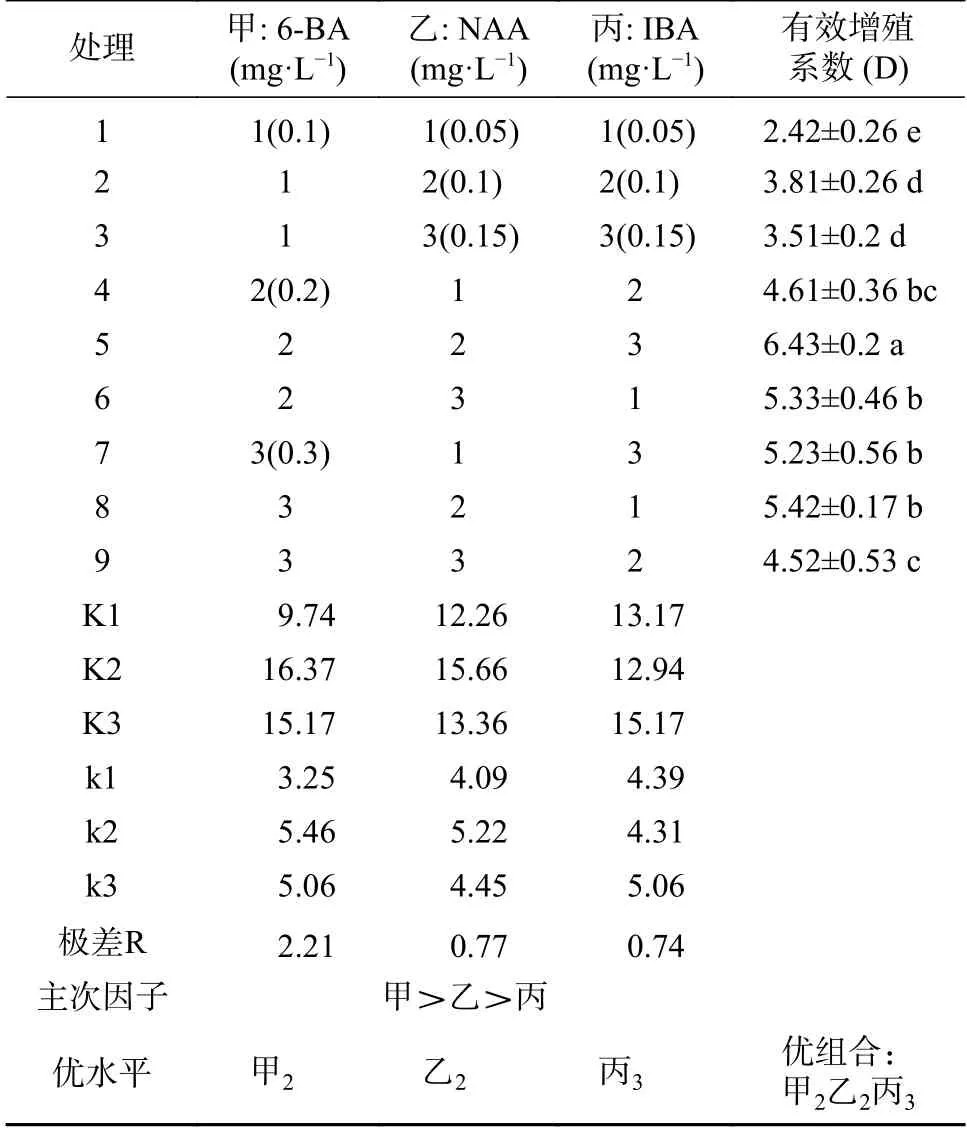
表7 增殖培养正交试验设计及结果Tab.7 Design and results of proliferation cultureorthogonal experiment
2.4 生根培养基筛选
生根试验表明(见表8和图3),当NAA浓度一定时,非洲堇生根率随IBA浓度的升高呈现先升高后趋于平稳的趋势(处理1~3),同理,当IBA浓度一定时,NAA对非洲堇生根的影响也表现出相同的趋势(处理4~6)。当IBA为1.0 mg·L-1、NAA为0.05 mg·L-1时(处理5),平均生根率92.67%,生根数14~50条/株,平均生根数>20条/株,此时,苗健壮、基部愈伤少、根系发达(见图2-C)。当IBA>1.0 mg·L-1、NAA>0.05 mg·L-1时,随着两种激素浓度的上升,生根率上升极为缓慢(处理6、8、9),尤其当NAA为0.1 mg·L-1时,苗基部愈伤较多,移栽时根容易受损(见图2-D),因此选用处理5为非洲堇较佳的生根培养基激素浓度配比。
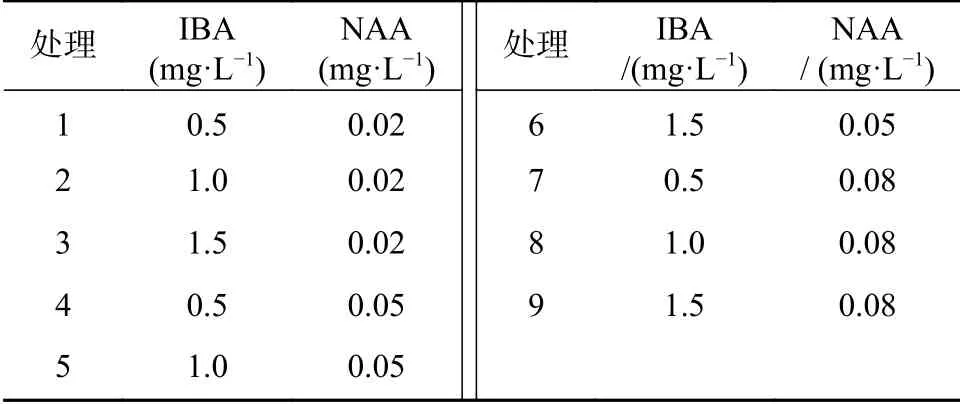
表8 非洲堇生根试验设计Tab.8 Rooting experiment design of Saintpaulia ionantha

图2 非洲堇组织培养各阶段图片Fig.2 Different stages pictures of tissue culture of Saintpaulia ionantha
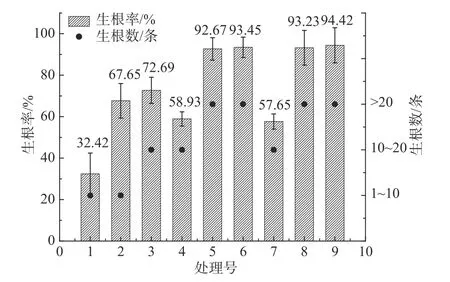
图3 不同激素配比对非洲堇生根的影响Fig.3 Effect of different hormone ratios on the rooting of Saintpaulia ionantha
3 讨论
研究发现,0.1% HgCl2和10% 84只要在合理的作用间范围内均能使非洲堇叶片得到较好的消毒效果(无菌外植体获得率>65%),但HgCl2属剧毒化学品[7],需特殊储存场所,废液处理也有特定要求,今后可尝试使用有效成分为NaClO的消毒液进行消毒,以期在脱毒的同时达到保护环境的效果。
外源激素种类和浓度配比决定植物组织培养过程中器官分化的方向。6-BA和NAA配合使用,可以使非洲堇叶片诱导愈伤和愈伤出芽一步完成,这与娄渊样[8]对非洲堇组培一次成苗技术研究有相似之处,不同之处在于激素浓度,本研究中,在6-BA 0.15 mg·L-1、NAA 0.1 mg·L-1的MS培养基中,非洲堇的愈伤诱导率为65.93%,同时不定芽诱导率58.11%,单个外植体不定芽(无根)平均发生个数为25.42个,而娄发现在6-BA和NAA均为0.5 mg·L-1培养基上,一个叶块上可长出数棵带根的完整小苗,导致不同结果主要与材料基因型、试验方法、内源激素种类和含量等因素有关。正交试验表明,6-BA、NAA、IBA 3种激素,仅6-BA是非洲堇继代增殖的主要影响因子,该结果与纪丽丽[9]的研究结果雷同,她认为6-BA对大花重瓣型非洲紫罗兰芽分化、增殖起决定性作用,但增殖倍数与6-BA和NAA的浓度比值有关。组培苗诱导生根过程中,IBA和NAA是常用的两种激素,根据培养材料不同,两种激素单独使用或配合使用以达到生根目的。朱立明[10]以大花重瓣型非洲紫罗兰组培无根苗作为试验材料,培养基附加0.1 mg·L-1NAA生根率可达82.1%,且根粗壮而长;耿明清[11]在培养基中附加0.2 mg·L-1IBA,非洲紫罗兰试管苗生根效果好;何家涛[12]单独使用NAA或IBA或IAA均能使非洲紫罗兰无根苗生根,且生根率在97%以上;本研究采用两种激素配合使用,当IBA和NAA分别为1.5和0.05 mg·L-1时,非洲堇生根效果理想。

