鼻腔鼻窦腺泡状横纹肌肉瘤10例临床病理分析
姚 瑶,化宏金,潘敏鸿,李 扬,李红霞,杨沁怡,丁 颖,范钦和,李 海
横纹肌肉瘤是一类显示不同程度骨骼肌分化方向的肉瘤类型,它们是一组异质性肿瘤。WHO(2020)软组织和骨肿瘤分类根据临床组织病理学及分子遗传学特征将其划分四种不同的亚型:胚胎性、腺泡状、多形性及梭形细胞/硬化性[1]。1956年Riopelle等[2]首次报道腺泡状横纹肌肉瘤(alveolar rhabdomyosarcoma, ARMS),Enzinger等[3]报道ARMS发病率占横纹肌肉瘤的30%,其属于小蓝圆细胞肉瘤,单纯组织形态学通常仅显示有限的骨骼肌分化特征,诊断较为困难。多数ARMS发生于周围软组织,位于鼻腔鼻窦者临床罕见。众多不同类型小蓝圆细胞肿瘤好发于鼻腔鼻窦,需进行鉴别诊断。此外,ARMS有部分免疫组化标志物异常表达,易造成误诊,对治疗效果和预后产生较大影响。本文收集10例鼻腔鼻窦腺泡状横纹肌肉瘤(sinonasal tract alveolar rhabdomyosarcoma, SNT-ARMS)进行回顾性分析并复习文献,探讨其诊断及鉴别诊断的要点,以期提高对该肿瘤的认识水平。
1 材料与方法
1.1 临床资料收集2013年6月~2020年10月南京医科大学第一附属医院病理学部诊断的10例SNT-ARMS,病例均经高年资病理科医师复核、确诊。10例患者年龄9~64岁,中位年龄42岁,3例男性,7例女性;其中7例为住院患者,3例为会诊或门诊患者。
1.2 免疫组化标本均经常规10%中性福尔马林固定,常规脱水,石蜡包埋,4 μm厚切片,行HE及免疫组化EnVision法染色,并设立阴、阳性对照。抗体包括:desmin、Myogenin、MyoD1、CKpan、CK-L、CD56、CK5/6、Ki-67、Syn、CgA、NSE、NeuN、NF、S-100、ALKp80、CD99、CD34、CD20、CD3、CD5、CD45RO、CD45、Pax-5、HMB-45、CK8/18、SMA、p53、FLI-1、TTF-1、Melan-A、CD138、PLAP、CD117、SOX10、SMMHC、CK7、EMA、Tdt。抗体均购自福州迈新公司,具体操作步骤严格按试剂盒说明书进行。
1.3 FISH检测FOXO1基因FISH FOXO1(13q14)基因断裂探针购自广州安必平医药公司,根据HE染色切片选择需要区域的肿瘤组织进行染色,FISH操作流程进行检测。判读标准:探针为GSP FOXO1(13q14)基因断裂探针(双色),探针杂交区域为人类13号染色体长臂(13q14)FOXO1基因所在区域,红色荧光信号标记FOXO1基因5′端,绿色荧光信号标记FOXO1基因3′端。DAPI定位细胞核,荧光信号为蓝色。正常细胞为单个细胞核中2个黄色信号,FOXO1基因断裂的细胞为细胞核中1个红色信号、1个绿色信号、1个黄色信号。每张切片至少计数100个肿瘤细胞,如FOXO1基因断裂细胞的数目≥30%,则判定为FOXO1基因断裂,检测结果为阳性。
2 结果
2.1 临床特征6例住院患者均因鼻腔或鼻窦部新生物及相应临床症状就诊,多表现为鼻塞、涕血、复视等症状;CT示鼻腔鼻窦内见软组织影,病变累及周围骨质呈膨胀性破坏,2例体积较大,累及范围较广者显示鼻中隔及眼眶、颅底骨质破坏。3例会诊及门诊患者均因颈部淋巴结肿大就诊,淋巴结穿刺结果分别诊断为转移性神经内分泌癌、淋巴瘤及横纹肌肉瘤,后经PET-CT检查发现全身多发淋巴结肿大及鼻腔内软组织影;其中1例还伴全身多发骨转移,影像学诊断提示为淋巴瘤可能性大;另1例女性患者因鼻窦横纹肌肉瘤放疗2年后,发现乳腺肿块就诊,乳腺肿块穿刺结果诊断为ARMS。
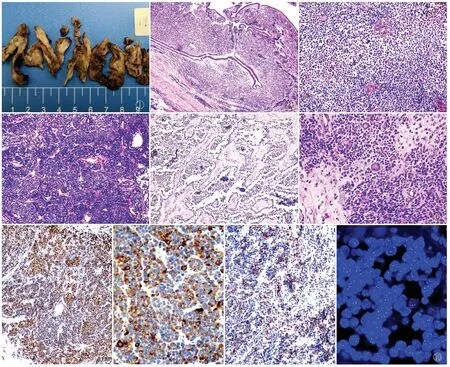
2.2 病理检查眼观:送检标本均为灰白、灰黄色破碎组织一堆,部分呈息肉样改变(图1),大小1.2 cm×1 cm×0.8 cm~4.5 cm×4 cm×3.8 cm。镜检:在鼻腔黏膜下方固有层内可见幼稚的小蓝圆细胞弥漫浸润,未见肿瘤组织侵犯表面鼻窦黏膜上皮(图2),肿瘤细胞形态一致、分化原始,胞质稀少,核深染(图3),核分裂象活跃,部分病例内肿瘤组织大片坏死,存活的肿瘤组织围绕血管周排列。肿瘤细胞呈弥漫实性片状或巢团状排列,瘤巢之间可见纤维血管间隔(图4),部分瘤巢中央的细胞因退变失去黏附性而脱落、漂浮于腔内,形成腺泡状或囊性结构(图5),多数病例内肿瘤细胞的实性片状、巢状及腺泡状排列方式通常混合存在,比例多少不等;3例肿瘤组织缺乏腺泡状生长方式,完全以实性片状排列为主。4例肿瘤组织可见散在肿瘤性花环状多核巨细胞(图6),2例肿瘤内可见少许圆形上皮样横纹肌母细胞,含有丰富的嗜酸性胞质;1例肿瘤内部分细胞含有显著的透明样胞质。淋巴结内转移性肿瘤形态与原发灶一致,特征性的腺泡状结构可见,转移至乳腺内的肿瘤组织呈弥漫片状及单行样排列,累及乳腺小叶,易误诊为乳腺浸润性小叶癌。
2.3 免疫表型本组desmin、Myogenin和(或)MyoD1均阳性,其中Myogenin弥漫一致核强阳性(图7),MyoD1阳性强度和范围较弱。6例肿瘤细胞CD56阳性,3例肿瘤细胞CKpan局灶阳性(图8),2例肿瘤细胞CK-L局灶阳性,4例肿瘤细胞Syn阳性(图9),1例肿瘤细胞Syn及CK-L共阳性,1例肿瘤细胞Syn及CKpan共阳性,1例肿瘤细胞ALKp80阳性。CK5/6、CgA、NSE、NeuN、NF、S-100、CD99、CD34、CD20、CD3、CD5、CD45RO、CD45、Pax-5、HMB-45、CK8/18、SMA、p53、FLI-1、TTF-1、Melan-A、CD138、PLAP、CD117、SOX10、SMMHC、CK7、EMA、Tdt均阴性。
2.4 FISH检测FOXO1基因10例患者均行FISH检测,结果显示:均存在FOXO1基因断裂重组(图10)。
①②③④⑤⑥⑦⑧⑨⑩
2.5 随访及预后本组有8例患者获得随访,其中6例患者死亡,中位生存期13个月,2例患者术后11、27个月生存至今。
3 讨论
头颈部ARMS临床相对少见,多发于鼻腔或鼻旁窦,临床表现不具有特征性,多数肿瘤生长迅速,位于鼻腔者可产生鼻塞、鼻衄等症状,而鼻旁窦的患者则可能出现眼球突出、面部胀痛、复视及颅神经受损的症状[4-5]。SNT-ARMS影像学检查缺乏特异性,难以做出准确的术前诊断。SNT-ARMS易有淋巴道转移,在疾病的进程中可以出现局部或全身多发的淋巴结转移,罕见情况下肿瘤以颈部淋巴结肿大为首发症状,全身检查后在鼻腔鼻窦处查及原发灶。本组3例会诊或门诊患者,均因颈部淋巴结肿大就诊,后经PET-CT检查后发现全身多发淋巴结肿大及鼻腔内软组织影,其中1例伴全身多发骨转移。此外,有文献报道女性SNT-ARMS患者有转移至乳腺的倾向[6]。本组亦有1例女性患者因鼻窦ARMS放疗2年,发现乳腺肿块复发就诊。亦有文献报道,SNT-ARMS的肿瘤细胞广泛累及骨髓及血液系统,类似于白血病的临床表现[7-8]。
SNT-ARMS与发生于软组织的同类肿瘤相似,肿瘤由形态单一、分化幼稚的小蓝圆细胞组成,肿瘤排列呈巢状。瘤巢之间为纤维血管间隔,肿瘤细胞巢中央的细胞常因退变失去黏附性而脱落、漂浮于腔内,形成特征性的腺泡状结构,其特征性的腺泡状结构在淋巴结和其他脏器的转移灶中常见。ARMS的肿瘤分化通常较为原始,不见或仅见少许横纹肌母细胞分化,约50%病例可见一种独特的核位于外周的花环状肿瘤性巨细胞,具有诊断提示意义[3-5]。ARMS有一些少见的形态学亚型:实性亚型者缺乏常见的腺泡状、巢状生长结构,而表现为弥漫实性片状的生长方式,诊断较为困难;透明细胞亚型则表现为肿瘤细胞具有丰富的透明状胞质[9],易误诊为其他类型的透明细胞肿瘤包括转移性肾透明细胞癌、透明细胞肌上皮癌等。本组病例几乎囊括上述经典的及罕见的组织形态学特征。
鼻腔鼻窦是众多小圆细胞肿瘤好发部位,其多种不同分化方向的肿瘤类型均可呈未分化小蓝圆细胞形态,包括:上皮性癌(未分化癌、NUT中线癌、小细胞神经内分化癌及SMARCB1基因缺陷型癌)、肉瘤(尤因肉瘤、横纹肌肉瘤、间叶性软骨肉瘤、差分化滑膜肉瘤)、淋巴瘤、小细胞性恶性黑色素瘤以及嗅母细胞瘤等[10]。在病理医师的日常临床诊断实践中,不同类型的鼻腔鼻窦小蓝圆细胞恶性肿瘤鉴别困难;病理医师通常需依赖多组免疫组化标志物检测,必要时尚需借助分子遗传学检测手段才能确诊。
鉴别诊断:(1)小细胞神经内分泌癌,部分鼻腔鼻窦的ARMS可以表达细胞角蛋白或神经内分泌标志物,且表达模式与小细胞神经内分泌癌相同,细胞角蛋白呈核旁点状高尔基体区阳性,易误诊[4,11]。在鼻腔鼻窦小圆细胞肿瘤的诊断过程中,病理医师通常采用上皮、淋巴、神经内分泌、恶性黑色素瘤的免疫组化标记进行诊断,由于多数SNT-ARMS患者年龄偏大使病理医师对横纹肌肉瘤的诊断放松警惕,当肿瘤细胞上皮和(或)神经内分泌标志物表达时易诊断为癌。因此,笔者建议在鼻腔鼻窦部位查见小蓝圆细胞肿瘤时,应进行横纹肌分化的免疫组化标志物进行诊断,包括desmin、MyoD1和Myogenin,后两者均为胞核表达,且更有特异性[12]。(2)SNT-ARMS常会出现区域或全身淋巴结的转移,有时还会以淋巴结肿大为首发症状。部分ARMS还可表达ALK蛋白[13],易误诊为间变大细胞淋巴瘤,诊断时需考虑淋巴结内ARMS存在的可能性,辅以相应的横纹肌标志物可以确诊。此外,ARMS不表达CD30,其虽表达ALK蛋白,但并不具有ALK基因的易位[14],与间变大细胞淋巴瘤不同。(3)胚胎性横纹肌肉瘤(embryonal rhabdomyosarcoma, ERMS):鼻腔鼻窦也是ERMS包括其特殊亚型葡萄簇肉瘤的好发部位[15],实体亚型的ARMS易与ERMS混淆[16]。ERMS组织学的异质性更为显著,肿瘤细胞除表现为圆形外,还可呈梭形、星状或卵圆形,间质常出现黏液变性,横纹肌母细胞分化更为显著。此外,ARMS与ERMS的横纹肌母细胞多呈条带状、蝌蚪样不同,其横纹肌母细胞多为圆形,胞质内横纹少见;出现花环状多核巨细胞高度提示为ARMS。免疫表型:虽然两种均表达横纹肌标志物,但ARMS通常表现为Myogenin胞核的弥漫强表达,而ERMS则表现为Myogenin强弱不等的表达[12]。对于鉴别较为困难的病例,FOXO1融合基因的检测可以明确区分。对于部分罕见的病例兼有ERMS和ARMS成分,此类肿瘤的本质尚存争议,但它们通常不具有ARMS特有的分子遗传学改变,且生物学行为更接近于ERMS[17-18]。
分子遗传学:ARMS具有特征性的染色体易位t(2;13)(q35;q14),产生PAX3-FOXO1融合基因[18-19],少数病例(约10%)为PAX7-FOXO1融合基因。不同的融合基因类型具有预后意义,伴PAX7-FOXO1的病例通常比PAX3-FOXO1者预后好[19]。PAX3-FOXO1融合基因并非为ARMS所特有,最近文献报道鼻腔鼻窦双表型肉瘤(biphenotypic sinonasal sarcoma, BSNS)少数病例也可以涉及相同的融合基因,有部分BSNS病例甚至可以伴横纹肌的分化,导致两者混淆[20-21]。两者的组织形态学差异明显,BSNS属于低级别的单形性梭形细胞肉瘤,特征性的表达SMA和S-100蛋白。上述结果提示分子遗传学检测可以为软组织肿瘤的诊断提供帮助,但评判时需结合肿瘤的镜下形态学特征综合考虑。
预后与治疗:临床显示ARMS比ERMS预后差,成年患者比儿童及年轻人预后差,而发生于鼻腔鼻窦者比发生于四肢软组织或头颈部其他部位者预后差[4-5,15]。本组10例患者中有8例获得随访,其中6例患者死亡,中位生存期13个月。手术联合化疗和(或)放疗的综合性治疗是首选的治疗方案,早期患者提倡手术切除后结合放、化疗;局部晚期患者可考虑先诱导化疗或放疗,待肿块缩小后再行手术,以提高肿瘤完整切除的机会[22]。有远处转移的横纹肌肉瘤者预后不佳,但最新针对晚期ARMS治疗的研究表明,先通过大剂量的放疗合并化疗控制原发灶和转移灶,再给患者行移植同种异体来源的造血干细胞,可以使部分患者即使是临床Ⅳ期的患者也能获益,患者可保持肿瘤无复发状态达1年以上[23]。

