调强放疗联合GP方案化疗对Ⅲ期非小细胞肺癌患者的效果
李敏杰,田玉龙,黄平平
(郑州大学第五附属医院 放疗科,河南 郑州 450000)
非小细胞肺癌(non-small cell lung cancer,NSCLC)属于肺部常见恶性肿瘤,早期具有较高隐匿性,故多数患者在确诊时已发展至中晚期,错失手术机会。临床多采用放疗、化疗联合方式治疗NSCLC,可延长生存期,改善生活质量[1-2]。调强放疗(intensity-modulated radiation therapy,IMRT)是一种较为常见放疗方式,具备定位准确、精准照射及计划的优点,在临床具有较高疗效,而在以往研究中,着重研究临床疗效与不良反应,而针对免疫功能作用相关研究数据较少[3-4]。本研究选取郑州大学第五附属医院收治的108例Ⅲ期NSCLC者,分析IMRT联合吉西他滨、顺铂方案(GP方案)化疗的效果,现报告如下。
1 资料和方法
1.1 一般资料选取2018年5月至2020年1月郑州大学第五附属医院收治的108例Ⅲ期NSCLC者,参照随机数表法分成研究组与对照组,分别为54例。对照组中男30例,女24例,年龄28~69岁,平均(48.57±9.70)岁,TNM分期为28例Ⅲa期、26例Ⅲb期,病灶位置为中央型26例、周围型28例,体质量49.6~79.1 kg,平均(64.36±7.35)kg,身高158.9~183.1 cm,平均(171.12±5.98)cm,卡氏评分63~79分,平均(71.06±3.95)分;研究组中男29例,女25例,年龄28~70岁,平均(49.06±10.45)岁,TNM分期为31例Ⅲa期、23例Ⅲb期,病灶位置为中央型31例、周围型23例,体质量48.9~79.3 kg,平均(64.11±7.57)kg,身高160.1~180.5 cm,平均(170.33±5.09)cm,卡氏评分65~78分,平均(71.52±3.22)分。两组年龄、性别、TNM分期、病灶位置、体质量、身高、卡氏评分等一般资料比较,差异无统计学意义(P>0.05)。
1.2 入组标准(1)纳入标准:①经组织病理学诊断为Ⅲ期NSCLC;②符合放疗、化疗适应证;③资料完整;④对本研究知情并签署知情同意书;⑤初次放化疗治疗。(2)排除标准:①重要器官严重障碍者;②对研究药物过敏者;③合并全身感染性疾病严重者;④伴有其他恶性肿瘤者;⑤伴有自身免疫功能严重缺陷者。
1.3 治疗方法
1.3.1对照组 接受GP方案化疗治疗。第1~3天静滴顺铂(江苏豪森药业集团有限公司生产,国药准字H20010743)25 mg·m-2,静滴时长3 h;第1~8天静滴吉西他滨(远大医药黄石飞云制药有限公司生产,国药准字H20133194)1 000 mg·m-2,静滴时长约30 min,3周为1个疗程。持续治疗4个疗程。
1.3.2研究组 基于对照组加用IMRT治疗。待化疗4个疗程结束后,进行IMRT治疗,具体步骤为:固定体位,利用CT定位和勾画大体的肿瘤靶区,外扩0.6~0.8 cm作为临床靶区,包括部分高危淋巴结的引流区域,再外扩1.0~1.5 cm作为计划靶区;以95%等剂量线将计划靶区覆盖,处方总剂量60 Gy,共30次,每次2 Gy,每日1次,每周5次。
1.4 疗效评估标准肿瘤已完全消退,1个月内无新病灶且无复发为完全缓解;肿瘤明显减小,比治疗前体积减少>50%,1个月内无新病灶产生为部分缓解;肿瘤有所减小,比治疗前体积减少≤50%,1个月无新病灶产生为稳定;肿瘤体积增大>25%或者产生新病灶为进展。将稳定率、部分缓解率、完全缓解率总和计为疾病控制率。
1.5 观察指标(1)疾病控制率。(2)两组治疗前后T淋巴细胞亚群,即CD3+、CD4+、CD8+、CD4+/CD8+。取晨起空腹4 mL静脉血,离心取血清,经免疫荧光法对血清CD3+、CD4+、CD8+、CD4+/CD8+水平进行检测。(3)两组治疗前后炎症因子,即肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、IL-2水平。取晨起空腹静脉血3 mL,离心取血清,经酶联免疫吸附法对血清TNF-α、IL-6、IL-2水平进行检测。(4)治疗前后两组肿瘤标志物变化,即细胞角蛋白19片段(fragment of cytokeratin 19,CYFRA21-1)、神经元特异性烯醇化酶(neuronspecific enolase,NSE)、糖类抗原199(carbohydrate antigen 199,CA199)。取晨起空腹3 mL静脉血,离心取血清,经化学发光免疫法对血清CYFRA21-1、CA199、NSE水平进行检测。(5)两组不良反应状况,即骨髓抑制、白细胞减少、血小板减少、恶心呕吐等。
2 结果
2.1 疾病控制率与对照组(53.70%)相比,研究组疾病控制率(72.22%)升高(P<0.05)。见表1。
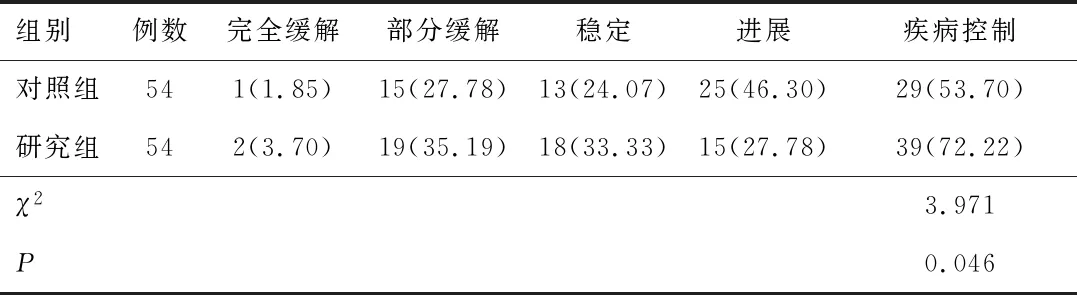
表1 两组疾病控制率比较[n(%)]
2.2 T淋巴细胞亚群治疗前两组CD3+、CD4+、CD8+、CD4+/CD8+比较,差异无统计学意义(P>0.05);治疗后研究组CD3+、CD4+、CD4+/CD8+较对照组高,CD8+较对照组低(P<0.05)。见表2。

表2 两组T淋巴细胞亚群变化比较
2.3 血清炎症因子水平治疗前两组TNF-α、IL-6、IL-2水平比较,差异无统计学意义(P>0.05);治疗后研究组TNF-α、IL-6水平较对照组低,IL-2水平较对照组高(P<0.05)。见表3。
表3 两组治疗前后血清炎症因子水平变化比较
2.4 肿瘤标志物治疗前两组NSE、CYFRA21-1、CA199水平比较,差异无统计学意义(P>0.05);治疗后研究组NSE、CYFRA21-1、CA199水平低于对照组(P<0.05)。见表4。

表4 两组肿瘤标志物变化比较
2.5 不良反应研究组恶心呕吐发生率(20.37%)、白细胞减少发生率(18.52%)、骨髓抑制发生率(14.81%)、血小板减少发生率(22.22%)与对照组(24.07%、25.89%、20.37%、18.52%)比较,差异无统计学意义(P>0.05)。见表5。
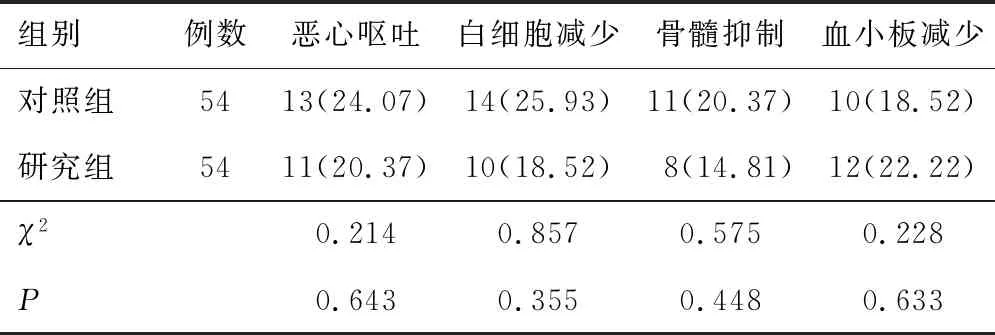
表5 两组不良反应发生情况比较[n(%)]
3 讨论
中晚期NSCLC化疗方案中较为常用的是GP方案,可有效干扰癌细胞的DNA复制与转录,同时抑制肿瘤细胞有丝分裂,进而达到广谱的抗癌效果,还能干扰癌细胞DNA修复,增强临床治疗效果,但其不良反应相对较多,多数患者无法耐受,进而致使临床疗效欠佳[5]。临床研究显示,在化疗基础上加用放疗,可进一步增加临床疾病控制率,延长生存期,还能改善患者生活质量[6]。本研究结果显示,与对照组(53.70%)相比,研究组疾病控制率(72.22%)升高,说明IMRT联合GP方案化疗的疗效显著,临床应用价值较高。
研究指出,NSCLC的发生、发展以及预后均与免疫功能相关[7]。T淋巴细胞所介导免疫方式为细胞免疫,而CD3+、CD4+、CD8+在机体的免疫功能调节中发挥作用,其中CD3+、CD4+能启动免疫应答,进而发挥抵抗肿瘤效果;CD8+分化成细胞毒性T细胞与肿瘤或者感染细胞,如果CD4+/CD8+下降,免疫功能受抑制,使肿瘤细胞出现免疫逃逸,从而加剧病情发展[8-9]。目前IMRT联合GP方案化疗与免疫功能关系的相关数据较少。本研究结果显示,治疗后研究组CD3+、CD4+、CD4+/CD8+较对照组高,CD8+较对照组低,提示IMRT联合GP方案化疗可有效改善机体免疫功能。肿瘤细胞可抑制免疫功能,而IMRT联合GP方案化疗可有效清除肿瘤细胞,进而解除免疫抑制效果,达到调节免疫功能目的。
研究指出,肿瘤标志物水平在肺癌诊断、预后评估、疗效判定中意义重大。本研究显示,治疗后研究组NSE、CYFRA21-1、CA199水平低于对照组,说明IMRT联合GP方案化疗可抑制血清肿瘤细胞,缓解病情发展。其中NSE属于糖酵解酶,存活在正常的神经、肿瘤细胞以及神经内分泌细胞内,一旦恶变,可释放至血液内,此时血清内NSE水平升高;CA199是糖类抗原之一,可在多种类细胞内检出;CYFRA21-1归类于可溶性片段,在上皮细胞内存在,是检测NSCLC的一种重要肿瘤标志物[10-12]。
IL-6高水平表达可加快肿瘤血管生成速度,进而促进肿瘤细胞的增殖与生长;IL-2可促进T淋巴细胞活化与增殖,增强免疫功能;高水平表达TNF-α能破坏各种细胞因子间正常协作,阻滞免疫系统对于肿瘤细胞攻击,并能诱发多种内源性损伤,促进病情发展[13-15]。本研究结果显示,治疗后研究组TNF-α、IL-6水平较对照组低,IL-2水平较对照组高,说明IMRT联合GP方案化疗治疗可抑制炎症反应,延缓病情发展。IMRT联合GP方案化疗方案在抑制肿瘤细胞同时,还对器官起保护作用,可降低受损组织释放炎症因子,减轻炎症反应。本研究结果显示,研究组恶心呕吐、白细胞减少、骨髓抑制、血小板减少发生率与对照组比较,差异无统计学意义,说明IMRT联合GP方案化疗治疗安全性有保证,无明显新生不良反应。
综上所述,IMRT联合GP方案化疗治疗Ⅲ期NSCLC患者效果明显,可显著增强免疫功能,减轻炎症反应,下调肿瘤细胞因子。本研究选取样本量较少,针对本研究结果应进行多中心、大样本量论证。

