参归补血汤提取工艺的优化及对IDA小鼠贫血的改善作用和JAK2/STAT3信号通路的影响
秦 瑞,吉世禹,刘俊宝,曹璐,冷维春*
(1.吉林大学中日联谊医院妇产科,长春 130033;2.吉林大学中日联谊医院药学部,长春 130033)
参归补血汤(参归补血汤方)由当归10 g,人参5 g,熟地黄10 g,白芍10 g等4味中药组成,方中阿魏酸及多糖成分被认为是治疗贫血类疾病的有效活性成分。因中药复方中成分繁多、服用量大,因此以高效、减量、着重提取有效成分及部位为目的的提取工艺优化是当前研究的重中之重[1-2]。
本研究首先进行参归补血汤提取工艺优化,基于小鼠缺铁性贫血模型,考察其对缺铁性贫血的有效性,并结合IL6诱导的HepG2细胞模型,探索参归补血汤对缺铁性贫血的改善作用机制。
1 材料与方法
1.1 实验动物
雄性ICR(SPF级)小鼠购自长春亿斯动物技术有限公司,60只,体质量(19±3)g,室内保持恒温状态(24±1)℃,普通饲料喂养,不限制进食和饮水,适应性饲养1周。
1.2 仪器与材料
1.2.1 仪器1)FA2004分析天平(常州市幸运电子设备公司);2)高速离心机、RT-PCR仪(德国艾本德);3)低速控温台式离心机(上海安亭科学仪器厂);4)qRT-PCR、电泳仪、半干转仪(美国BIO-RAD);紫外可见分光光度计(上海元析仪器有限公司);高效液相色谱仪(日本岛津);酶标仪(奥地利TECAN)。
1.2.2 材料1)芦丁标准品、葡萄糖分析标准品(源叶公司);2)低铁饲料(北京协同生物);3)甲醇、乙腈(色谱纯,美国Fisher公司),其余试剂均为分析纯;4)中药饮片当归(批号:190606)、熟地(批号:10219027)、人参(批号:180501)、白芍(批号:07219029),均符合《中华人民共和国药典》2020版一部药用标准;5)复方硫酸亚铁片(吉林西点药业,批号189200);6)Elisa试剂盒(长春晶美科技公司);7)RNA提取试剂盒(北京全式金生物公司);8)反转录试剂(TAKARA生物公司);9)抗体(美国CST公司)。
1.3 提取方法的设计及验证
1.3.1 水提取正交实验设计根据参归补血汤方主要活性成分的理化特点,采以水为提取媒介,进行提取工艺研究。按生产化要求,以加水倍数(15、20、25倍)、提取时间(0.5 h、1.0 h、1.5 h)及提取次数(1、2、3次)为考察因素,以L9(34)进行正交实验设计,确定最佳条件,因素水平见表1。
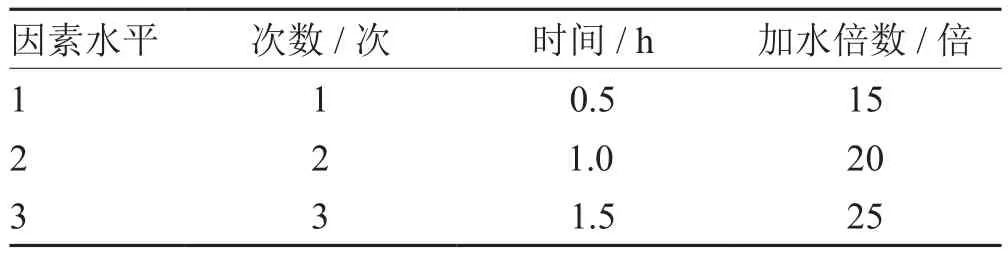
表1 参归补血汤水提取因素水平
1.3.2 水提取工艺验证取5批处方量药材样品,按最优工艺条件提取。测定各批提取液中阿魏酸及粗多糖的含量,计算RSD值。
1.3.3 有效成分含量测定1)阿魏酸含量测定。色谱柱:安捷伦C18(250 mm×4.6 mm,5 μm);流动相:0.1%磷酸和乙睛,比例从9:1梯度洗脱至7:3,梯度洗脱15 min,流速1 mL·min-1,进样量10 μL,检测波长230 nm;阿魏酸的线性回归方程:Y= 6 503.1X-120.96,r2= 1,在 0.2~ 1.8 mg范围内与吸光度呈良好的线性关系。2)粗多糖含量测定。取汤剂样品50 μL置比色管中,补水至2 mL,加5%苯酚1 mL,涡旋混匀后加10 mL浓硫酸,沸水浴2 min,485 nm测定吸光度。总多糖的线性回归方程:Y= 3.805 7X+ 0.0258,r2= 0.998 5,在 0~ 0.25 mg范围内与吸光度呈良好的线性关系。
1.4 小鼠缺铁性贫血模型的建立
1.4.1 动物分组及给药60只雌性小鼠分成空白、模型、阳性、低剂量、中剂量及高剂量6组,每组10只。空白组给予正常饲料;其余组给予低铁饲料,饲养期间避免与铁器接触。造模40 d后持续给药15 d,低剂量组 200 mg·kg-1·d-1、中剂量组 400 mg·kg-1·d-1、高剂量组800 mg·kg-1·d-1,阳性对照组给予复方硫酸亚铁片 13 mg·kg-1·d-1。
1.4.2 Hepcidin及缺铁性贫血药效学相关指标检测称量各组小鼠体质量后,眼球取血,置4℃冰箱备用。按Elisa试剂盒说明书,测定血液中Hepcidin、Hb、FEP、Si、stfr和 TIBC 含量。
1.5 参归补血汤抑制IL-6诱导HepG2细胞Hepcidin表达的研究
1.5.1 CCK8法检测补血汤对HepG2细胞的抑制作用HepG2细胞铺于96孔板中,密度每毫升5×103个。贴壁后空白组给予培养基100 μL;其余分别给予 50 μg·mL-1、100 μg·mL-1、150 μg·mL-1、200 μg·mL-1、400 μg·mL-1、600 μg·mL-1及800 μg·mL-1当归补血汤 100 μL,48 h 后加入 CCK8孵育50 min,于450 nm处检测吸光度。
1.5.2 体外构建IL-6诱导HepG2细胞Hepcidin高表达的模型将HepG2细胞铺于6孔板中,密度每毫升45×104个。贴壁后模型组给予50 ng·mL-1IL-6;给药组造模后给予当归补血汤200 μg·mL-1,48 h后提取细胞总蛋白及总RNA。1)Hepcidin mRNA的检测:采用总RNA提取试剂盒提取HepG2细胞RNA,Takara反转录试剂盒转录,引物见表2,mRNA测定由PCR仪完成。2)JAK2/STAT3信号通路检测:取各组由RIPA裂解的蛋白样品加Loading Buffe后沸水浴5 min,进行SDS-PAGE。4 ℃过夜孵育一抗Betaactin(1:1 000)、JAK2(1:800)及 STAT3(1:200 0)后,孵育HRP标记的二抗(1:300 0)1 h,ECL法显色。

表2 引物序列
2 结果与分析
2.1 水提取正交实验结果
采用多指标综合加权评分法对参归补血汤中当归阿魏酸及汤剂总多糖收率2项考察指标进行方差分析。设定满分为100分,指标成分的比重分数为阿魏酸50、粗多糖50。在此基础上进行总加权评分,利用综合评分值(Pi)对实验结果进行方差分析:以NXY表示第Y个指标成分下第X个指标成分的测定值,以各指标的最大值作为参照对同一指标各数据进行标准化处理;AXY表示第Y个指标成分下的第X个测定值的标准化数据。BXY=NXY/(NY)max,其中 X=1-9,Y=1,2。综合评分Pi=∑比重分数×AXY。将总分结果带入正交实验结果中即得(见表3,表4)。
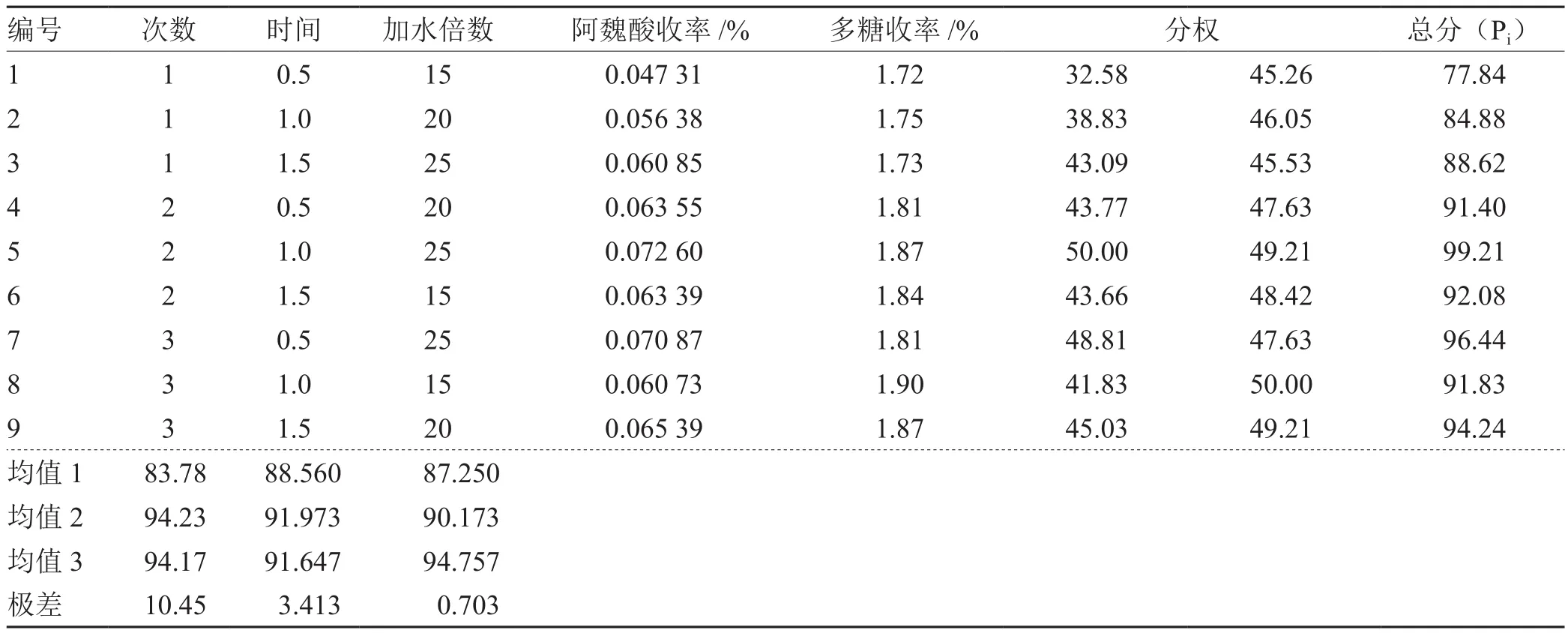
表3 参归补血汤L9(3 4)水提取正交实验设计表与结果分析

表4 参归补血汤水提取工艺参数方差分析表
由综合评分方差分析结果可知,各因素对提取效果影响均为显著。确定最终提取工艺为:提取次数2次、提取1 h、加水量25倍。
2.2 水提取工艺重复性验证结果
精密量取第5组A2B2C3方案的复方提取液,进行五次处方提取,测定吸光度。得5批次阿魏酸RSD = 1.35%,五批次多糖RSD = 2.83%,重复性均良好(见表5)。
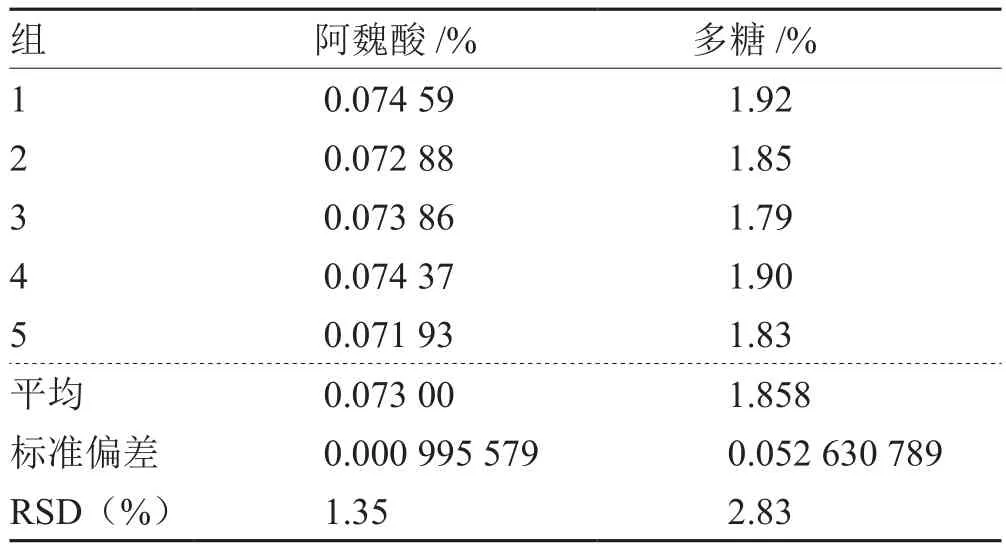
表5 参归补血汤水提取工艺重复性验证结果
2.3 参归补血汤对缺铁性贫血小鼠相关指标及Hepcidin改善作用
与空白组相比,模型组小鼠的耳朵和爪子明显苍白,眼暗淡无色,毛发脱落,反应迟缓,体质量降低;Hepcidin、FEP显著升高(P< 0.01),Hb、SI、stfr,TIBC和体质量明显降低(P<0.05或P<0.01),证明贫血模型建立成功[9]。给药15 d后,与模型组相比,参归补血汤高剂量组小鼠的血常规指标和体质量明显改善(P<0.05或P<0.01),且改善效果与阳性药相当(见表6)。
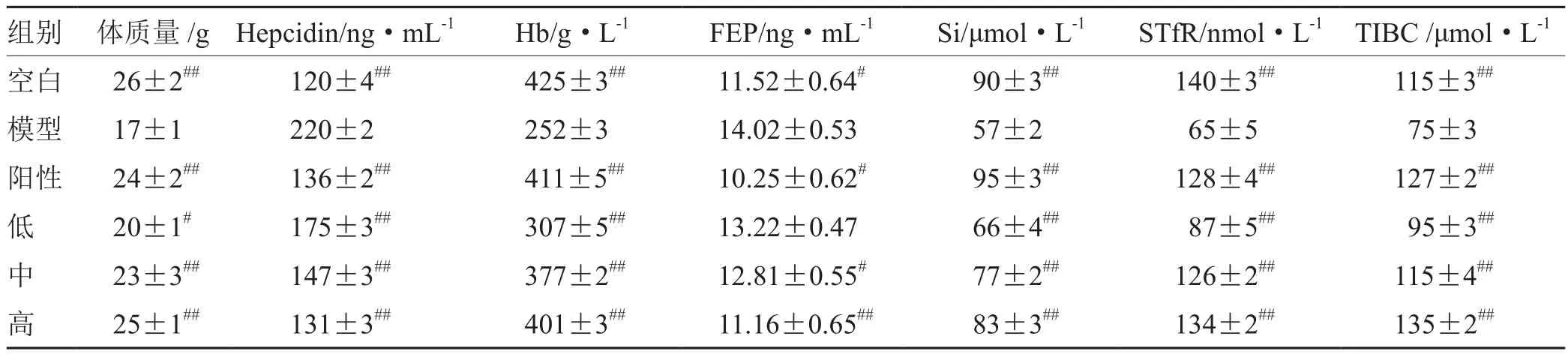
表6 参归补血汤对小鼠的体质量和血常规指标的影响(n=70)
2.4 参归补血汤对IL-6诱导HepG2细胞相关信号通路影响
2.4.1 参归补血汤对HepG2细胞的抑制作用CCK8结果可知 50 μg·mL-1、100 μg·mL-1和 150 μg·mL-1参归补血汤对癌细胞无抑制效果,浓度200~800 μg·mL-1汤剂对HepG2细胞毒性抑制作用显著增加(P<0.001),后续实验采用200 μg·mL-1进行机制验证。
2.4.2 参归补血汤对IL-6诱导HepG2细胞Hepcidin mRNA及相关信号通路蛋白影响结果表明参归补血汤显著降低经IL-6造模后的Hepcidin mRNA的表达(P<0.001)(见图2);同时,WB结果表明相关JAK2/STAT3信号通路蛋白表达量显著减低(P<0.001)(见图3)。

图1 CCK8检测参归补血汤对HepG2细胞抑制率的影响(n = 8)
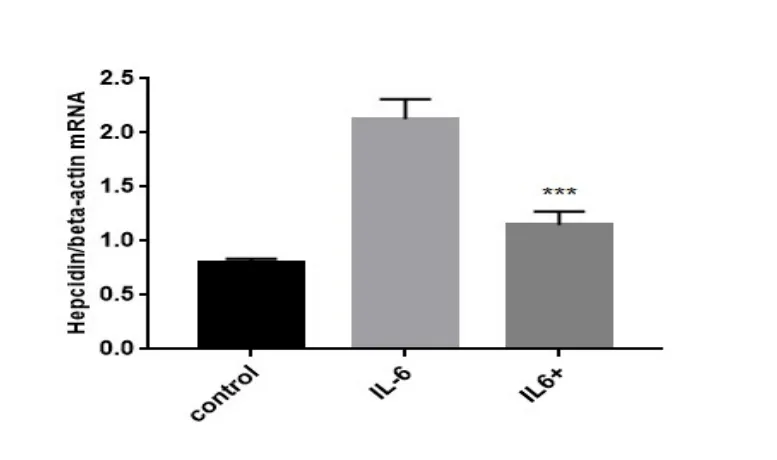
图2 参归补血汤对IL-6 诱导HepG2 细胞的Hepcidin mRNA表达的影响(n = 3)

图3 参归补血汤对IL-6诱导HepG2细胞的相关通路蛋白表达的影响(n=3)
3 讨论
本实验表明参归补血汤水提取工艺稳定,提取效率佳;其对缺铁性贫血小鼠贫血情况改善明显,与模型组相比,小鼠血液中Hepcidin与FEP明显下降,体质量、Hb、Si、STfR及TIBC明显增加,其高剂量组效果与阳性药组效果相似;其对IL6诱导的肝癌HepG2细胞共培养后Hepcidin mRNA表达显著降低,相关p-JAK2及p-STAT3通路蛋白表达水平也显著降低。结果表明参归补血汤能通过抑制JAK2/STAT3通路下调Hepcidin的表达,从而达到改善缺铁性贫血的作用。
Hepcidin是组织中铁吸收和释放的关键调节剂,能维持对红细胞和其他组织的稳定铁供应,同时避免高水平铁对器官产生的有害作用[4]。实验表明,通过抑制Hepcidin表达能够升高贫血模型中血清铁水平,进而纠正贫血症状[5],与本研究结论一致,说明参归补血汤具有改善缺铁性贫血作用。另外,Hepcidin在肿瘤细胞中合成升高,增加胞内铁保留,从而促进肿瘤存活[6-8]。提示我们,能够通过降低Hepcidin表达进而促使铁排出,达到抑制肿瘤的目的[9]。本研究中,参归补血汤能降低肝癌HepG2细胞中Hepcidin mRNA表达,说明其调控铁代谢不仅可改善缺铁性贫血,亦具有抗肿瘤潜力。
IL-6能通过STAT3信号传导刺激铁调素转录。在未受刺激细胞中,STAT3在细胞质中保持无活性形式。IL-6/STAT3通路可将刺激信号从细胞表面传导至细胞核,从而调控Hepcidin表达[10]。先前研究证明,JAK2/STAT3通路能够通过调控Hepcidin,达到抑制胃癌细胞增殖和转移的作用[11]。本研究发现参归补血汤能够通过抑制JAK2/STAT3通路表达,而实现对Hepcidin的调控作用。

