血清同型半胱氨酸、脑白质高信号与颅内微出血相关性研究
王 磊, 庞洪波, 陈宗胜, 徐文锐, 湛长青, 费世早
颅内CMBs、WMH是脑小血管病(cerebral small vessel disease,CSVD)特征性影像学表现;颅内广泛低灌注、动脉粥样硬化、血管内皮功能受损可能与CMBs发生相关[1~3],但发病机制仍不明确。研究证实[4],血清Hcy可导致血管内皮功能障碍而与心脑血管疾病、阿尔茨海默病痴呆的发生相关。本研究通过探讨血清Hcy、WMH与CMBs形成的相关性,从而为CSVD的防治提供新的思路。
1 对象与方法
1.1 研究对象 收集芜湖市第二人民医院神经内科2020年-2021年收治的非出血性卒中患者309例,男性166例(53.72%),女性143例(46.28%),年龄29~91岁;所有患者签署知情同意书,获得本院伦理委员会批准。排除标准:合并严重肝肾功能不全的患者。
1.2 方法 记录患者基本资料,完善头部核磁共振成像(magnetic resonance imaging,MRI)、磁敏感加权成像(susceptibility weighted imaging,SWI)检查,血清Hcy、空腹血糖、血脂、尿酸、肌酐等生化检测。
1.3 CMBs诊断标准 SWI序列上直径<10 mm圆形或卵圆形低密度病灶,且周围无水肿。
1.4 分组 根据有SWI序列有无CMBs,分为CMBs组和对照组;根据CMBs部位分为深部CMBs组(CMBs位于基底节、丘脑、放射冠、内囊、外囊、脑干、小脑),脑叶CMBs组(CMBs位于大脑皮质、皮质下、岛叶或同时存在深部CMBs)[5];根据CMBs数量分为少量CMBs组(≦5个)和大量CMBs组(>5个);根据Hcy中位数水平,分为低水平Hcy组(≦9.6 mmol/L)和高水平Hcy组(>9.6 mmol/L)。
1.5 Fazekas量表 使用Fazekas量表记录脑室旁高信号(periventricular hyperintensity,PVH)和深部白质高信号(deep white matter hyperintensity,DWMH)评分及Fazekas总分;由两位神经内科医师独立完成,结果取其平均值。
1.6 统计学分析 采用SPSS 22.0软件进行统计学分析。计量资料进行正态分布检验,两组间比较采用两独立样本t检验或秩和检验;计数资料以百分比(%)表示,采用χ2检验;多因素分析采用Logical回归分析;相关检验采用Spearman相关分析;以P<0.05为差异有统计学意义。
2 结 果
2.1 CMBs组与对照组一般基线资料比较 CMBs组患者脑梗死、高血压发生率高于对照组,男性患者人数及年龄均高于对照组(P<0.01)。
2.2 CMBs组与对照组危险因素比较 CMBs组血清Hcy、空腹血糖、肌酐、收缩压及脉压差均高于对照组(P<0.05);Fazekas总分、PVH评分、DWMH评分均高于对照组(P<0.01)(见表1);Logical回归分析结果显示,性别、Fazekas总分、收缩压是CMBs发生独立危险因素(P<0.05)(见表2)。
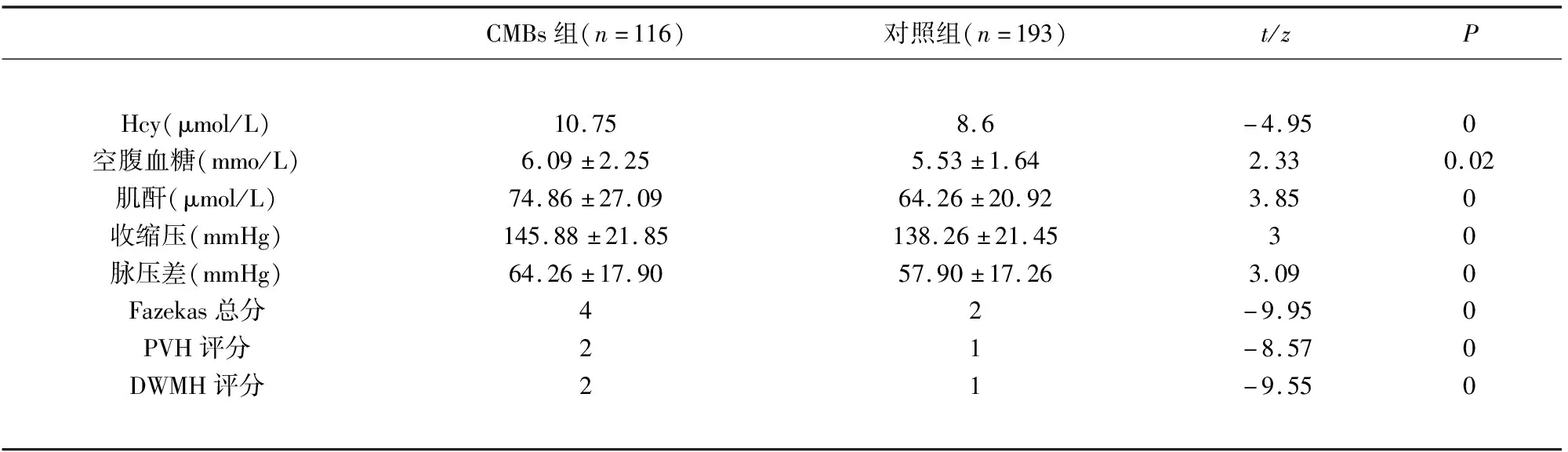
表1 CMBs与对照组危险因素比较

表2 CMBs相关危险因素Logical回归分析
2.3 CMBs部位、数量相关危险因素分析 脑叶CMBs组Fazekas总分、PVH评分、DWMH评分均高于深部CMBs组(P<0.05)(见表3);大量CMBs组血浆Hcy水平、Fazekas总分、PVH评分、DWMH评分、脑梗死发生率高于少量CMBs组(P<0.05);总胆固醇、高密度脂蛋白水于少量CMBs组(P<0.05)(见表4)。
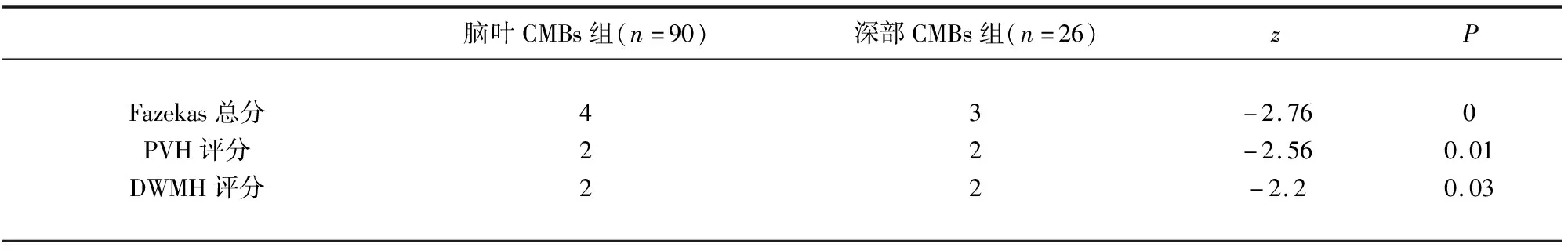
表3 脑叶与深部CMBs组相关危险因素分析
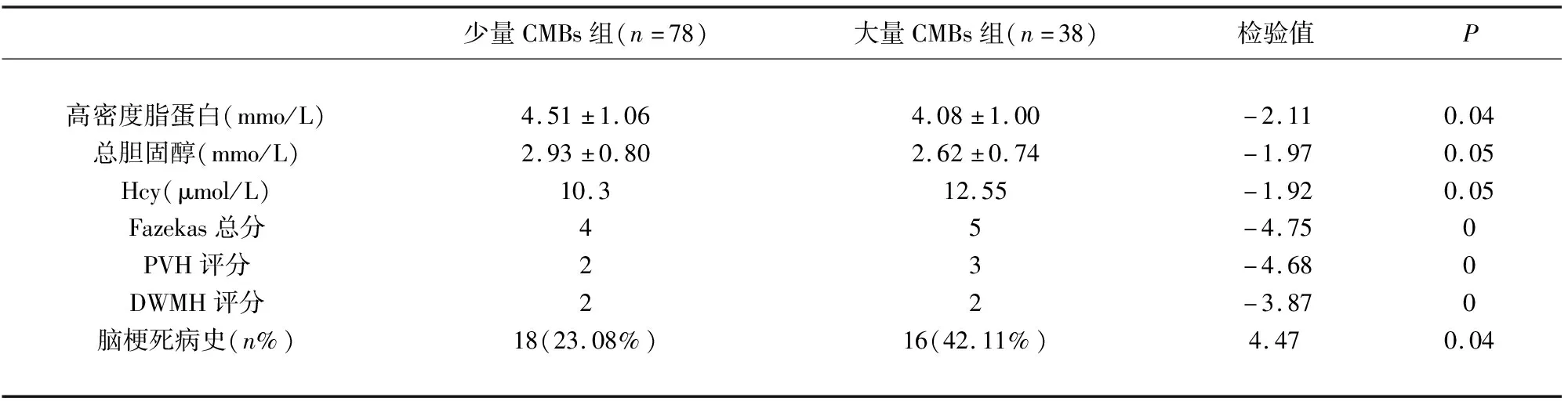
表4 CMBs数量相关因素分析
2.4 不同水平Hcy组Fazekas总分、CMBs发生率比较 高水平Hcy组Fazekas总分、PVH评分、DWMH评分及CMBs发生率均明显高于低水平Hcy组(P<0.01)(见表5)。
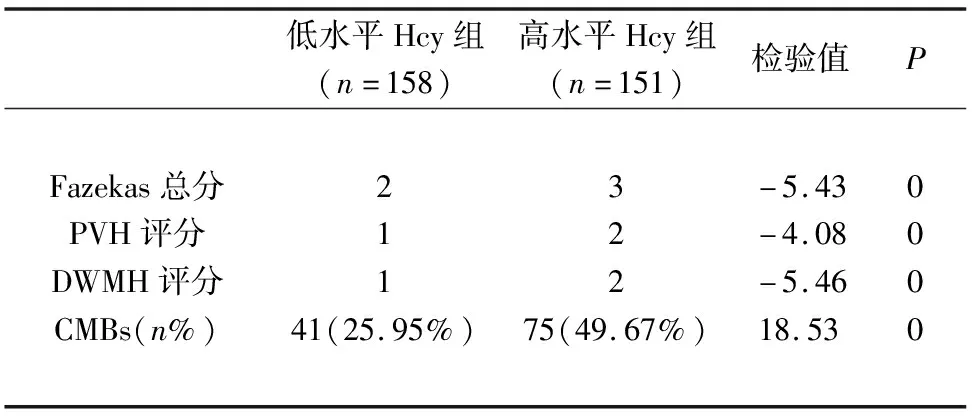
表5 不同水平Hcy组Fazekas评分、CMBs发生率比较
2.5 CMBs与Hcy、WMH相关性分析 结果显示血清Hcy水平、Fazekas总分、PVH评分、DWMH评分与CMBs发生率呈正相关(P<0.01)。
3 讨 论
CMBs、WMH是CVSD特征性的影像学表现,内皮细胞功能受损导致小血管结构重塑和功能改变可能是CMBs形成的主要原因。Hcy、WMH与CMBs的相关性目前存在争论[6,7]。
本研究显示,Hcy、年龄、男性、高血压、脑梗死病史、收缩压、脉压差、空腹血糖、肌酐是CMBs发生的危险因素,与多数国内外研究结果一致。Zhou YN等[8]研究证实血清Hcy、年龄、高血压病史、收缩压、颈动脉粥样硬化是WMH和CMBs发生的危险因素。Yoo JS等[9]研究认为Hcy、年龄、高血压是CMBs发生独立危险因素。Nam KW[10]等研究显示高水平Hcy组扩大的血管周围间隙发生率高于低水平组。Yuan H等[11]研究发现CSVD组亚甲基四氢叶酸还原酶(MTHFR)C677T与血清Hcy水平及CSVD发生风险密切相关(TT>CT>CC)。Feng C等[12]研究提示血清Hcy是CSVD发生的独立危险因素。
本研究显示,Fazekas总分、PVH评分、DWMH评分与CMBs部位、数量密切相关;Hcy水平升高,CMBs数量、Fazekas、PVH、DWMH评分增加,证实了Hcy与WMH、CMBs以及WMH与CMBs之间的相关性,与国内外研究结果一致。Naka等[13]研究发现血清Hcy水平、CMBs数量与急性脑梗死患者WMH严重程度相关。Zhou YN等[8]研究证实PVH、DWMH、WMH总分与CMBs严重程度及数量呈正相关。吕晓培等[14]研究认为WMH与CMBs严重程度密切相关。Piao X等[15]Meta分析显示WMH患者血清Hcy明显升高,提示血清Hcy与WMH的发生关系密切。Hassan A等[16]研究发现WMH患者携带MTHFR等位基因C677T,血清Hcy水平明显升高。Fan H等[17]研究证实高血压、高Hcy血症是青年卒中患者WMH的独立危险因素。Rutten-Jacobs等[18]研究发现MTHFR TT、CT等位基因与高血压患者颅内WMH体积密切相关。Cao L等[19]研究认为血清Hcy升高与颅内WMH严重程度密切相关。Staszewski等[20]研究发现血清Hcy、白介素-6(Interleukin-6,IL-6)分别与影像学腔隙性脑梗死、WMH进展相关。Yu等[21]研究提示老年腔隙性脑梗死患者(≥60岁)血清Hcy水平与PVH严重程度密切相关,而与DWMH无相关性。本研究显示,Hcy与CMBs部位无相关性,与国外研究结果不一致。Nam[10]等研究显示血清Hcy水平与脑叶CMBs发生风险呈正相关,而与深部CMBs形成无关。Yoo等[9]研究证实携带MTHFR等位基因与脑叶CMBs发生相关。
Hcy通过诱发氧化应激反应,导致血管内皮功能及脂质代谢障碍与CVSD形成密切相关。可能的发病机制包括:(1)Hcy抑制内源性NO的生成,造成颅内慢性低灌注状态及小动脉闭塞改变,从而导致WMH及腔隙性脑梗死的发生;(2)Hcy破坏血脑屏障功能,导致毒性产物在血管周围间隙聚集及类淋巴系统组织间液循环障碍与CMBs、WMH、扩大的血管周围间隙形成相关[10];(3)Hcy激活脑小动脉内皮细胞NADPH氧化酶2(Nox-2)的活性,导致脑小动脉结构和功能改变[22]。
4 结 论
血清Hcy与WMH、CMBs关系密切,是CMBs发生的危险因素;降低血清Hcy水平减少CMBs发生风险,可能成为一种新的治疗策略。本研究仍存在不足之处:一、研究对象包括急性脑梗死患者,由于急性期应激反应,可能会对实验结果造成偏差;二、部分患者饮酒史可能对Hcy检测结果造成影响。未来仍需扩大样本量,严格筛选患者,同时进行影像学随访,进一步探讨Hcy与WMH、CMBs之间的相关性。

