MFGE8在缺血性脑损伤中表达及对巨噬细胞极化的调控作用
柳 正, 王朝晖, 周春亭,2
缺血性脑损伤(ischemic brain injury,IBI)是由于远端动脉狭窄、脑血流下降及永久性脑梗死引发的突发神经功能缺损疾病[1~4]。研究报道,小胶质细胞/巨噬细胞的不同表型极化与IBI的病理性发生发展密切相关[5]。在缺血性脑卒中和IBI后,脑内皮质和纹状体中出现动态小胶质细胞的M1极化[6]。引起包括高表达促炎细胞因子,如TNF-α和诱导型一氧化氮合酶等;相反,M2亚型的小胶质细胞/巨噬细胞在促进脑修复过程中起重要作用,包括神经发生、血管生成、轴突重塑及髓鞘再生等[5,7]。因此,阐明M1向M2亚型过渡的机制可能为脑卒中提供新的和有针对性的治疗方法。
乳脂球-表皮生长因子VIII(Milk Fat Globule-EGF Factor 8,MFGE8)是一种分泌型糖蛋白,具有调节凋亡性细胞吞噬和抗炎作用等[8~10]。MFGE8在脑缺血和脑外伤中已显示出有益作用[11,12]。MFGE8具有调控肿瘤相关巨噬细胞M2型巨噬细胞极化的作用[13]。因此,本研究拟分析:(1)MFGE8蛋白在IBI和MCAO模型大鼠外周血中的表达变化;(2)持续激活Mfge8的N2a细胞上清对BV-2小胶质细胞系极化比例的影响;(3)持续激活Mfge8的N2a细胞上清对BV-2小胶质细胞系PI3K/Akt/mTOR信号通路的影响。进而,为揭示IBI患者低表达MFG-E8和M1型巨噬细胞极化之间联系提供理论依据。
1 材料与方法
1.1 实验动物 30只无特定病原体级别的健康雄性Sprague-Dawley大鼠(年龄:2~3 个月)购自北京维塔尔河实验动物技术有限公司(中国北京)。大鼠被关在8个独立的笼子里,每个笼子里有2只大鼠,自由进食和饮水。所有大鼠均在(25±2)℃的室温下喂养,12 h光照/黑暗循环,持续7 d。
1.2 主要试剂 小鼠N2a神经元细胞系和小鼠BV-2小胶质细胞系购自武汉普诺赛生命科技有限公司。胎牛血清(FBS)和Dulbecco改良Eagle培养基(DMEM)购自武汉塞维尔生物科技有限公司。Mfge8持续激活(Continual activation,CA)慢病毒质粒购自武汉奥克鼎盛生物科技有限公司。人MFGE8酶联免疫吸附(ELISA,D711255)试剂盒购自生工生物工程(上海)股份有限公司,大鼠MFGE8酶联免疫吸附(ELISA,ABIN6957839)试剂盒购自武汉云克隆科技股份有限公司,小鼠MFGE8酶联免疫吸附(ELISA,SEB286Mu)试剂盒购自武汉云克隆科技股份有限公司。抗大鼠Fc-Blocker、CD45-APC、F4/80-FITC、iNOS-PE和Arginase 1-PE-Cy7抗体购自北京达科为生物科技有限公司。Mfge8(Protein Tech)、NeuN(Protein Tech)、F4/80(Protein Tech)、αv/β3-integrin(Protein Tech)、Fak(Protein Tech)、p-P65(Affinity)、P65(Affinity)、p-Erk1/2(Affinity)、Erk1/2(Protein Tech)、Jnk1/2(Protein Tech)、P38(Protein Tech)、P110α(Service bio)、P110β(Service bio)、p-P85(Affinity)、P85、p-AKT(Ser473)(Affinity)、p-AKT(Thr308)(Affinity)、p-mTOR(Ser2481)(Affinity)、p-mTOR(Ser2488)(Affinity)、mTOR(Protein Tech)和β-actin(Protein Tech)。FITC、CoraLite594和HRP兔和鼠二抗(Protein Tech)。其他试剂均为分析纯。
1.3 实验方法
1.3.1 一般资料 征集2019年2月-2021年1月本院收治的24例缺血性脑卒中患者和40名正常对照人群。正常对照人群:年龄(66.51±4.42)年,男20例,女20例。缺血性脑卒中组:年龄(69.52±7.56)年。男14例,女12例,两组一般资料比较,差异均无统计学意义(P>0.05), 具有可比性。纳入标准:(1)CT检查明确诊断为缺血性脑损伤;(2)未进行相关治疗。排除标准:(1)缺氧性脑损伤患者和外伤性脑损伤患者;(2)临床资料不全者;(3)CT检查以除外脑出血、硬膜下或硬膜外血肿、瘤卒中等。本文研究经本院伦理委员会审核批准,所有患者、志愿者均对本研究知情并签署知情同意书。
1.3.2 IBI大脑中动脉闭塞(MCAO)大鼠模型 依据文献报道[1],大鼠接受大脑中动脉闭塞(MCAO)。大鼠在手术前禁食12 h,但仍可饮水。术中腹腔注射2%戊巴比妥钠30 mg/kg麻醉。之后,切开颈部的右前部。暴露右侧颈动脉三角后,分离双侧颈总动脉(CCA)、左颈外动脉(ECA)和颈内动脉(ICA)的起始端。然后用动脉夹夹住CCA近端和 ECA 远端,使用眼科剪刀将ECA分叉到距CCA10 mm 处。将5号动脉导管置入CCA端,松开CCA近端动脉夹,用20 ml注射器采集动脉血10 ml。接下来,夹住CCA近端,移除动脉导管,然后打开ECA。将一根 20 mm尼龙线沿血流插入ECA,缝合切口。缺血2 h后,将尼龙线拉回CCA(恢复大脑中动脉供血)。手术后使用加热垫将动物环境温度保持在37 ℃±0.5 ℃。手术结束后,将动物放入带有干净垫子的饲养箱中,并提供自由取食和饮水。空白对照组采用类似操作的假手术(Sham)。
1.3.3 免疫荧光检测 大脑中动脉闭塞(MCAO)大鼠脑组织切片采用常规脱水、石蜡包埋切片。柠檬酸缓冲液修复后,加入Mfge8(1∶200)、NeuN(1∶500)或F4/80(1∶200)抗体,4 ℃孵育18 h,TBST漂洗3次(5 min/次)后二抗(1∶250)室温孵育2 h。TBST漂洗3次(5 min/次)后采用明美荧光显微镜拍照。
1.3.4 细胞培养 小鼠N2a神经元细胞系和小鼠BV-2小胶质细胞系常规培养与含有10%胎牛血清(FBS)的Dulbecco改良Eagle培养基(DMEM)中。以5×104个细胞/孔的密度接种细胞于12孔板中,在37 ℃、5% CO2培养箱中培养24 h。随后,小鼠N2a神经元细胞系转染Mfge8持续激活(Continual activation,CA)慢病毒质粒,收集细胞和培养上清,小鼠N2a神经元细胞系培养上清加入至小鼠BV-2小胶质细胞系中继续培养24 h。
1.3.5 流式细胞术检测巨噬细胞极化 脑组织加入含2%FBS的PBS,并采用注射器头部于冰上碾碎。采用70 μm滤网过滤后,染色。培养细胞采用EDTA消化后,400 g 室温离心5 min收集。细胞重悬于PBS中,加入Fc-Blocker室温孵育30 min,400 g 室温离心5 min。细胞重悬于PBS中,加入CD45-APC、F4/80-FITC染色室温孵育30 min,400 g 室温离心5 min。细胞重悬于PBS中,加入4%多聚甲醛固定 15 min,1% TritonX-100破膜 30 min,加入iNOS-PE和Arginase 1-PE-Cy7抗体室温孵育30 min。400 g 室温离心5 min。细胞重悬于500 μl PBS中。漂洗两次后,细胞重悬于500 μl PBS中上机检测。
1.3.6 酶联免疫吸附(ELISA)检测MFGE8蛋白表达 根据酶联免疫吸附(ELISA)试剂盒使用说明,以标准曲线法检测缺血性脑损伤(IBI)、大脑中动脉闭塞(MCAO)大鼠和小鼠N2a神经元细胞系培养上清中MFGE8蛋白表达。
1.3.7 免疫印迹检测MFGE8蛋白表达 将处理的小鼠N2a神经元细胞系和小鼠BV-2小胶质细胞系加入100 μl的RIPA裂解液,冰上孵育30 min,超声破碎 10 s。14000 g 4℃离心20 min。上清通过BCA法检测蛋白浓度后,加入5X 上样缓冲液于95 ℃变形5 min。以50 μg蛋白上样量用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳分离后,Turbo干转15 min于0.22 μm的聚偏二氟乙烯膜上,5%牛血清白蛋白溶液封闭1 h,孵育一抗,4 ℃孵育18 h,TBST漂洗3次(5 min/次)后二抗室温孵育2 h。TBST漂洗3次(5 min/次)后采用ECL显影液于Bio-Rad 凝胶成像系统显影,采用Image 2X软件分析灰度值。

2 结 果
2.1 MFGE8蛋白在IBI和MCAO模型大鼠外周血中的表达 IBI外周血中MFGE8的相对含量明显低于对照组,差异有统计学意义(t=2.051,P=0.0446)(见图1A);MCAO模型大鼠脑梗死面积(见图1B、C)、神经功能缺损评分(mNSS)(见图1D)和外周血中Mfge8的相对含量明显低于假手术组(Sham),差异有统计学意义(t=2.223,P=0.0259)(见图1E)。

图1 缺血脑损伤患者和MCAO模型大鼠外周血中MFGE8蛋白表达。A:ELISA法检测缺血脑损伤(IBI)患者外周血中MFGE8蛋白表达;B:MCAO模型大鼠脑组织梗死代表图;C:MCAO模型大鼠梗死面积统计分析图;D:MCAO模型大鼠神经功能缺损评分(mNSS)统计分析图;E:ELISA法检测缺血脑损伤患者外周血中MFGE8含量(*P<0.05,**P<0.01)
2.2 Mfge8蛋白在MCAO模型大鼠脑组织中的定位表达 Mfge8蛋白与神经元细胞标志(NeuN)高度共定位表达(见图2A);Mfge8蛋白与巨噬细胞标志(F4/80)并不共定位表达(见图2B)。
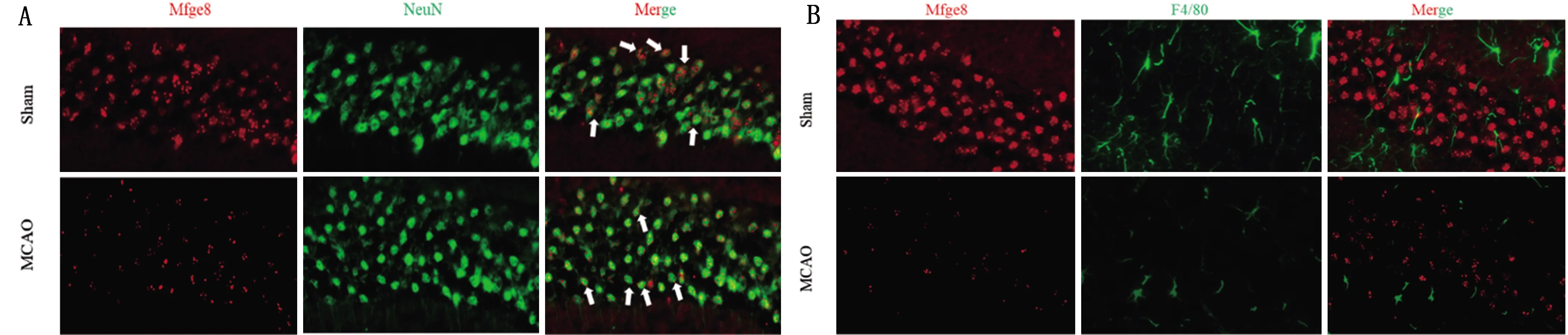
图2 MCAO模型大鼠脑组织Mfge8蛋白表达检测。A:免疫荧光法检测Mfge8和NeuN定位表达代表图;B:免疫荧光法检测Mfge8和F4/80定位表达代表图
2.3 MCAO模型大鼠脑组织巨噬细胞极化比例检测 MCAO模型大鼠脑组织中M1型巨噬细胞比例明显高于Sham,差异有统计学意义(t=4.063,P=0.0004)(见图3A~C);M2型巨噬细胞比例明显低于Sham,差异有统计学意义(t=5.964,P<0.0001)(见图3A、B、D)。
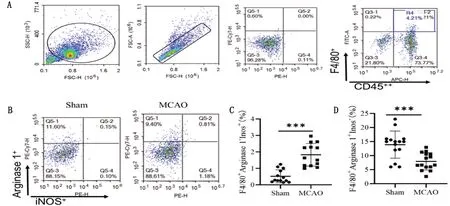
图3 缺血脑损伤患者和MCAO模型大鼠脑组织巨噬细胞极化比例变化。A:流式细胞术检测巨噬细胞极化设门策略;B:流式细胞术检测MCAO模型大鼠脑组织巨噬细胞极化代表图;C:流式细胞术检测MCAO模型大鼠脑组织巨噬细胞极化统计图(***P<0.0001)
2.4 持续激活Mfge8的N2a细胞上清对BV-2小胶质细胞系极化的影响 Mfge8蛋白在Mfge8CA组的N2a神经细胞系中的相对表达量和培养上清中的含量明显高于WT组的N2a神经细胞系,差异有统计学意义(t=9.638,P<0.0001;t=4.484,P=0.0003)(见图4A、B)。Mfge8CA 组N2a神经细胞系培养上清处理的BV-2小胶质细胞M1型巨噬细胞比例明显低于WT,差异有统计学意义(t=2.405,P=0.0230)(见图4C、D);M2型巨噬细胞比例明显高于野生组WT,差异有统计学意义(t=5.859,P<0.0001)(见图4C、E)。
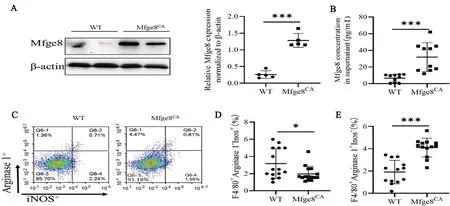
图4 持续激活Mfge8对BV-2小胶质细胞极化的影响 A:免疫印迹法检测持续激活Mfge8的N2a神经细胞Mfge8蛋白表达代表图和统计图;B:ELISA法检测持续激活Mfge8的N2a神经细胞培养上清统计图;C:流式细胞术检测持续激活Mfge8的N2a神经细胞培养上清对BV-2小胶质细胞极化代表图;D&E:流式细胞术检测MCAO模型大鼠脑组织巨噬细胞极化的统计图(*P<0.05,***P<0.0001)
2.5 持续激活Mfge8N2a细胞上清对BV-2小胶质细胞极化相关蛋白表达的影响 αv/β3-整合素和Fak在Mfge8CA 组BV-2小胶质细胞中的相对表达量明显高于WT组,差异有统计学意义(t=2.405,P<0.0001;t=3.274,P<0.0113)(见图5A、B)。p-P65蛋白在Mfge8CA 组BV-2小胶质细胞中的相对表达量明显低于WT组,差异有统计学意义(t=6.013,P<0.0001)(见图5A、D)。

图5 持续激活Mfge8对BV-2小胶质细胞极化相关蛋白表达的影响。A:免疫印迹法检测蛋白表达代表图;B~E: 免疫印迹法检测蛋白统计图(*P<0.05,***P<0.0001)
2.6 持续激活Mfge8对BV-2小胶质细胞PI3K/AKT/mTOR信号蛋白表达的影响 P85、P85、p-AKT(Ser473)、p-mTOR(Ser2481)和p-mTOR(Ser2488)蛋白在Mfge8CA组BV-2小胶质细胞中的相对表达量明显高于WT组,差异有统计学意义(**P<0.001,P<0.0001)(见图6)。

图6 持续激活Mfge8对BV-2小胶质细胞PI3K/AKT/mTOR信号蛋白表达的影响。A:免疫印迹法检测蛋白表达代表图;B~G:免疫印迹法检测蛋白统计图(**P<0.001,***P<0.0001)
3 讨 论
缺血性脑损伤(ischemic brain injury,IBI)是一种复杂的病理变化,极易导致残疾和痴呆[1]。越来越多的证据表明,IBI早期小胶质细胞M1型极化是导致神经性血管炎症和脑血管重塑抑制的重要诱因[7,14]。促炎因子的释放极易导致神经毒性和神经元损伤[15,16]。MFGE8在急性损伤和炎症反应中发挥多种作用[8,9]。MFGE减少缺血再灌注损伤,减轻早期脑损伤中的细胞凋亡和炎症[13,17]。然而,MFGE8在IBI中的表达及对小胶质细胞极化的调控作用尚未见报道。
本研究发现,缺血性脑卒中患者外周血中的Mfge8蛋白含量明显降低。大脑中动脉闭塞(MCAO)大鼠模型外周血和脑组织中Mfge8蛋白含量明显低于假手术组。同时,MCAO大鼠模型脑组织中巨噬细胞呈现M1型极化增强,M2型极化减弱。提示,MFG-E8下调与脑组织中巨噬细胞的促炎性M1型极化有关。这与早期报道的重组MFG-E8在体调节炎症、氧化应激,尤其是脑缺血和神经退行性疾病中的细胞凋亡来提供神经保护一致[18]。其次,本研究证实,Mfge8主要来源与神经元细胞,且持续激活Mfge8的神经元细胞培养上清可体外促进M2小胶质细胞/巨噬细胞极化,抑制M1小胶质细胞/巨噬细胞极化。MFGE8可通过整合素β3/FAK/PI3K/AKT 信号通路减少大鼠脑外伤后细胞凋亡[18],通过整合素β3/SOCS3/STAT3信号促进小胶质细胞表型转化为 M2 来抑制神经元炎症[18]。因此,本研究检测Mfge8下游巨噬细胞极化相关蛋白表达。结果表明,神经元细胞来源的Mfge8可激活整合素β3/FAK/PI3K/AKT/mTOR信号促进M2小胶质细胞/巨噬细胞极化,并抑制Nf-κB炎性蛋白表达。因而,Mfge8是抑制IBI脑组织炎性反应的重要调控分子之一。并且,神经元细胞Mfge8分泌下调是IBI脑组织小胶质细胞/巨噬细胞极化异常的重要诱因。
综上所述,IBI外周血中下调的MFGE8可能是脑组织中炎性增强的重要标志,且神经元细胞来源的MFGE8减少导致小胶质细胞/巨噬细胞M1型极化增强,诱发炎性反应并抑制抗炎反应,继而可能损伤血管重塑等引起缺血损伤。MFGE8对小胶质细胞/巨噬细胞极化的调控作用与整合素β3/FAK/PI3K/AKT/mTOR信号相关。

