对阴沟肠杆菌有强抑制活性乳酸菌的分离及鉴定
李亚飞,罗春雨,刘 奇
(大理大学基础医学院,云南大理 671000)
阴沟肠杆菌(Enterobacter cloacae)是一种条件致病菌,能在人和动物的粪便、泥土或植物中检出,属于肠道正常菌种之一。自研究证明阴沟肠杆菌是造成肥胖的直接原因之一后〔1〕,掀起了一股对阴沟肠杆菌的研究热潮。阴沟肠杆菌能够引起人食源性疾病,现已被列为食品加工行业卫生检测指标之一,经常能从水、食品加工厂、大米、家禽产品和水产品中分离得到。若在食物加工过程中消毒不彻底,则有可能造成阴沟肠杆菌的污染,其产生的大量腐胺等有害物质会导致食物的腐败。也有研究〔2〕表明,以阴沟肠杆菌为病原菌且常累及多个器官的细菌性感染疾病发病率逐年上升。由于其产生的酶具有很强的耐药性,因此临床治疗有难度。乳酸菌(lactic acid bacteria,LAB) 是目前应用最广泛的益生菌之一,被认为是对抗肠道病原体感染极有前途的一种替代品。对乳酸菌的研究发现,其代谢产物可防止许多机会性病原体的过度生长,常见的有金黄色葡萄球菌、白假丝酵母菌、大肠埃希菌等。另外,乳酸菌通过发酵碳水化合物产生的大量乳酸对阴沟肠杆菌生物膜形成有抑制作用〔3〕。鉴于阴沟肠杆菌数量增多是造成肥胖的直接原因之一〔1〕,本实验以阴沟肠杆菌标准菌株ATCC 700323 为目标菌株,筛选大理地区泡菜样本中分离出的对阴沟肠杆菌具有高抑制活性的乳酸菌,为研发具有潜在抑制肥胖功能的泡菜提供基础,丰富传统乳酸发酵食品潜在的减肥功能。
1 材料与方法
1.1 材料
1.1.1 实验材料 在云南省大理市收集居民家中自制的泡菜样品共17 份,乳酸菌发酵乳1 份,样本合计18 份。
1.1.2 主要试剂 阴沟肠杆菌标准株ATCC 700323,由大理大学病原生物学综合实验室提供;pGM-Simple-T Fast Cloning Kit(北京天根生化科技有限公司);PCR Amplification Kit(宝生物工程(大连)有限公司);AxyPrep DNA 凝胶回收试剂盒(杭州爱思进生物技术有限公司)。
1.1.3 主要仪器 Applied Biosystems PCR 热循环仪(美国Applied Biosystems 公司);蛋白凝胶成像系统(美国Bio-Rad 公司)。
1.1.4 培养基制备 取BBL 琼脂培养基基础(青岛博海生物科技有限公司)28 g,加400 μL 吐温-80,用去离子水定容至400 mL,混合均匀。115 ℃高压灭菌20 min,冷至50 ℃后平板分装。
1.2 方法
1.2.1 乳酸菌的培养分离 将收集到的18 份样本分别在BBL 平板上分区划线接种,37 ℃厌氧培养24 h。
1.2.2 分离菌种的革兰氏染色 对经BBL 培养基分离培养得到的疑似为乳酸菌的单个菌落进行革兰氏染色,显微镜观察记录形态。
1.2.3 菌落PCR 鉴定 对分离培养得到的疑似菌落转种过夜再培养,挑取新培养的单个菌落,对革兰氏染色为阳性的全部细菌基因组DNA 用乳酸菌特异性引物进行菌落PCR 检测,参照文献〔4-5〕进行。正向引物:5′-GTAGCGGTGAAATGCGTAGATA TATGGAA-3′,反向引物:5′-GTGATCCAGCCGCAG GTTCTCC-3′。总扩增体系20 μL,相关循环参数如下:94 °C 预变性5 min;95 °C 变性40 s,57 °C 退火30 s,72 °C 延伸100 s,循环30 次;72 °C 延伸10 min。PCR 扩增产物取10 μL,进行琼脂糖凝胶(0.7%,W/V)电泳鉴定,目的条带大小为800 bp 左右。
1.2.4 分离菌株对阴沟肠杆菌抑菌活性的分析参考文献〔6-7〕,分析分离得到的乳酸菌对阴沟肠杆菌(ATCC 700323)的抑菌作用。用比浊法将阴沟肠杆菌稀释(0.5 个麦氏单位),均匀涂布于BBL 培养基上。然后将菌落PCR 扩增出的800 bp 条带的菌株点种于已涂布好阴沟肠杆菌的平板上,37 ℃厌氧培养24 h,观察所接乳酸菌周围产生的抑菌圈大小,记录结果,每个分离株重复3 次。
1.2.5 活性菌种目的条带的切胶回收 将抑菌圈最大的菌株所对应的800 bp 条带再次进行PCR扩增,并用AxyPrep DNA 凝胶回收试剂盒切胶回收备用。
1.2.6 质粒构建TA 克隆 参照说明书,切胶回收800 bp 电泳条带后,采用pGM-Simple-T Fast TA 克隆试剂盒构建TA 克隆〔8〕。无菌PCR 反应管中体系为:2 × RapiLigation Mix 5 μL,pGM -Simple -T Fast Vector(50 ng/μL)1 μL,1 μL 目的PCR 片段,重蒸水补足至10 μL。将转化后的菌悬液用平板涂布法接种于含有20 μL 异丙基硫代半乳糖苷(isopropylthiogalactosside,IPTG,10 mmol/L)和10 μL 5-溴-4-氯-3-吲哚-β-D-半乳糖苷(5-Bromo-4-chloro-3-indolyl-β-D-galactoside,X-gal) 的氨苄青霉素抗性平板上,经蓝白菌落筛选,37 ℃厌氧培养15~20 h,挑取白色菌落进行菌落PCR 重复鉴定。
1.2.7 测序鉴定 利用美国国家生物信息中心(NCBI)网站的Blast(https://blast.ncbi.nlm.nih.gov/Blast.cgi)工具,对克隆片段测序比对,根据测序结果判断PCR 分离的阳性菌株是否为乳酸菌。
2 结果
2.1 革兰氏染色 18 份标本在BBL 培养基上生长出的单个菌落经革兰氏染色后镜检,有17 份为紫蓝色杆状细菌,即为革兰氏阳性杆菌,作为候选菌种进行后续鉴定。
2.2 乳酸菌的PCR 鉴定 革兰氏染色鉴定为紫蓝色杆菌的菌落,经PCR 鉴定,菌株1~2、4~18 扩增出了800 bp 片段,与目的条带一致。见图1。
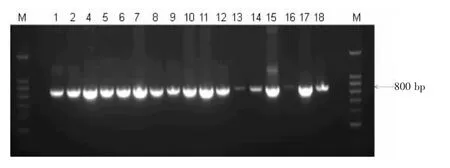
图1 不同菌株的PCR 电泳图
2.3 分离菌株对阴沟肠杆菌的抑菌活性 不同样本中分离得到的乳酸菌对阴沟肠杆菌的抑制作用不同,产生的抑菌圈大小不同。见表1。其中8 号菌株产生的抑菌圈最大,直径为(2.10±0.15)cm;其次是16 号菌株,抑菌圈直径为(2.00±0.16)cm。结果表明8 号菌株对阴沟肠杆菌ATCC 700323 抑制活性最强,所以选择8 号菌株作为目的菌株。
表1 不同菌株对阴沟肠杆菌的抑菌圈直径(±s)
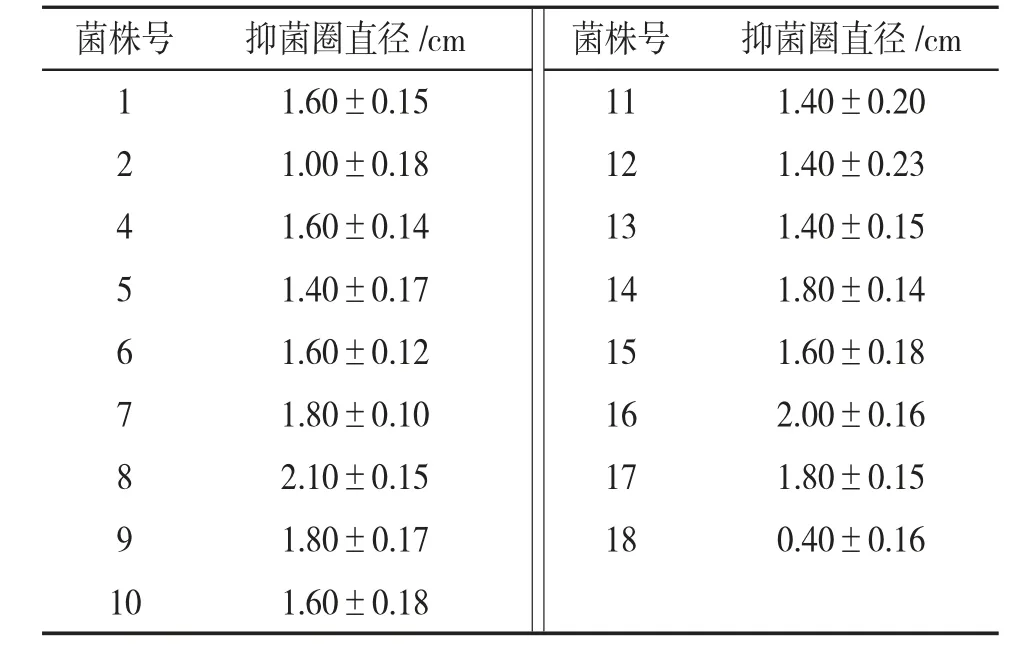
表1 不同菌株对阴沟肠杆菌的抑菌圈直径(±s)
菌株号 抑菌圈直径/cm 菌株号 抑菌圈直径/cm 11.60±0.15111.40±0.2021.00±0.18121.40±0.2341.60±0.14131.40±0.1551.40±0.17141.80±0.1461.60±0.12151.60±0.1871.80±0.10162.00±0.1682.10±0.15171.80±0.1591.80±0.17180.40±0.16101.60±0.18
2.4 800 bp 条带的切胶回收及扩增 由于8 号菌株具有最强的抑制活性,后续实验对8 号菌株进行TA 克隆构建及测序鉴定。首先切取8 号菌株800 bp 扩增条带,经切胶回收后,再次进行重复大体系的扩增。见图2。
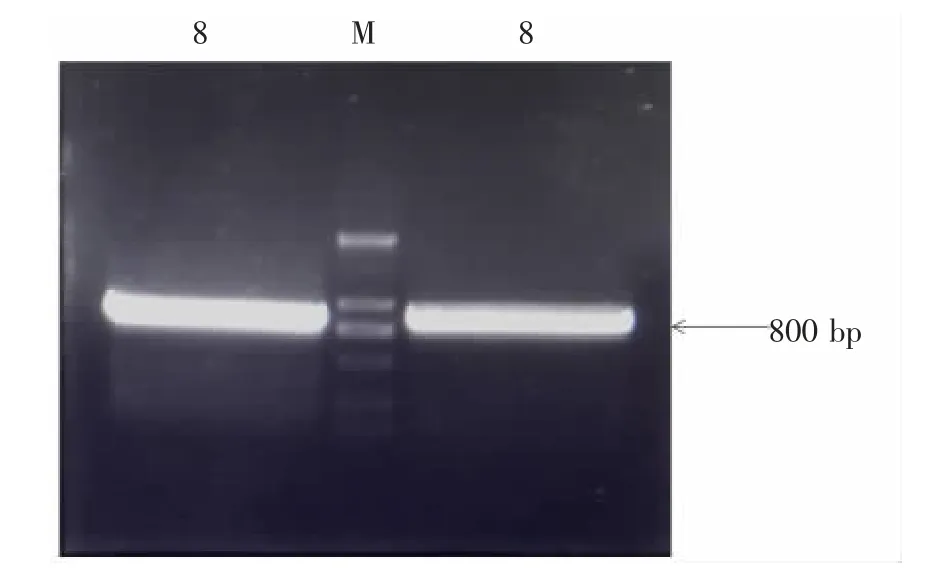
图2 800 bp 条带的大体系扩增PCR 电泳图
2.5 TA 克隆的构建及菌落PCR 验证 将T 载体与8 号菌株大体系扩增切胶回收后的800 bp DNA 连接,经转化、蓝白斑筛选后,随机挑取平板上8 个白色菌落,对其再次进行菌落PCR 技术鉴定,结果见图3。其中8 号菌株的8-1、8-5 为阳性菌落。挑取菌落8-1、8-5 进行摇菌扩增后,取1 mL 菌液送昆明擎科生物科技有限公司测序。
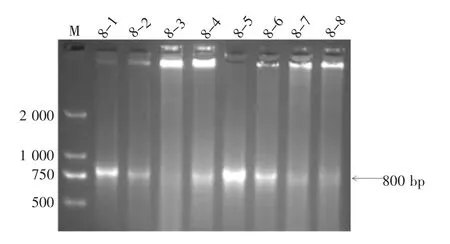
图3 TA 克隆的菌落PCR 鉴定结果图
2.6 测序结果及比对 测序峰图显示,两端引物结合的区域之间,峰图无背景图信号,测序结果质量高,见图4。序列内容为:“GTAGCGGTGAAATGCG TAGATATATGGAAGAACCCCAGTGGCGAAGGCGG CTGTCTGGTCTGTAACTGACGCTGAGGCTCGAAAG TATGGGTAGCAAACAGGATTAGATACCCTGGTAG TCCATACCGTAAACGATGAATGCTAAGTGTTGGA GGGTTTCCGCCCTTCAGTGCTGCAGCTAACGCATT AAGCATTCCGCCTGGGGAGTACGGCCGCAAGGCT GAAACTCAAAGGAATTGACGGGGGCCCGCACAA GCGGTGGAGCATGTGGTTTAATTCGAAGCTACGC GAAGAACCTTACCAGGTCTTGACATACTATGCAA ATCTAAGAGATTAGACGTTCCCTTCGGGGACATG GATACAGGTGGTGCATGGTTGTCGTCAGCTCGTG TCGTGAGATGTTGGGTTAAGTCCCGCAACGAGCG CAACCCTTATTATCAGTTGCCAGCATTAAGTTGGG CACTCTGGTGAGACTGCCGGTGACAAACCGGAGG AAGGTGGGGATGACGTCAAATCATCATGCCCCTTA TGACCTGGGCTACACACGTGCTACAATGGATGGTA CAACGAGTTGCGAACTCGCGAGAGTAAGCTAATC TCTTAAAGCCATTCTCAGTTCGGATTGTAGGCTGC AACTCGCCTACATGAAGTCGGAATCGCTAGTAAT CGCGGATCAGCATGCCGCGGTGAATACGTTCCCG GGCCTTGTACACACCGCCCGTCACACCATGAGAA TTTGTAACACCCAAAGTCGGTGGGGTAACCTTTTA GGAACCAGCCGCCTAAGGTGGGACAGATGATTAG GGTGAAGTCGTAACAAGGTAGCCGTAGGAGAACC TGCGGCTGGATCAC”。测序文件中,59~87 bp,889~910 bp 之间分别是F、R 引物的结合位点。其序列大小为852 bp,与电泳条带大小吻合。将上述测得的序列结果用Blast 进行比对,比对结果见表2。明确了8 号菌为乳杆菌科(Lactoba cillaceae)的植物乳杆菌属(Lactiplantibacillus)或乳酸菌属(Lactobacillus sp.),可以用作乳制品发酵及泡菜制作的菌种。

图4 测序峰图
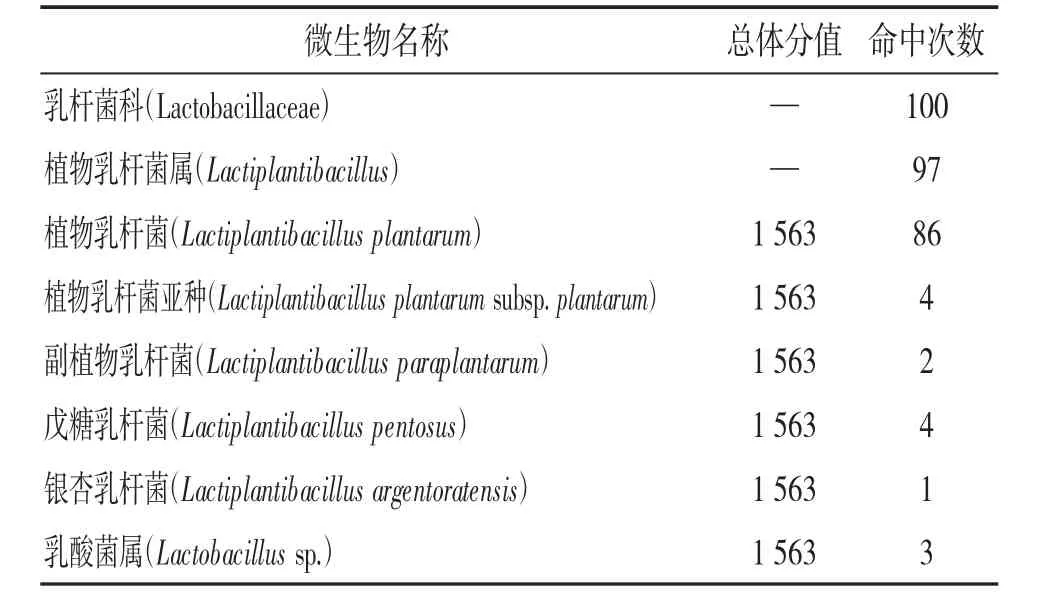
表2 测序比对结果
3 讨论
肥胖一直都是高血脂、糖尿病、动脉粥样硬化等多种疾病的常见影响因素,严重危害人类健康。如何控制肥胖,研究其机制,一直都是科学家们关注的热点。有研究〔9〕表明,阴沟肠杆菌是影响肥胖的关键因素,通过建立小鼠肥胖模型后发现,肠道内阴沟肠杆菌产生的内毒素脂多糖是导致宿主代谢紊乱和引起炎性反应的重要原因之一。本团队之前也通过调查统计证明了大学生粪便中阴沟肠杆菌菌落数量与其BMI之间呈正相关,且具有统计学意义。
乳酸菌能产生乳酸,可调节机体胃肠道正常菌群,维持机体微生态稳定、抑制毒素,从而控制肠道内腐败菌大量繁殖及腐败相关产物的产生,对肠道进行保护〔10〕。有研究证明对于阴沟肠杆菌诱导的高脂肪饮食喂养的动物肥胖模型,植物乳杆菌具有很好的抗肥胖作用〔11〕。乳酸菌的物种多样性和它在自然界分布广、易获取的特点,使其不论在学术研究还是生产生活中都具有重要的价值,广泛应用于微生物分类研究、食品加工业、医学研究等重要领域。因而有许多科研人员聚焦于优良乳酸菌的分离筛选及相关基因工程的改造研究〔12-13〕。现已有许多乳酸菌的鉴定方法,包括形态学鉴定、生化鉴定、基于基因水平上的鉴定等〔14〕,目前最主要的鉴定方法是基于基因水平的方法。Cocolin 等〔15〕首次通过PCRTGGE 技术扩增细菌16Sr DNA 序列V3 可变区的233bp 片段,成功鉴定出了6 种乳酸菌。潘渠等〔5〕进一步研究对比分析了已完成测序的14 种乳酸菌的16Sr DNA,设计出了一对乳酸菌特异性引物,且有较高的特异性。
云南省大理地区有着多年的食用泡菜传统,泡菜制作最关键的因素就是乳酸菌,它是目前最主要的发酵菌剂。乳酸菌的发酵性能及安全性对人们健康至关重要。我们在大理地区收集了泡菜样本和发酵乳制品18 份,旨在分离培养出对阴沟肠杆菌具有抑制优势的乳酸菌种。研究结果显示,收集到的泡菜样本中分离的乳酸菌对阴沟肠杆菌具有不同的抑制活性,通过革兰氏染色、菌落PCR 鉴定、抑菌活性分析,选取了抑制活性最强的菌株,再通过条带切胶回收、大量扩增、TA 克隆构建、测序比对等一系列步骤最终鉴定该菌株为植物乳杆菌(Lactiplantibacillus plantarum)。后续实验将进一步对肥胖人群中的不同阴沟肠杆菌分离株进行相关抑制活性测定。通过对该菌株的后续研究,有望使其成为泡菜产业化生产的纯种菌株。

