纳豆激酶的溶栓作用及其机制研究
闫泉香,冯 利,徐 峰,吴 浩,
(1.沈阳开放大学理工学院, 辽宁沈阳 110003;
2.国家开放大学医药学院, 北京 100039;
3.沈阳药科大学生命科学与生物制药学院, 辽宁沈阳 110016)
血栓性疾病严重威胁人类的生命健康,是当代医学研究的重点和热点之一[1]。据统计[2],因血栓导致的死亡人数占全球死亡总人数的1/3~1/2。随着我国居民生活水平的持续提高,其生活方式和饮食习惯也发生了巨大变化,血栓相关性疾病的发病率和死亡率也不断攀升。在过去的30多年里,我国心脑血管疾病的发病率和死亡率迅猛增长[3-4],我国心脑血管疾病的总死亡率远高于高收入和中等收入国家,是邻国日本的3倍多。因此,积极预防和治疗血栓疾病是我国健康事业的当务之急。
目前,临床上使用的抗血栓药物主要有抗凝血药、抗血小板聚集药和溶栓药三类[5]。虽然可供选择的抗血栓药物较多,但其不能溶解陈旧血栓,且直接作用弱,有出血、过敏反应等不良反应[6]。日本学者从纳豆中发现的纳豆激酶是一种具有强效溶栓作用的丝氨酸蛋白酶[7]。纳豆激酶源自我国的传统食物,具有安全性高、分子量小、可被肠道吸收、起效快、溶栓效果持续时间长,且可溶解陈旧血栓等优点[8-9],有望开发成为具有市场潜力的抗血栓药物。目前对纳豆激酶的研究大多停留在发酵条件优化[10]、分离纯化[11]、药效学[12]等层面,缺乏对其抗血栓作用及其机制的深入研究。
本文采用体外和体内试验相结合的方法,研究了纳豆激酶对陈旧血栓、静脉和动脉血栓的溶栓作用,并进一步从抑制血栓形成和溶解血栓两方面研究了纳豆激酶抗血栓作用的可能的分子机制。深入研究纳豆激酶的抗血栓作用及其机制,为纳豆激酶开发成为新型抗血栓药物提供科学依据。
1 材料与方法
1.1 材料与仪器
SPF级雄性SD大鼠 150只,2~3月龄,辽宁长生生物技术有限公司(动物合格证号:SCXK2010-0001),大鼠饲养于温度为 24±1 ℃,相对湿度为50%~60%,12 h 光照(08:00~20:00),12 h黑暗,隔音的SPF级动物房内,大鼠自由摄食、饮水;纳豆激酶(20000 FU/g) 广东双骏生物科技有限公司(生产批号:120306130518140110);三氯化铁(分析纯) 天津大茂化学试剂厂;水合氯醛(10% w/v) 中国医药集团上海化学试剂公司。
STAT FAX 2100全自动酶免仪 美国阿尼朗斯公司;VARIOSKAN FLASH多功能酶标仪 北京博仪恒业科技发展有限公司;BI-2000微循环观测系统 成都泰盟科技有限公司;迈瑞BC-2900型全自动血细胞分析仪 深圳迈瑞医疗公司;MVIS-2015型全自动血液流变分析仪 重庆天海医疗设备有限公司。
1.2 实验方法
1.2.1 纳豆激酶对陈旧血栓的体外溶解实验 取9只大鼠,每只大鼠尾静脉取血1.5 mL,置于2 mL EP管中于4 ℃静置,1 d后,待血液凝固成胶冻状,切割成均匀大小血栓(约125 mm3),用生理盐水冲洗血块表面,称重,置于试管中,立即分别加入1 mL不同剂量(20、50、100、500、1000、2000 FU/kg)的NK溶液、不同剂量(1000、10000 FU/kg)的尿激酶(Urokinase,UK)溶液(阳性对照药)和生理盐水(空白对照),于37 ℃恒温箱中密封静置,分别于0.5、2、4、8、16、24、36、48 h,取出血块,用滤纸吸净表面水分,称重[13]。
1.2.2 纳豆激酶对三氯化铁诱导的大鼠颈动脉血栓的作用 将80只大鼠分为假手术组(注射生理盐水)、模型组(注射生理盐水)、五个NK剂量组(125、250、500、1000、2000 FU/kg)及UK 组(10000 IU/kg)(预实验结果显示,在体内1000 IU/kg尿激酶完全无效,不能作为阳性药,10000 IU/kg,能出阳性结果,所以选择该剂量),每组10只,一次给药后(尾静脉注射),用 10% 水合氯醛麻醉(0.3 mL/100 g),备皮,分离两侧颈动脉,左侧分离约2 cm,其下置小片塑料薄膜,用于保护血管周围组织,用含35%三氯化铁20 μL(假手术组使用等量的生理盐水)的小片定量滤纸(1 cm×1 cm)敷于其上,右侧颈总动脉埋线待用,30 min后去除滤纸片,去除滤纸片1.5 h后,于右侧颈总动脉插管取血,置于肝素浸润的EP管中,4 ℃ 3000 r/min离心15 min,取上层血浆,用于血液指标测定。结扎左侧颈动脉并取出血栓,用滤纸片吸干并称重。
1.2.3 纳豆激酶对大鼠下腔静脉结扎血栓形成的影响 将大鼠称重并分为6组,每组10只,尾静脉注射给予纳豆激酶高(2000 FU/kg)、中(1000 FU/kg)、低(500 FU/kg)剂量,模型组和假手术组给与等量的生理盐水,阳性对照组给与尿激酶(10000 IU/kg)。给药1 h后,腹腔注射3.5%水合氯醛溶液(1 mL/100 g)麻醉大鼠。将麻醉后的大鼠仰卧固定,于腹正中线切开皮肤约1.5 cm,从腹白线切开腹膜,分离下腔静脉,于左肾静脉下方用粗丝线完全结扎下腔静脉(假手术组不结扎),缝合腹膜。4 h后重新打开腹腔,在结扎线下方2 cm处用止血钳夹住血管,剪断取出该段血管,检查是否有血栓形成,若形成,则将血栓取出,用滤纸轻轻擦干后称重。
1.2.4 大鼠血清血液指标测定 将100只大鼠分为正常对照组(注射生理盐水)、模型组(注射生理盐水)、7 个NK 剂量组(67.5、100、125、250、500、1000、2000 FU/kg)及UK 10000 IU/kg组。每组10只,一次给药后(尾静脉注射),用10%水合氯醛麻醉(0.3 mL/100 g),备皮,分离两侧颈动脉,左侧分离约2 cm,其下置小片塑料薄膜,用于保护血管周围组织,用含35%三氯化铁20 μL(假手术组使用等量的生理盐水)的小片定量滤纸(1 cm×1 cm)敷于其上,右侧颈总动脉埋线待用,30 min后去除滤纸片,去除滤纸片1.5 h后,于右侧颈总动脉插管取血,置于肝素浸润的EP管中,4 ℃ 3000 r/min离心15 min,取血,采用放射免疫法按照试剂盒说明书中的操作步骤和试药剂量测定大鼠血浆中的血栓素B2(TXB2),6-酮前列腺素 F1α(6-K-PGF1α)、前列腺素 E2(PGE2)、羟自由基(·OH)、LF(脂褐素)、超氧阴离子()、黄嘌呤氧化酶(XOD)水平、组织纤溶酶原激活物(t-PA)。
1.3 数据处理
实验数据采用SPSS软件(11.0版)进行统计。各组数据均用(±SD)表示,实验采用One-Way ANOVA进行数据处理。使用LSD进行组间两两比较(当方差齐时),使用Dunnett’s T3进行组间两两比较(当方差不齐时)。
2 结果与分析
2.1 纳豆激酶对陈旧血栓的体外溶解实验
纳豆激酶对陈旧血栓的体外溶解实验结果见表1。由表1可见,0~4 h内,NK 100 FU/kg的溶栓作用和UK 10000 IU/kg几乎相当,大于UK 1000 IU/kg的溶解速率;在8 h时后,NK100 FU/kg 对血栓的溶解作用明显强于UK 1000 IU/kg。给与NK 2000 FU/kg,2 h后,血栓完全溶解;给与100 FU/kg NK 12 h后血栓完全溶解;给与UK,需要48 h才能将血栓完全溶解。生理盐水对血栓作用不明显,血栓在48 h后仍没完全溶解,由于血栓的自然收缩,析出血清,血栓重量也有所降低。因此,NK对体外大鼠陈旧血栓的溶解作用与NK的剂量及作用时间成正比,NK剂量越大、作用时间越长,溶解效果越好,且NK的溶栓效果远好于同等剂量的UK。
表1 纳豆激酶对1 d大鼠血栓的影响(n=10±SD)Table 1 Effect of NK on 1 d old thrombus of rat in vitro(n=10,±SD)
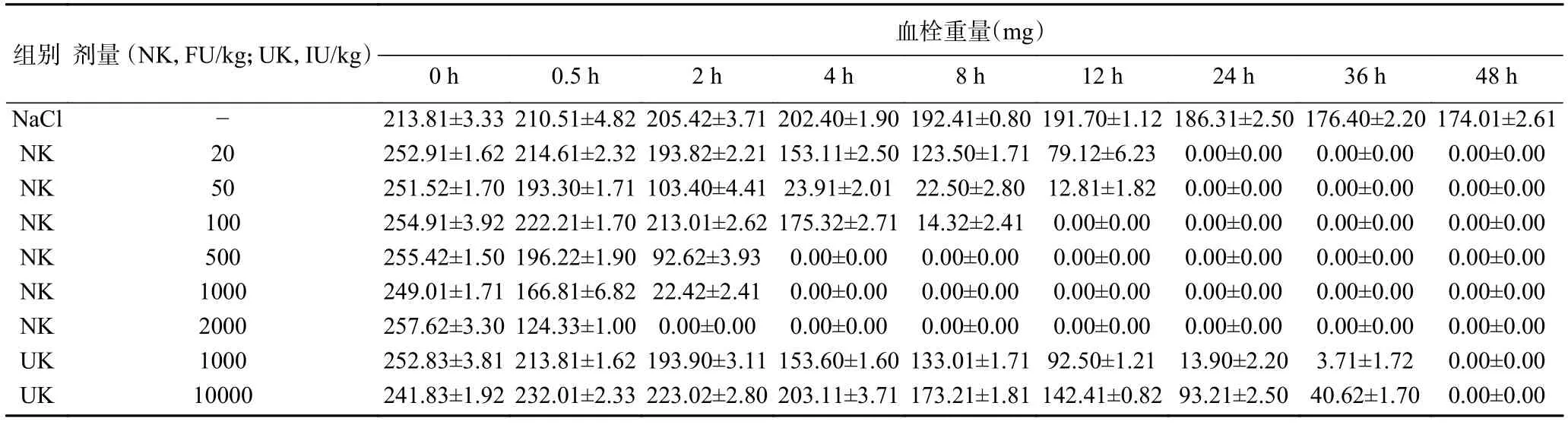
表1 纳豆激酶对1 d大鼠血栓的影响(n=10±SD)Table 1 Effect of NK on 1 d old thrombus of rat in vitro(n=10,±SD)
组别 剂量 (NK,FU/kg;UK,IU/kg)血栓重量(mg)0 h 0.5 h 2 h 4 h 8 h 12 h 24 h 36 h 48 h NaCl - 213.81±3.33210.51±4.82205.42±3.71202.40±1.90192.41±0.80191.70±1.12186.31±2.50176.40±2.20174.01±2.61 NK 20 252.91±1.62214.61±2.32193.82±2.21153.11±2.50123.50±1.7179.12±6.23 0.00±0.00 0.00±0.00 0.00±0.00 NK 50 251.52±1.70193.30±1.71103.40±4.4123.91±2.01 22.50±2.80 12.81±1.82 0.00±0.00 0.00±0.00 0.00±0.00 NK 100 254.91±3.92222.21±1.70213.01±2.62175.32±2.7114.32±2.41 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 NK 500 255.42±1.50196.22±1.9092.62±3.93 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 NK 1000 249.01±1.71166.81±6.8222.42±2.41 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 NK 2000 257.62±3.30124.33±1.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 0.00±0.00 UK 1000 252.83±3.81213.81±1.62193.90±3.11153.60±1.60133.01±1.7192.50±1.21 13.90±2.20 3.71±1.72 0.00±0.00 UK 10000 241.83±1.92232.01±2.33223.02±2.80203.11±3.71173.21±1.81142.41±0.8293.21±2.50 40.62±1.70 0.00±0.00
2.2 纳豆激酶对动脉血栓形成的作用
纳豆激酶对动脉血栓作用的试验结果见表2。由表2可见,与模型组相比,假手术组未形成明显血栓。NK在125 FU/kg剂量时没有明显溶栓效果,从250 FU/kg剂量开始起效,剂量达到2000 FU/kg时,血栓溶解超过一半,且溶栓效果与剂量成正比,剂量越大,溶栓效果越好。因此,纳豆激酶250 FU/kg可显著(P<0.05)降低三氯化铁诱导的大鼠颈动脉血栓重量,明显抑制血栓形成,且NK 500 FU/kg抗血栓作用的效果优于UK 10000 IU/kg。
表2 静脉注射NK对三氯化铁诱导的大鼠颈动脉血栓的作用(n=10,±SD)Table 2 Effect of NK injected on carotid arterial thrombosis induced by FeCl3 in rats(n=10, ±SD)
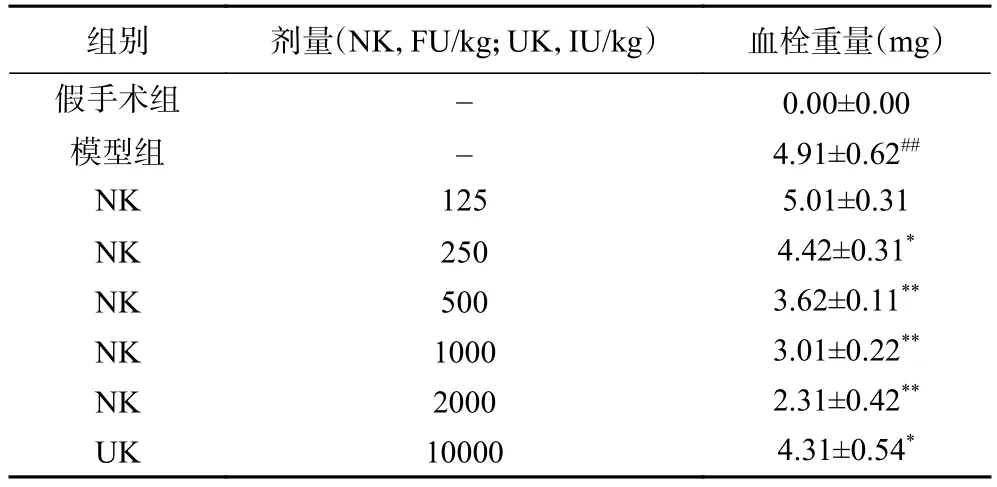
表2 静脉注射NK对三氯化铁诱导的大鼠颈动脉血栓的作用(n=10,±SD)Table 2 Effect of NK injected on carotid arterial thrombosis induced by FeCl3 in rats(n=10, ±SD)
注:##P<0.01,与空白对照组相比;*P<0.05,**P<0.01,与模型组相比;NK:纳豆激酶;UK:尿激酶;表3~表6同。
组别 剂量(NK,FU/kg;UK,IU/kg) 血栓重量(mg)假手术组 - 0.00±0.00模型组 - 4.91±0.62##NK 125 5.01±0.31 NK 250 4.42±0.31*NK 500 3.62±0.11**NK 1000 3.01±0.22**NK 2000 2.31±0.42**UK 10000 4.31±0.54*
2.3 纳豆激酶对静脉血栓形成的作用
纳豆激酶对静脉血栓作用的试验结果见表3。由表3可见,与模型组相比,假手术组未形成明显血栓。给予NK 500 FU/kg后开始起效,且效果强于10000 IU/kg 的UK;低、中、高三个剂量的NK均可极显著(P<0.01)降低结扎法诱导的大鼠下腔静脉血栓重量,剂量达到2000 FU/kg时,血栓重量比模型组减少约73%。因此,纳豆激酶可明显抑制下腔静脉血栓的形成,且抗血栓效果优于尿激酶。
表3 静脉注射NK对腹静脉结扎导致血栓的作用(n=10, ±SD)Table 3 Effect of NK on abdominal vein thrombosis induced by ligation in rats(n=10,±SD)

表3 静脉注射NK对腹静脉结扎导致血栓的作用(n=10, ±SD)Table 3 Effect of NK on abdominal vein thrombosis induced by ligation in rats(n=10,±SD)
组别 剂量 (NK,FU/kg;UK,IU/kg) 血栓重量 (mg)假手术组 - 0.00±0.00模型组 - 11.51±5.30##NK 500 5.62±3.31**NK 1000 5.62±3.41**NK 2000 3.10±1.71**UK 10000 7.71±1.82*
综上,纳豆激酶在体内对动、静脉血栓的形成均具有良好的对抗作用,且其作用效果优于传统抗血栓药物尿激酶。
2.4 纳豆激酶对大鼠血清血液指标的影响
2.4.1 纳豆激酶对血小板聚集的影响 TXB2、6-KPGF1α和PGE2是参与血小板聚集和炎症反应的重要因子[14-15]。纳豆激酶对血小板聚集影响的试验结果如表4所示。
由表4可见,与空白对照组相比,模型组大鼠血浆中的TXB2及PGE2水平明显升高,6-K-PGF1α水平明显降低,说明建模成功。与模型组大鼠相比,纳豆激酶500和67.5 FU/kg可分别极显著(P<0.01)降低大鼠血浆中的PGE2和TXB2的水平,纳豆激酶在 100~500 FU/kg 范围内,可显著(P<0.05)升高大鼠血浆中的6-K-PGF1α水平,并呈剂量依赖性。10000 FU/kg的尿激酶对模型组大鼠血浆中升高的PGE2及TXB2水平无明显效果。
表4 纳豆激酶对大鼠血浆TXB2、6-K-PGF1α和PGE2水平的影响(n=10,±SD)Table 4 Effect of NK on the level of TXB2、6-K-PGF1α, and PGE2(n=10, ±SD)
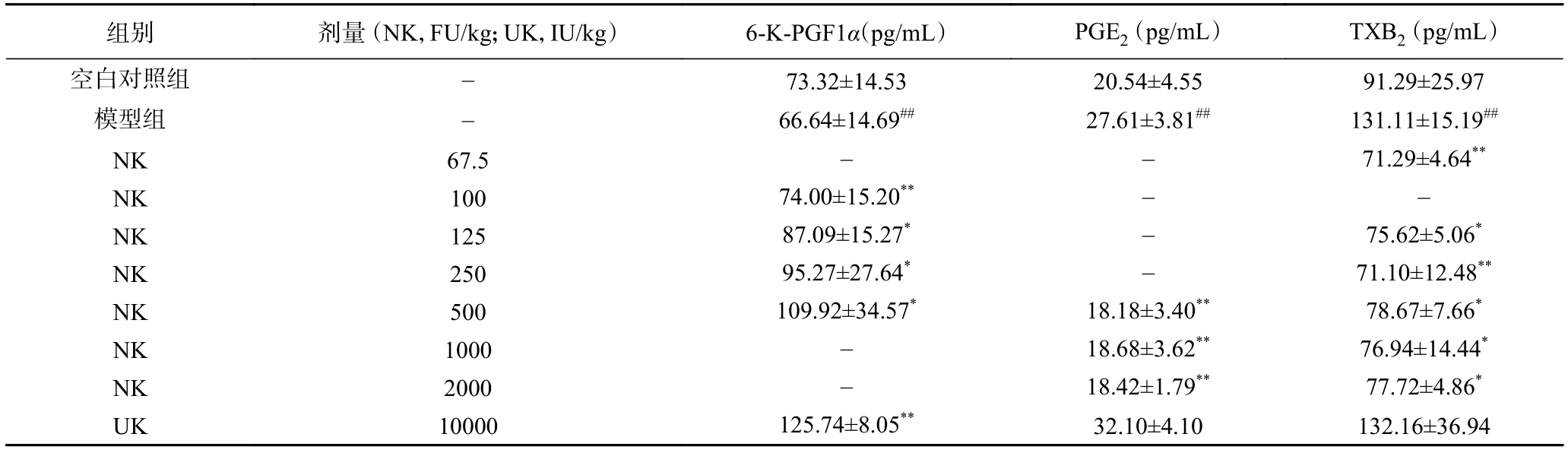
表4 纳豆激酶对大鼠血浆TXB2、6-K-PGF1α和PGE2水平的影响(n=10,±SD)Table 4 Effect of NK on the level of TXB2、6-K-PGF1α, and PGE2(n=10, ±SD)
组别 剂量 (NK,FU/kg;UK,IU/kg) 6-K-PGF1α(pg/mL) PGE2 (pg/mL) TXB2 (pg/mL)空白对照组 - 73.32±14.53 20.54±4.55 91.29±25.97模型组 - 66.64±14.69## 27.61±3.81## 131.11±15.19##NK 67.5 - - 71.29±4.64**NK 100 74.00±15.20** - -NK 125 87.09±15.27* - 75.62±5.06*NK 250 95.27±27.64* - 71.10±12.48**NK 500 109.92±34.57* 18.18±3.40** 78.67±7.66*NK 1000 - 18.68±3.62** 76.94±14.44*NK 2000 - 18.42±1.79** 77.72±4.86*UK 10000 125.74±8.05** 32.10±4.10 132.16±36.94
表5 纳豆激酶对大鼠血液中的、·OH及LF水平的影响(n=10,±SD)Table 5 Effect of NK on the level of , ·OH, LF, and XOD(n=10,±SD)
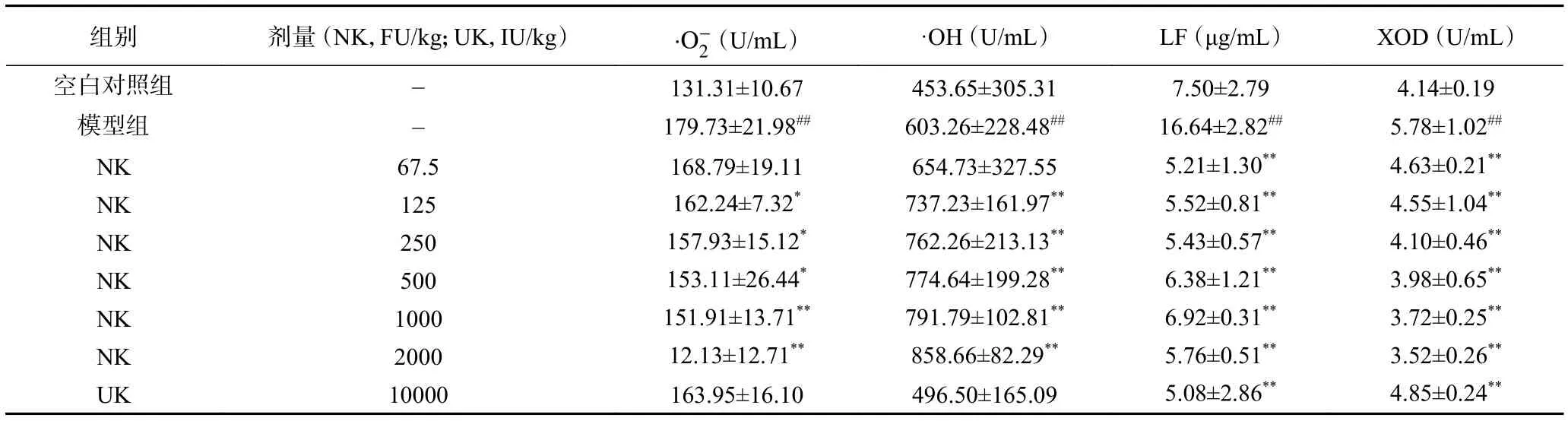
表5 纳豆激酶对大鼠血液中的、·OH及LF水平的影响(n=10,±SD)Table 5 Effect of NK on the level of , ·OH, LF, and XOD(n=10,±SD)
组别 剂量 (NK,FU/kg;UK,IU/kg) images/BZ_352_1095_2817_1145_2855.png(U/mL) ·OH (U/mL) LF (μg/mL) XOD (U/mL)空白对照组 - 131.31±10.67 453.65±305.31 7.50±2.79 4.14±0.19模型组 - 179.73±21.98## 603.26±228.48## 16.64±2.82## 5.78±1.02##NK 67.5 168.79±19.11 654.73±327.55 5.21±1.30** 4.63±0.21**NK 125 162.24±7.32* 737.23±161.97** 5.52±0.81** 4.55±1.04**NK 250 157.93±15.12* 762.26±213.13** 5.43±0.57** 4.10±0.46**NK 500 153.11±26.44* 774.64±199.28** 6.38±1.21** 3.98±0.65**NK 1000 151.91±13.71** 791.79±102.81** 6.92±0.31** 3.72±0.25**NK 2000 12.13±12.71** 858.66±82.29** 5.76±0.51** 3.52±0.26**UK 10000 163.95±16.10 496.50±165.09 5.08±2.86** 4.85±0.24**
2.4.3 纳豆激酶对t-PA的影响 组织型纤溶酶原激活物(t-PA)可激活纤溶酶原转化为纤溶酶。纳豆激酶对大鼠血浆中的t-PA水平影响的试验结果如表6所示。
由表6可见,与空白对照组相比,模型组大鼠血浆中的t-PA的含量极显著(P<0.01)降低;与模型组相比,纳豆激酶所有给药组的t-PA水平均有所升高,纳豆激酶的较低剂量组(125 FU/kg)即表现出显著性(P<0.05)地升高t-PA水平效应,效果与阳性药尿激酶相仿。因此,纳豆激酶可明显增加t-PA含量,直接激活纤溶酶原,发挥间接溶栓作用。
表6 纳豆激酶对大鼠血浆中t-PA水平的影响(n=10,±SD)Table 6 Effect of NK on the level of t-PA(n=10, ±SD)
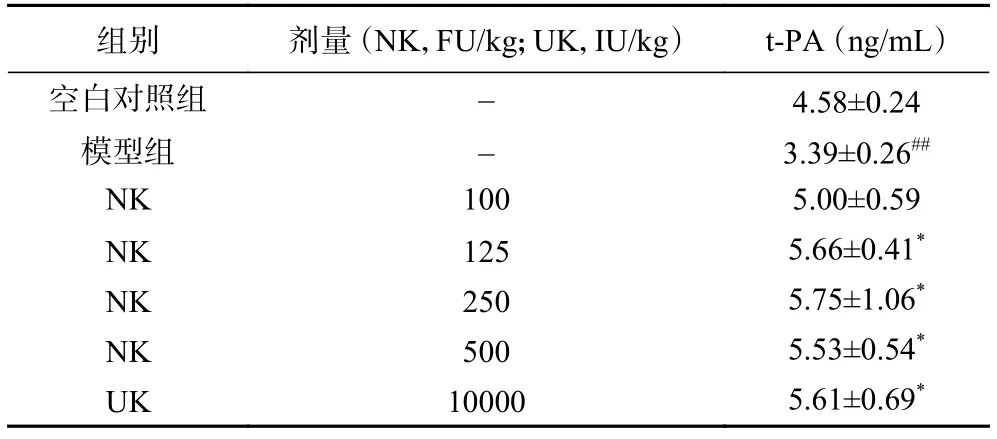
表6 纳豆激酶对大鼠血浆中t-PA水平的影响(n=10,±SD)Table 6 Effect of NK on the level of t-PA(n=10, ±SD)
组别 剂量 (NK,FU/kg;UK,IU/kg) t-PA (ng/mL)空白对照组 - 4.58±0.24模型组 - 3.39±0.26##NK 100 5.00±0.59 NK 125 5.66±0.41*NK 250 5.75±1.06*NK 500 5.53±0.54*UK 10000 5.61±0.69*
3 讨论
3.1 纳豆激酶抑制血栓形成的机制
3.1.1 抑制血小板的聚集 血小板聚集是凝血的起始步骤,而集聚状态的血小板是血栓的主要组成部分之一[16]。血栓素(TXB2)是引发血小板聚集,促进血栓形成的重要物质;生理剂量的前列腺素E2(PGE2)也可以促进血小板聚集;而6-酮-前列腺素(6-K-PGF1α)可以抑制血小板的聚集。在本研究中,纳豆激酶可以降低模型组动物血浆中升高的TXB2、PGE2的水平,提升6-K-PGF1α水平从而阻止血小板聚集,抑制血栓的形成。因此,纳豆激酶可使炎症反应代谢途径发生偏转,花生四烯酸原来可以直接生成TXB2,现在变为生成6-K-PGF1α,从而使TXB2生成减少。这与文献[17]的报道是一致的。
3.1.2 纳豆激酶对炎症代谢途径的影响 本文首次发现,纳豆激酶可使炎症反应代谢途径发生偏转,由花生四烯酸直接生成TXB2,改变成生成6酮前列腺素,而使TXB2生成减少(详见图1),这与经典的非甾体抗炎药完全不同。
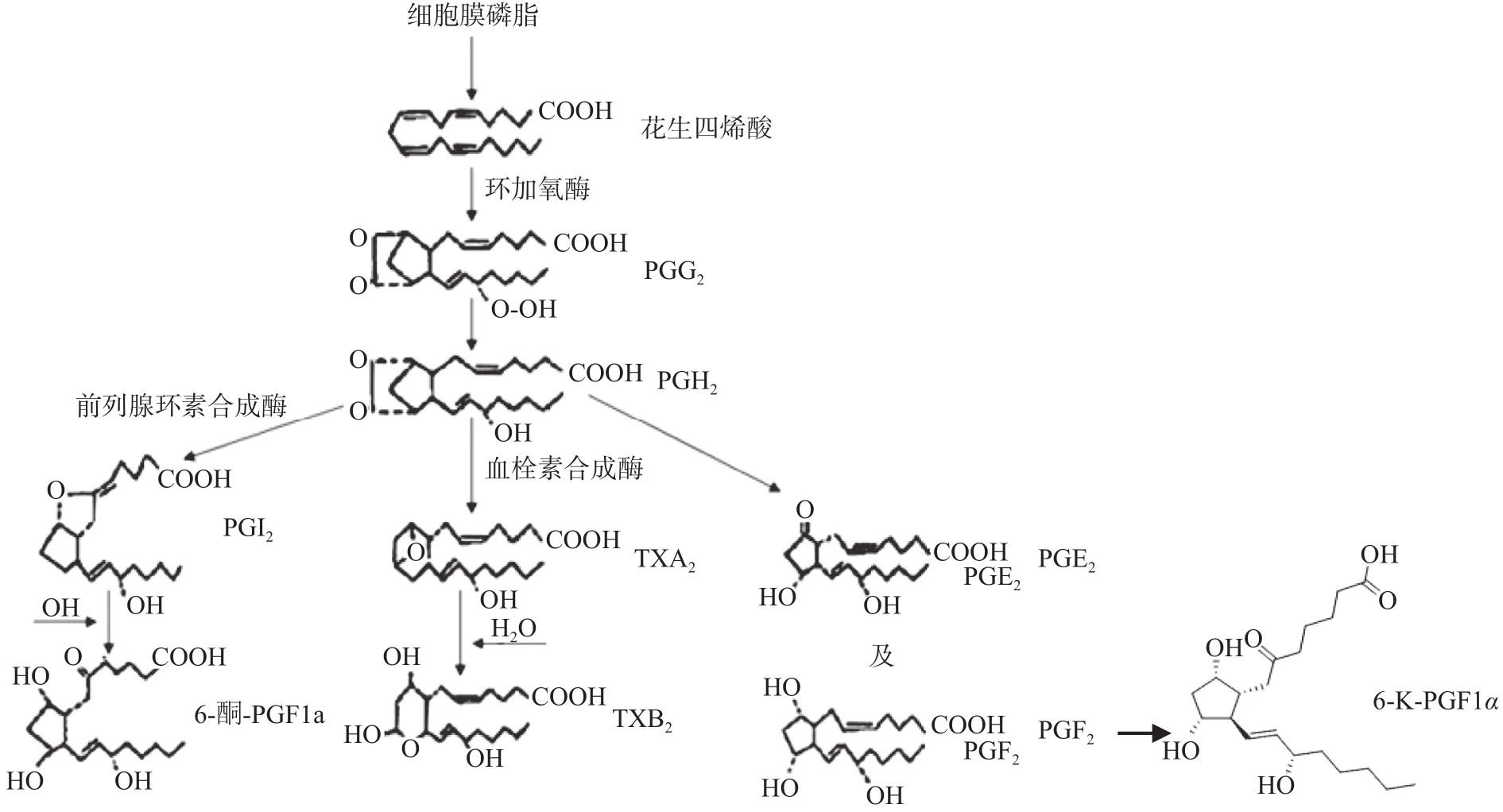
图1 NK的抗炎机制Fig.1 Anti-inflammatory mechanism of NK
3.1.3 降低氧化损伤 血管内皮氧化损伤是血栓形成的重要原因之一[18],损伤的血管内皮细胞暴露出胶原蛋白,激活血小板,启动凝血系统。自由基与活性氧是重要的生物活性物质,具有很强的氧化性,是造成组织细胞损伤的元凶[19]。血管中存在氧化与抗氧化两种系统,当血管中氧化程度超出细胞对氧化物的清除能力,氧化系统和抗氧化系统失衡,就会导致血管内皮损伤,逐渐形成血栓[20-21]。脂褐素(LF)是老年斑的主要成分,可沉积在血管壁导致血管损伤,血栓形成,动脉粥样硬化等疾病[22]。黄嘌呤氧化酶(XOD)可催化自由基的产生,从而造成血管损伤,血栓形成[23]。在本研究中,纳豆激酶可以降低、·OH、LF、XOD的水平,从而减轻氧化损伤和过氧化物堆积,抑制血栓的形成,对治疗动脉粥样氧化等疾病具有潜在应用价值[24-25]。
3.2 纳豆激酶溶解血栓的机制
3.2.1 直接溶栓 纤维蛋白是血栓的主要成分之一[26],纤维蛋白单体由纤维蛋白原激活产生。随后,纤维蛋白单体聚集并与血小板一起形成血栓。已有实验通过纤维蛋白平板法,发现纳豆激酶可在加热和未加热的纤维蛋白平板上产生溶解圈,证明了纳豆激酶可直接溶解纤维蛋白[27]。在本研究的预实验中,也得出类似结果,且纳豆激酶对纤维蛋白的溶解作用大于尿激酶。此外,在体内,纳豆激酶也可以发挥纤溶作用[28-29]。
3.2.2 间接溶栓 纤溶酶为体内溶解血栓的重要物质,可将不溶性的纤维蛋白降解为可溶性的产物。组织型纤溶酶原激活物(t-PA)在体内纤溶系统调控中起重要作用[30],其可激活纤溶酶原生成纤溶酶而溶解血栓。与文献[31]报道一致,在本研究中,纳豆激酶可刺激血管内皮细胞产生t-PA,增加机体内t-PA的含量,从而发挥间接溶栓作用。
纤溶酶原激活物抑制物(PAI-1)也是体内调控纤溶系统的重要物质,PAI-1可抑制t-PA从而抑制纤溶酶原的激活[32]。有研究[33-35]表明纳豆激酶可降低PAI-1活性,促进t-PA激活纤溶酶原,产生纤溶酶,溶解血栓。
4 结论
本研究显示,纳豆激酶具有良好的体内外溶栓作用,对陈旧血栓、静脉、动脉血栓均有良好的溶栓效果。纳豆激酶的溶栓机制可能与其抑制血小板聚集,减轻氧化损伤而抑制血栓形成有关。还可能与其可以通过提高t-PA的水平或抑制PAI-1而间接发挥溶栓作用有关。

