发酵麦麸多糖对氧化应激大鼠脾脏的保护作用研究
王 勤,王文文,王 园, ,段元霄,安晓萍,齐景伟
(1.内蒙古自治区药品检验研究院,内蒙古呼和浩特 010010;2.内蒙古农业大学动物科学学院,内蒙古自治区草食家畜饲料工程技术研究中心,内蒙古呼和浩特 010018)
氧化应激是指机体在受到刺激时,活性氧和活性氮产生量大于清除量,氧化系统和抗氧化系统失衡,导致其在体内大量积累引发氧化损伤的过程[1]。如果这种氧化损伤不能及时修复就会诱导其他疾病的发生。研究发现,氧化应激易引发自身免疫疾病,如系统性红斑狼疮、类风湿关节炎和Ⅰ型糖尿病等[2]。脾脏作为外周免疫器官,含有大量的淋巴细胞和其他免疫细胞,具有储血、滤血、内分泌调节以及免疫应答等功能。免疫细胞因细胞膜中含有不饱和脂肪酸,所以对氧化应激十分敏感,在受到自由基攻击后,会影响免疫功能[3]。因此,通过使用抗氧化剂缓解脾脏氧化应激,改善机体健康状况意义重大。
多糖是一类从天然植物中提取的生物活性物质,具有抗氧化、调节免疫、抑菌及抗肿瘤等作用[4]。小麦麸皮中约含有46%左右的非淀粉多糖(果胶多糖、纤维素多糖及非纤维素多糖),且含有一定量的酚酸类物质[5]。多项研究表明,小麦麸皮经过微生物发酵处理会增加生物活性物质的含量,进而提高其抗氧化能力[6-7]。Zhang等[8]研究发现麦麸阿魏酰低聚糖可以缓解由AAPH诱导的氧化应激,提高氧化应激大鼠心脏、肝脏和肾脏组织中过氧化氢酶(Catalase,CAT)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)、超氧化物岐化酶(Superoxide dismutase,SOD)活性以及谷胱甘肽(Glutathione,GSH)含量。然而,关于发酵麦麸多糖(Fermentedwheat bran polysaccharides,FWBPs)在缓解脾脏氧化应激方面的报道还不多见。因此,本试验通过体外抗氧化指标评价FWBPs的抗氧化活性,并进一步以腹腔注射敌草快(Diquat)建立大鼠氧化应激模型,研究FWBPs对氧化应激大鼠脾脏的保护作用,以期为FWBPs应用于抗氧化方面保健产品的开发利用提供理论支撑。
1 材料与方法
1.1 材料与仪器
SPF级雄性SD大鼠 48只,20~22日龄,体重40~50 g,由内蒙古医科大学试验动物中心提供,合格证号SCXK(蒙)2015-0001,大鼠每天给予充足的水和饲料,3 d后开始试验;麦麸、豆粕粉、玉米粉 市场;DPPH(二苯基-2-三硝基苯肼)、丁基羟基茴香醚(BHA)、维生素 C(VC) 美国 Sigma公司;酿酒酵母(Saccharomyces cerevisiae)CGMCC 2.119、枯草芽孢杆菌(Bacillus subtilis)CGMCC 1.0892 内蒙古自治区草食家畜饲料工程技术研究中心保存;无水乙醇、六氰合铁酸钾、三氯乙酸、三氯化铁、硫酸亚铁、双氧水、水杨酸 国药集团化学试剂有限公司;氯仿(分析纯)、异丙醇 上海阿拉丁生化科技股份有限公司;总抗氧化能力(Total antioxitant capacity,TAOC)、SOD、CAT测试盒 南京建成生物工程研究所;GSH-Px、GSH和 8-羟基脱氧鸟苷(8-hydroxy deoxyguanosine,8-OHdG)试剂盒 武汉基因美生物科技有限公司;BCA蛋白浓度测定试剂盒 北京索莱宝科技有限公司;Invitrogen TRIzol试剂 美国赛默飞世尔科技公司;FastQant RT Kit(with gDNase)、SuperReal PreMix Plus(SYBR Green)试剂盒 北京天根生化试剂有限公司;大鼠基础饲粮 江苏协同医药生物工程有限公司。
HVA-85型压力灭菌器 日本Hirayama公司;SW-CJ 超净工作台 上海新苗医疗器械;QYC-200恒温培养摇床 上海福玛实验设备有限公司;LRH-250F生化培养箱 上海一恒科学仪器有限公司;TDL-5-A型台式高速离心机 上海安亭科学仪器厂;Epoch2 型微孔板分光光度计 美国Bio-Rad公司。
1.2 实验方法
1.2.1 FWBPs的制备 试验所用FWBPs制备方法参照李暄[9]。先将麦麸、豆粕和玉米粉碎,过40目筛,以麦麸、豆粕粉和玉米粉(质量比=80.46:9.32:10.22)为基质,按照10%接种量接入以混合种子液,混合种子液由比例为酿酒酵母和枯草芽孢杆菌6.7:3.3 组成,料水比 1:1,35.4 °C 发酵 48 h。发酵结束后,将发酵基质于45 °C烘干48 h,粉碎后与蒸馏水1∶20混合,80 °C水浴浸提30 min,上清液加入4倍体积的95%乙醇溶液,静置过夜,离心收集沉淀,经过酶处理与Sevag法相结合法去除蛋白质后,获得FWBPs,多糖含量为633.58 mg/g,该多糖由甘露糖、鼠李糖、葡萄糖、半乳糖、木糖、阿拉伯糖组成,摩尔比为5:4:46:9:67:46。
1.2.2 FWBPs体外抗氧化活性评价
1.2.2.1 还原力的测定 还原力的测定方法参照Jia等[10], 分别取不同浓度(0、0.5、1、2、4 mg/mL)的FWBPs溶液0.75 mL,依次各加入0.75 mL的磷酸盐缓冲液(0.2 mol/L,pH6.6)及0.75 mL的六氰合铁酸钾溶液(1%),混匀,50 ℃ 水浴 20 min,冷却,再加入0.75 mL的10%三氯乙酸终止反应,3000 r/min离心10 min,取1.5 mL上清液,加入1.5 mL蒸馏水和 400 μL 0.1% 三氯化铁,室温反应 10 min,700 nm处测定吸光度值A1,空白对照以蒸馏水代替FWBPs溶液测得吸光度值A0,还原力=A1-A0。以BHA作为阳性对照,测定方法同上。
1.2.2.2 DPPH自由基清除率的测定 DPPH自由基清除率的测定参照Zhang等[11]方法,取2 mL不同浓度(0、0.5、1、2、4 mg/mL)的 FWBPs溶液和 2 mL DPPH溶液(0.2 mmol/L,95%乙醇溶液)混匀,室温黑暗条件下反应30 min,517 nm测定吸光度值A。以BHA作为阳性对照,测定方法同上。计算公式:
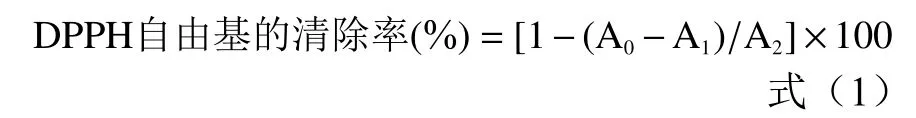
式中:A0:样品吸光度;A1:乙醇代替DPPH溶液吸光度;A2:蒸馏水代替样品吸光度。
1.2.2.3 羟基自由基清除率的测定 羟基自由基清除率的测定参照Zhang等[11]的方法,取0.5 mL浓度为(0、0.5、1、2、4 mg/mL)的 FWBPs与 0.5 mL硫酸亚铁溶液(9.0 mmol/L)和 0.5 mL双氧水溶液(8.8 mmol/L)混合,室温反应10 min,再加入0.5 mL水杨酸-乙醇溶液(9 mmol/L),室温反应 30 min,510 nm测定得吸光度A。以BHA作为阳性对照,测定方法同上。计算公式:
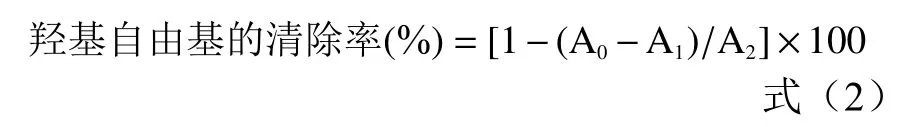
式中:A0:样品吸光度;A1:蒸馏水代替硫酸亚铁溶液吸光度;A2:蒸馏水代替样品吸光度。
1.2.3 FWBPs对氧化应激大鼠脾脏保护作用评价
1.2.3.1 动物分组及造模给药处理 将48只健康断奶雄性Wistar大鼠随机分为6个组,每组8只,动物分组及造模给药处理如表1。FWBPs(低、中、高)组和阳性对照组大鼠持续灌胃14 d,每日1次,正常对照组和氧化应激模型组大鼠灌胃给予等量的生理盐水。最后一次灌胃2 h后,除正常对照组外,其它五组腹腔注射敌草快(0.1 mmol/kg BW)建立氧化应激模型。24 h后,乙醚致晕,剖开腹腔,收集脾脏组织,液氮速冻,存于-80 ℃冰箱中待测。试验在内蒙古农业大学动物科学学院进行,常规饲养管理,自由采食、饮水。

表1 试验动物分组设计Table 1 Experimental design and animal grouping
1.2.3.2 抗氧化相关指标的测定 取适量脾脏组织,加磷酸缓冲液(0.01 mol/L,pH7.4)制备 10%(w/w)组织匀浆,3000 r/min离心10 min,取上清液用于总蛋白、T-AOC、SOD、CAT、GSH-Px、GSH和 8-OHdG的测定,所有操作均按试剂盒说明书进行。
1.2.3.3 抗氧化相关基因表达水平分析 采用Trizol法提取大鼠脾脏组织总RNA。经微孔板分光光度计测得A260nm和A280nm比值在1.8~2.0之间,琼脂糖凝胶电泳法评价RNA质量。参照FastQant RT Kit(with gDNase)说明书分别将各样品的总RNA进行逆转录合成cDNA,并以此为模板,使用表2所列的引物,按照 SuperRealPreMix Plus(SYBR Green)说明书进行Real-time PCR检测。以β-肌动蛋白(βactin)为内参,谷氨酸-半胱氨酸连接酶催化亚基(Glutamate cysteine ligase catalytic subunit,GCLC)、谷氨酸-半胱氨酸连接酶调节亚基(Glutamate cysteine ligase modifiersubunit,GCLM)、醌氧化还原酶 1(NAD(P)Hquinoneoxidoreductase 1,NQO1)、血红素氧合酶(heme oxygenase-1,HO-1)及核因子E2相关因子 2(Nuclear factor E2-related factor 2,Nrf2)的相对表达量采用2-△△Ct法进行计算。引物由上海生工生物有限公司合成,详细信息见表2。

表2 抗氧化基因的引物序列Table 2 Primer sequences of antioxidant genes
1.3 数据处理
试验数据采用SAS 9.2进行统计分析,其中正常对照组和氧化应激组进行t检验,低、中、高剂量组与阳性对照组进行单因素方差分析,并用Duncan’s检验进行多重比较。试验结果均以平均值和标准差表示,P<0.05表示差异显著。
2 结果与分析
2.1 FWBPs体外抗氧化活性
2.1.1 还原力 还原力是评价抗氧化能力的一个重要指标[12],还原力越强,表明其抗氧化能力越高。由图1所示,随着FWBPs溶液浓度的增加,其还原力也逐渐增加;当FWBPs溶液浓度达到4 mg/mL时,其还原力显著提高(P<0.05),但仍显著低于阳性对照BHA(P<0.05)。与上述研究结果相似,杜涓等[13]研究结果显示,当样品浓度达到4 mg/mL时,四种不同组分的 FWBPs(吸光值分别为 0.24、0.58、0.67、0.61)的还原力增加,但不如BHA的还原力强。FWBPs是一种混合物,其中含有的低聚糖基团和阿魏酰基团可能会影响氧化还原电位,影响其还原力[14]。由此推测,FWBPs的抗氧化作用可能是由于其含有低聚糖和酚酸类物质。研究发现,低聚糖在抗氧化方面有良好作用[15],而阿魏酸是一种公认的抗氧化剂,被广泛应用于食品工业领域[16]。
2.1.2 DPPH自由基清除率 过量的DPPH自由基会破坏机体细胞结构,造成其功能障碍甚至死亡[17]。由图1所示,当FWBPs浓度在 0.5~2 mg/mL范围内时,DPPH自由基清除能力显著提高(P<0.05),4 mg/mL时DPPH自由基清除率最高,可达92.35%,且与阳性对照BHA的清除能力相当。此结果与杜涓等[13]研究结果相似,四种不同组分的FWBPs均有较强的DPPH自由基清除能力,4 mg/mL的清除率可达80%。此结果表明,FWBPs对DPPH自由基有较强的清除作用。
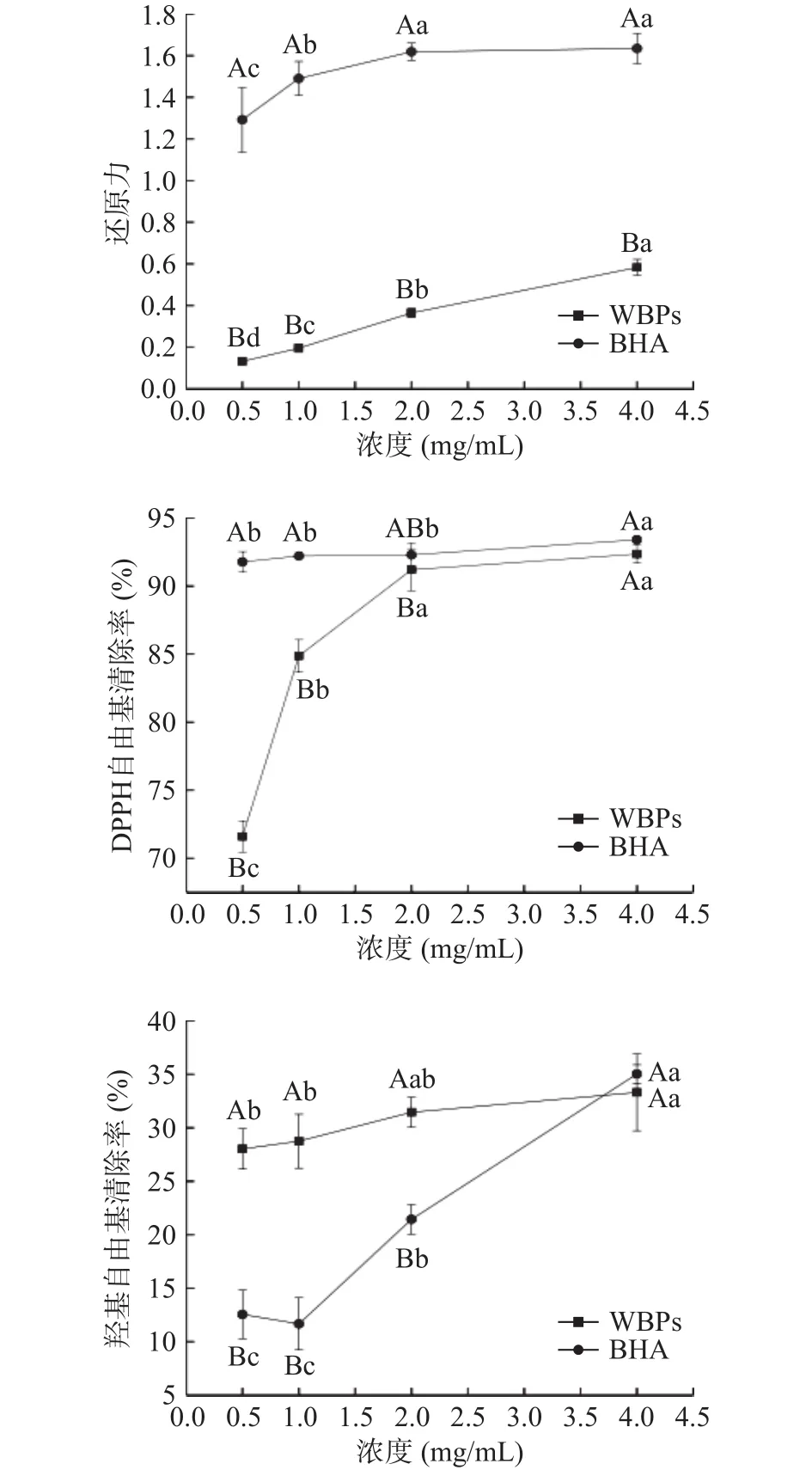
图1 不同浓度FWBPs的体外抗氧化活性Fig.1 In vitro antioxidant activity of FWBPs with different concentrations
2.1.3 羟基自由基清除率 羟基自由基是一种极具危害的自由基,具有很强的氧化活性,可以直接损伤核酸、蛋白质、脂质等生物大分子,进而影响机体健康[12]。由图1所知,当FWBPs浓度在0.5~2 mg/mL范围内时,其羟基自由基清除率显著高于同浓度的阳性对照 BHA(P<0.05);当浓度在 4 mg/mL 时,BHA的羟基自由基清除率与FWBPs相当。与上述结果相似,吕青青[18]研究发现,小麦麸皮多糖有较强羟基自由基清除能力,可达30%。
2.2 FWBPs对氧化应激大鼠脾脏保护作用
2.2.1 FWBPs对氧化应激大鼠脾脏抗氧化相关指标的影响 动物机体可以通过抗氧化体系来清除过量自由基,进而缓解氧化应激。抗氧化体系包括由GSH-Px、CAT及SOD等抗氧化酶组成的酶体系和由GSH、维生素C、维生素E、类胡萝卜素、类黄酮、胆红素及微量元素硒等物质组成的非酶体系[19-21]。8-OHdG是一种有害氧化代谢产物,是目前研究公认的评价氧化应激损伤的指标[22]。如表3所示,敌草快攻毒会导致大鼠脾脏GSH-Px活性显著下降(P<0.05),T-AOC和 8-OHdG的含量显著增加(P<0.05),这说明敌草快攻毒导致抗氧化酶活性降低,而氧化代谢产物8-OHdG含量增加,大鼠脾脏氧化应激模型构建成功。有趣的是,敌草快攻毒提高了T-AOC,这可能与攻毒条件下抗氧化体系被激活有关,具体原因有待进一步研究。与氧化应激模型组相比,低和中剂量组中GSH-Px活性显著增加(P<0.05);低剂量组中 GSH 含量显著增加(P<0.05);而中、高剂量组和阳性对照组中8-OHdG的含量显著降低(P<0.05)。多项研究发现,FWBPs可提高大鼠组织中SOD、CAT及GSH-Px等抗氧化酶的活力及mRNA表达水平[23-24]。与本试验结果相似,壳聚糖可通过增加敌草快攻毒仔猪血清中GSH-Px、CAT及SOD的活性,进而缓解氧化应激[25]。此结果表明,FWBPs可通过增加GSH-Px活力、GSH含量,降低8-OHdG的含量缓解敌草快攻毒所致的脾脏氧化应激。
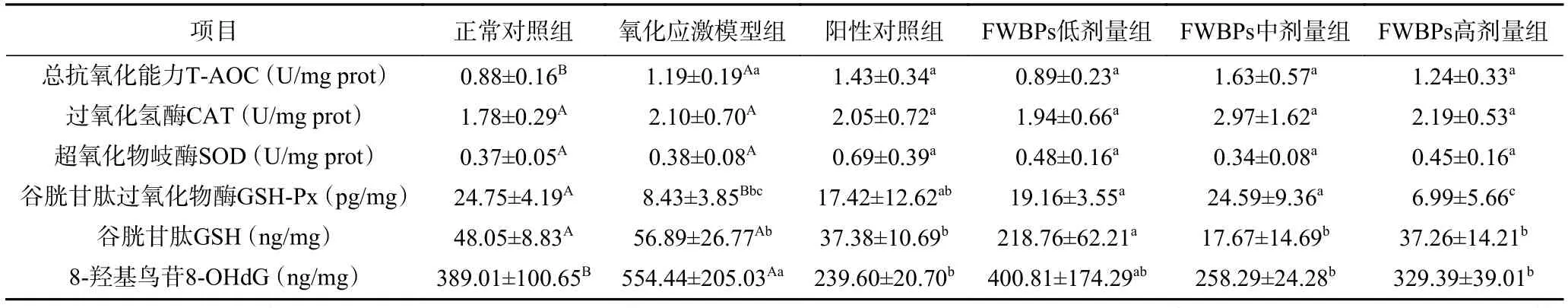
表3 FWBPs对氧化应激大鼠脾脏抗氧化相关指标的影响Table 3 Effects of FWBPs supplementation on antioxidant indices in spleen of oxidative stress rats
2.2.2 FWBPs对氧化应激大鼠脾脏抗氧化相关基因表达的影响 为了进一步探讨FWBPs对大鼠脾脏氧化应激缓解作用的可能分子机制,本试验测定了脾脏抗氧化相关基因的相对表达量。由表4所示,敌草快攻毒会导致大鼠脾脏GCLM的mRNA表达水平显著增加(P<0.05)。与氧化应激模型组相比,中剂量组大鼠脾脏中NQO1和Nrf2的mRNA表达量显著增加(P<0.05)。核因子 E2 相关因子 2(Nrf2)信号通路是目前研究发现的最经典的内源性抗氧化应激通路之一[26]。在氧化应激发生后,Nrf2会被活化,与kelch样ECH相关蛋白1(kelchlike ECH associated protein1,Keap1)解离,进入细胞核与抗氧化反应元件(Antioxidant response element,ARE)结合,促进HO-1、NQO1、GCLC和 GCLM的转录和表达,诱导CAT、SOD和GSH-Px等抗氧化酶的转录和表达,进而缓解氧化应激[27]。HO-1可通过与金属离子螯合、修饰蛋白巯基及清除自由基等方式防御氧化应激[28]。醌类可被NQO1直接被还原成氢醌,进而减少醌类转化产生的氧自由基,从而缓解醌类物质代谢引起氧化应激损伤[29]。谷氨酸-半胱氨酸连接酶是由催化亚基GCLC和调节亚基GCLM组成的二聚体,它可以调控GSH的合成[30]。由此结果推测,FWBPs可通过激活Nrf2,增加NQO1的mRNA表达量,进而缓解敌草快攻毒所致的脾脏氧化应激。
3 讨论与结论
研究发现,氧化应激与肥胖、糖尿病、帕金森病及心脑血管疾病等慢性疾病的发病机制密切相关[31]。一般通过摄食抗氧化类物质来提高机体抗氧化能力,缓解氧化应激。动物机体主要通过抗氧酶和抗氧化物质抵抗氧化应激。本试验发现,氧化应激模型组大鼠脾脏GSH-Px活力下降,而FWBPs预处理可增加氧化应激大鼠脾脏GSH-Px活力、GSH含量及NQO1和Nrf2的mRNA表达量,并可降低8-OHdG的含量。由此推测,FWBPs的抗氧化作用可能是通过激活Nrf2,促进NQO1的转录和表达,诱导GSHPx的表达和GSH的分泌,进而缓解敌草快攻毒所致的脾脏氧化应激,保护脾脏健康。FWBPs的抗氧化作用机制可能是多途径的,后续有待深入研究脾脏组织中抗氧化信号通路相关蛋白表达情况,以探明FWBPs的靶向作用机制。
体外试验结果显示,4 mg/kg BW FWBPs对DPPH自由基和羟基自由基都有较强的清除作用,且与阳性对照BHA作用相当,这证明FWBPs有较强的体外抗氧化作用。体内试验发现,FWBPs预处理可增加氧化应激大鼠脾脏GSH-Px活力、GSH含量及NQO1和Nrf2的mRNA表达量,并可降低8-OHdG的含量。综上所述,FWBPs具有较好的体外、体内抗氧化能力及氧化应激修复作用,可作为一种天然抗氧化剂应用于食品工业领域,本试验也为FWBPs的开发利用提供了理论参考。

