超声引导下真空辅助旋切术与开放切除术治疗合并钙化灶乳腺肿块的效果比较
何 鹏, 李永飞, 吴意赟, 任晓梅, 卞卫和, 姚 昶
(江苏省中医院/南京中医药大学附属医院, 1. 乳腺外科,2. 超声医学科, 江苏 南京, 210029)
合并钙化灶乳腺肿块的乳腺影像报告和数据系统(BI-RADS)分级常在4级以上,往往需要通过活检进一步诊断和治疗[1]。既往临床对于乳腺肿块一般选用超声或X线定位下开放切除活检,但存在手术范围较大、术后遗留瘢痕的缺点[2]。近年来,超声引导下真空辅助旋切术因其定位准确、创伤小、美观效果好的优点已被广泛应用于临床[3]。本研究比较了超声引导下真空辅助旋切术与开放切除术治疗合并钙化灶乳腺肿块的效果,现将结果报告如下。
1 资料与方法
1.1 一般资料
回顾性分析2018年1月—2021年3月江苏省中医院收治的合并钙化灶乳腺肿块手术患者的临床资料。纳入标准: ① 单侧乳腺病灶者; ② 乳腺肿块直径≤2.5 cm者; ③ 钙化灶在乳腺肿块内且直径≤2.0 mm者。排除标准: ① 乳腺实质外钙化(如皮肤钙化、血管钙化等)者; ② X线检查提示乳腺实质内簇状分布多形性、细线状及分支状钙化者; ③ 月经期、妊娠期、哺乳期者; ④ 合并严重心、脑、肝、肾基础疾病不能耐受手术者; ⑤ 有出血倾向、凝血功能障碍者; ⑥ 乳腺内有假体者; ⑦ 病理报告显示恶性肿瘤者。最终纳入88例患者,均为女性,根据手术方式的不同将其分为旋切组和开放组。旋切组45例,年龄22~76岁,平均(46.64±13.06)岁; 肿块直径0.5~2.4 cm, 平均(1.32±0.52) cm; 钙化灶直径0.5~2.0 mm, 平均(1.09±0.43) mm。开放组43例,年龄25~86岁,平均(44.98±12.86)岁; 肿块直径0.4~2.5 cm, 平均(1.37±0.44) cm; 钙化灶直径0.5~2.0 mm, 平均(1.07±0.40) mm。2组患者一般资料比较,差异无统计学意义(P>0.05), 具有可比性。所有患者术前均签署知情同意书。
1.2 仪器与设备
真空辅助旋切系统应用Ethicon Endo-Surgery公司生产的Mammotome EX/SCM23型号仪器,配载Devicor公司生产的HH8BEX旋切针。超声设备应用深圳迈瑞公司生产的M8 super型号高频彩色多普勒超声诊断仪,探头频率为4~12 MHz。
1.3 方法
① 旋切组: 采用超声引导下真空辅助旋切术治疗。嘱患者取平卧位,以高频超声探查其乳腺肿块及钙化情况,根据病灶特征选择穿刺点。局部麻醉后,在穿刺点做3.0~4.0 mm的小切口。在超声引导下将穿刺针刀头置于肿块的正下方,用“十字交叉”定位法使针槽处于病灶的中间位置。取样状态下行抽吸旋切,先切除乳腺肿块组织再逐步靠近钙化灶,将其包裹在病灶组织中,加大负压吸入针槽中一并切除。术中实时调整旋切针刀头的角度及进针深度,一次性完整切除病灶。观察取出的标本,确认肿块及钙化灶已切除,抽吸残腔局部渗液,超声探查无明显异常回声,退出穿刺针。按压残腔表面,观察3~5 min, 若创腔无明显渗血,拉拢切口后使用皮肤粘合剂闭合,以弹力绷带加压包扎。② 开放组: 采用开放切除术治疗。术前行超声体表定位,局部麻醉后,根据肿块所在位置做乳晕部弧形切口或肿块表面切口,充分游离后切除包括钙化灶在内的肿块及周边小范围腺体组织,创腔止血,切口以可吸收线皮内缝合,加压包扎。标本送病理科进行冰冻病理检查或石蜡病理检查。
1.4 观察指标
① 手术相关指标: 观察并比较2组患者的钙化灶切除率、手术时间、术中出血量、切口愈合时间、瘢痕长度。② 术后并发症: 比较2组患者术后局部血肿、切口感染、乳房外形改变情况,术后6个月内复查乳腺超声,比较2组术区病灶残留情况。③ 疼痛情况: 术后当天应用疼痛数字评价量表(NRS)对患者进行疼痛评分。0分为无痛; 1~3分为轻度疼痛,睡眠不受影响; 4~6分为中度疼痛,睡眠受影响; 7~10为重度疼痛,严重影响睡眠。④满意度情况: 出院后对患者进行电话回访并调查患者满意度,满意度评分项目包括乳房切口、手术瘢痕、外观形态、诊疗体验、治疗效果,每项20分,总评分>90分为满意, 80~90分为一般, <80分为不满意。
1.5 统计学分析
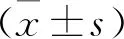
2 结 果
2.1 手术相关指标比较
2组患者均顺利完成手术。旋切组45例中, 43例成功切除,钙化灶切除成功率为95.56%; 2例未能旋切成功者均为接近2.0 mm的斑片状钙化,切除过程中旋切刀损坏,扩大切口行开放手术取出。开放组43例中, 28例选择乳晕部切口, 15例选择肿块表面切口,钙化灶切除成功率为100.00%。
旋切组手术时间、切口愈合时间、瘢痕长度短于开放组,术中出血量少于开放组,差异有统计学意义(P<0.05)。见表1。
2.2 术后疼痛和满意度情况比较
旋切组术后疼痛评分低于开放组,满意度高于开放组,差异有统计学意义(P<0.05)。见表2。
2.3 术后并发症情况比较
2组术后局部血肿、切口感染、外形改变、病灶残留情况比较,差异无统计学意义(P>0.05)。见表3。
表1 2组患者手术相关指标比较
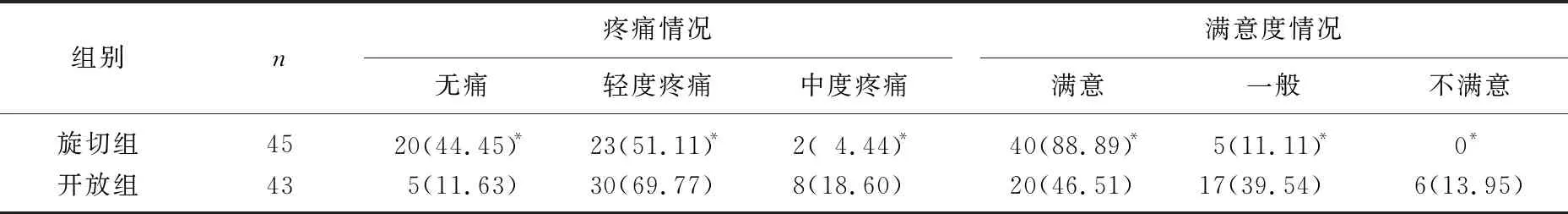
表2 2组患者术后疼痛和满意度情况比较[n(%)]

表3 2组患者术后并发症比较[n(%)]
3 讨 论
乳腺钙化(特别是直径小于1.0 mm的微钙化)是乳腺癌影像检查中的常见征象,准确检出并诊断乳腺钙化灶,有助于乳腺癌的早期发现[4]。X线检查是乳腺钙化的诊断金标准,但其对致密性乳腺的诊断性能有所下降[5]。随着超声技术的发展,乳腺肿块内钙化的检出敏感性已明显提高[6]。乳腺钙化的传统手术方式为X线导丝定位区段乳腺组织切除,患者需在术前接受射线暴露和有创操作,而且存在导丝移位和切除范围较大的弊端[2]。计算机辅助X线立体定位引导下真空辅助旋切是乳腺钙化活检的新技术,但不适用于乳房较小、病灶位于腺体边缘及临近胸肌深层的病灶,而且该技术对设备的要求较高,难以推广[7]。
超声引导下真空辅助旋切术是乳腺多发结节、触诊阴性结节的首选活检切除方式,具有操作便捷、无辐射、微创美观的优点[8]。但若乳腺结节内合并钙化灶则切除难度加大,尤其伴有粗大钙化的病灶易引起旋切刀损坏,临床医师应根据临床经验和具体情况慎重选择术式[9]。随着真空辅助旋切技术的改进和经验的积累,该术式的适应证逐渐扩大,用其切除合并钙化的乳腺肿块成为可能。研究[10]表明,钙化灶的大小是能否微创切除的关键。常规使用的Mammotome Legacy HH8BEX旋切针针槽内径为3.9 mm, 操作过程中旋切组织的直径一般为3.0 mm左右,因此超过3.0 mm的钙化往往难以切除,而小于2.0 mm的钙化一般能在切除乳腺肿块组织时一并切除。相关研究[10]报道, 56例含有粗钙化的乳腺肿块中, 50例能通过真空辅助旋切系统彻底切除, 2.0 mm内的钙化全部微创切除。本研究中,合并2.0 mm以下钙化灶的乳腺肿块的真空辅助旋切成功率为95.56%, 与相关研究[10-12]结论相符。
本研究中,旋切组手术时间、切口愈合时间、瘢痕长度短于开放组,术中出血量少于开放组,差异有统计学意义(P<0.05)。分析原因,超声引导下真空辅助旋切术操作便捷,省去了切开、游离、止血、缝合步骤,手术时间明显缩短; 超声定位精确,直达病灶,手术范围小,术中出血量明显减少,术后疼痛明显减轻; 所有操作仅在4.0 mm左右的小切口内完成,切口愈合时间明显缩短,无切口感染,愈合后的瘢痕微小美观,患者满意度较高。需要注意的是,虽然本研究2组患者的术后并发症发生率无显著差异,但随着肿块体积的增大,少数患者旋切术后难以充分止血,术后渗血会造成局部皮肤瘀斑甚至形成血肿,加重局部疼痛,且旋切次数也会增加,少数患者肿块不能完整切除,可出现病灶残留情况。本研究中,2例患者钙化灶未能旋切成功,考虑与钙化灶直径偏大、质地较硬、多发且彼此靠近,旋切刀直接切割到钙化灶而损坏刀头有关。手术医师术前应在超声下仔细探查钙化灶特征,且术中应注意精细操作。
合并钙化灶乳腺肿块的手术方式应个体化选择。超声引导下真空辅助旋切术的优选适应证包括: ① 患者对美观效果要求较高; ② 肿块直径不超过2.5 cm, 位于乳房外周,处于腺体内部中央或靠近后间隙,触诊不可及; ③肿块多发需要一并切除者; ④ 超声检查提示肿块形态规则、边界清楚、内部回声均匀、纵横比小于1,钙化灶直径不超过2.0 mm,单发点状或多个点状钙化散在分布。开放切除术的优选适应证包括: ① 患者要求完整切除病灶,对美观效果要求不高; ② 肿块位于乳晕部中央区,表浅靠近皮下组织,触诊可及; ③ 超声提示肿块形态欠规则、边界欠清、边缘分叶、内部回声欠均匀、纵横比大于1,钙化灶直径大于2.0 mm。
综上所述,超声引导下真空辅助旋切术治疗合并钙化灶乳腺肿块具有操作便捷、无辐射污染、手术时间短、出血量少、愈合时间短、切口瘢痕小、疼痛轻微、患者满意度高等诸多优点,建议在临床适度推广。本研究属于回顾性分析,远期效果还需今后开展大样本随机对照研究进一步观察。在临床工作中,医师应根据手术适应证选择术式,掌握钙化灶切除手术技巧,以获得更好的手术效果,减少并发症的发生。

