高镍三元正极材料表面碱性物质研究进展
胡 悦,徐乐乐,周彦方,徐 哲,田守帅,廖 凡,杨小俊
(1.湖北容百锂电材料有限公司,湖北鄂州436000;2.绿色化工过程教育部重点实验室,新型反应器与绿色化学工艺湖北省重点实验室,磷资源开发利用教育部工程研究中心,武汉工程大学化工与制药学院)
随着世界各国对新能源汽车的加速布局,电动车的续航里程成为了各大车企的关注热点。动力电池中正极材料能量密度的高低,是制约动力汽车实现长续航的关键因素。因此,高能量密度正极材料近年来被广泛研究。高镍三元正极材料凭借着高能量密度在正极材料中脱颖而出,从NCM523(N=Ni,C=Co,M=Mn)到NCM622,以及到最近热门的NCM811,随着镍含量的增加,三元正极材料的能量密度逐步提高。目前,具有高能量密度的锂离子电池已经在插电式混合动力汽车(PHEVs)和电动汽车(EV)上被广泛应用。但是,随着镍含量的增加,高镍材料的固有缺点也随之暴露。镍含量的增加会加剧材料内部阳离子的混排程度,使Li+的扩散受阻,材料的倍率性能下降;Co的引入在一定程度上解决了混排加剧的问题[1]。此外,镍含量的增加加剧了晶格内O2-向O2的转化,伴随热量的释放,同时发生热诱导相变;Mn含量的增加能提高材料的热稳定性[2-3]。因此,活性正极材料Li[Ni(1-x-y)CoxMny]O2(NCM)的性能在很大程度上由Ni、Co、Mn的相对含量决定。其中,Ni提供了高比容量;Mn保证良好的循环寿命和结构稳定性;Co增加了电子导电性,提供了良好的Li+传输速率,改善了材料的倍率性能[4]。为进一步提高能量密度以满足电动汽车实现长续航的要求,且减少对高成本Co的依赖,各大电动汽车厂商也开始选择使用高镍型活性正极材料制作的电池。但是,有研究发现NCM811比NCM111材料容量衰减更快,使用寿命更短。高镍材料表面形成的碱性物质是导致容量衰减加快、加剧结构相变的关键因素[4-6],尤其是Li2CO3和LiOH,不仅使材料表面pH升高,也对材料的加工和储存产生不利影响。因此,近年来对高镍材料表面碱性物质的形成、危害及处理工艺的研究成为对锂离子电池正极材料研究的热点,分析三元材料表面碱性物质对正极材料的影响对于提高二次锂离子电池的功能和安全性至关重要。
1 高镍材料表面碱杂质的组成和形成机理
活性正极材料LiNiO2和与其具有相同结构的NCA(A=Al)、NCM表面存在Li2CO3的现象很早就被报道[7-9]。从高镍活性正极材料的合成工艺可知,材料的热稳定性与镍含量呈反比,因此合成高镍活性正极材料的煅烧温度一般为700℃。选用分解温度低的LiOH·H2O作为锂源,在煅烧冷却阶段,未反应的锂源也残留在材料表面,此时活性正极材料表面会存在LiOH和Li2CO3[10]。三元材料烧结过程示意图见图1。
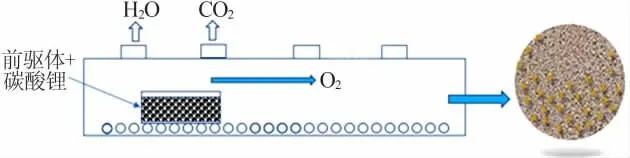
图1 三元材料烧结过程示意图Fig.1 Sintering process of ternary cathode materials
合成后的活性正极材料表面在储存过程中会形成非晶态的杂质薄膜,其组成也为碱性物质,而表面碱性杂质的成分、形成的快慢或含量的多少,则与活性正极材料Ni含量的高低、所处环境中CO2和H2O的含量有关。LIU等[11]利用LiNi0.8Co0.2O2分别进行O2、CO2和H2O的程序升温脱附与质谱联用(TPDMS)测试,确定表面吸附态形式主要为碳酸氢盐(HCO3-)和碳酸盐(CO32-)。FAENZA等[12]研究了NCA分别在Ar气、空气、干燥空气、干燥CO2气氛中形成的表面杂质。储存在Ar气或者干燥空气(露点:-40~-35℃)中的NCA材料,红外光谱显示LiHCO3/Li2CO3微量存在;储存在空气中的NCA表面,存在大量的LiHCO3和Li2CO3。进一步将这些不同储存环境中的材料进行热重分析,对比在不同温度下的质量损失情况,发现其质量损失顺序为空气储存质量损失>干燥CO2储存质量损失>干燥空气储存质量损失=惰性Ar气储存质量损失,这一现象表明环境中的水分有助于表面碱性物质的形成。目前,对于表面碱性物质形成的机理并没有统一的定论:一部分学者认为CO2在材料表面直接转化为Li2CO3;一部分学者认为是活性正极材料中Li+的脱嵌与环境中水分(或者H+)的相互作用有关,首先在表面形成LiOH,再逐渐转化为HCO3-和CO32-。MATSUMOTO等[13]将制备的LiNi1-x-yCoxAlyO2暴露在相对湿度为55%、温度为25℃的流通空气中,利用红外光谱探测到Li2CO3的存在,研究发现CO2的转化量和材料的暴露时间成正比。利用高温测试下的X射线衍射(XRD)观察到Li2CO3的特征峰在525℃开始出现,并在675℃达到最大值,最终在725℃消失。同时,通过热重分析,MATSUMOTO等采用Ozawa原理研究了NCA样品在不同气氛条件下与CO2的反应活化能和转化率的关系。在100%CO2干燥气氛中,NCA表面形成Li2CO3所需活化能最高。随着O2的加入,反应活化能减小,因此Li2CO3形成可能符合反应式(1)所表示的路径,此时的反应活化能为130 kJ/mol。MATSUMOTO等发现在100%CO2(相对湿度为100%)气氛中,NCA表面形成Li2CO3所需活化能和有氧状态下的反应活化能一致,因此他们认为水分可在低温下促进NCA表面碳酸化反应。表面Li2CO3形成机理见图2。

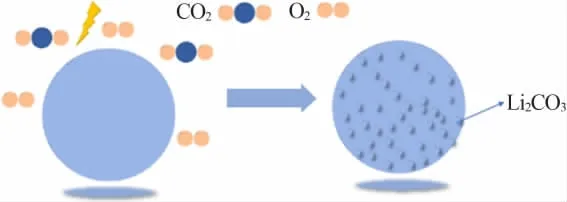
图2 表面Li2CO3形成机理图Fig.2 Formation mechanism of lithium carbonate on surface
ZHANG等[14]通过研究LiNi1/3Mn1/3Co1/3O2在潮湿环境下(空气,20℃,60%湿度)的结构、磁性和电化学特性的演变,探索了LiNi1/3Mn1/3Co1/3O2对H2O的反应活性。拉曼光谱显示表面存在LiOH和Li2CO3,通过磁特性验证了LiOH和Li2CO3形成的碱性表层厚度约为10 nm,Li参与了表面LiOH和Li2CO3的形成过程。按此推测,如果没有水分,就不会形成氢氧化物或水合物,甚至会阻碍碳酸盐的形成。SICKLINGER等[15]将在干燥CO2中储存的NCM811和潮湿环境中储存的NCM811材料进行了对比,利用漫反射红外傅里叶变换光谱(DRIFTS)和热重(TGA-MS)测试。结果表明,在干燥CO2中储存的NCM811材料表面CO32-含量低;潮湿CO2与材料表面发生反应形成碱性物质,H2O的参与似乎提供了另一条更容易的反应路径。表面LiOH、Li2CO3形成机理图见图3。SHKROB等[16]将其解释为阳离子(Li+/H+)的交换过程[见式(2)~(4)],H+/Li+的交换最可能发生在边缘区域。层中的Li+向外迁移并与碳酸盐或氢氧化物结合,H+/Li+的交换发生在表层,生成的H+则向相反的方向迁移至过渡金属(TM)离子的空位中。
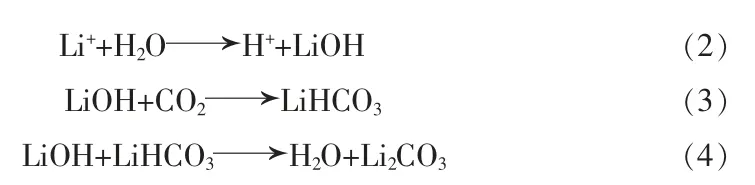
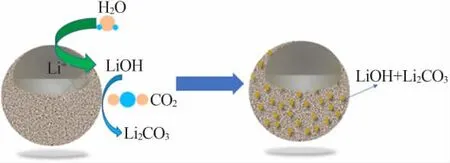
图3 表面LiOH、Li2CO3形成机理图Fig.3 Formation mechanism of lithium hydroxide and lithium carbonate on surface
在上述过程中,部分学者认为Ni并没有由+3价转变为+2价,而是在表面生成了NiOOH[17-18];另一部分学者认为阳离子交换对该反应过程作用很小,更倾向于Li+和表面活性氧与H2O、CO2的反应生成LiOH、LiHCO3、Li2CO3,为保持氧化还原过程中材料的电中性,材料内部的过渡金属将会由高价态转变为低价态,并跃迁至亚表层[16]。大多数情况下,表面碱性物质越多,意味着材料表面有更多的NiO岩盐相和LixNi1-xO相,因为这些相的生成正是发生了氧化还原反应[见式(5)~(8)],同时产生了活性氧和表面碱性物质[19-20]。
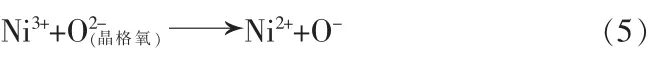
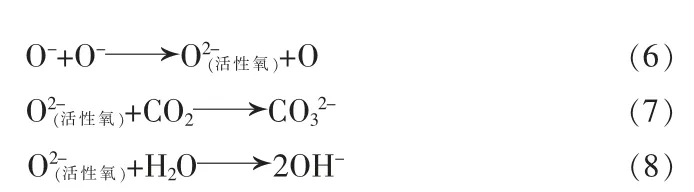
SHIZUKA等[21]首先制备了不同Ni含量、Li含量、分别掺杂Mn或Al的Li1+zNi1-x-yCoxMyO2(M=Al,Mn)材料,并对比了它们在空气和CO2环境中储存前后表面CO32-和电化学性能的变化。发现在同样环境暴露下,材料组成中Ni含量越高表面所含CO32-越多,且该材料的倍率性能恶化越快。将Li1.040Ni0.80Co0.15Al0.05O2在CO2中持续暴露24 h,通过XRD分析发现Li2CO3的存在,并且随着暴露时间的增加,扫描电镜(SEM)显示材料表面由最初的光滑变得模糊钝化。对暴露后材料中Ni元素进行价态分析,发现了Ni3+向Ni2+的转化,100周循环测试容量保持率降低至60%。
2 表面碱性物质对正极材料的危害
对于高镍型三元材料,随着Ni含量增加Li在分子层中的约束力减弱,Li+的脱嵌将变得十分顺畅,相比NCM111产品,NCM811就可以在0.2C倍率、较低的截止电压下产生较高的容量[22]。但是,在空气中暴露时,高镍三元材料表面甚至层状结构中的Li+也更容易在表面形成碱性物质,由于碱性物质形成过程中还伴随过渡金属的还原和迁移,Ni3+的还原促进了颗粒表面活性氧的形成,在空气(含CO2、H2O)中,活性氧的形成进一步促进了颗粒表面形成碱性吸附质,从而使迁移至表面的Li+和过渡金属离子固化[23-24]。碱性物质层的厚度随着颗粒表面与H2O、CO2接触时间的增加而变厚,且H2O、CO2含量越高,碱性物质的形成速度越快[25-26]。JUNG等[27]将NCM811在环境中放置1 a,通过X射线光电子能谱(XPS)观察到表面晶格氧信号消失、Ni元素信号存在,并且表层(碱性物质层)厚度增大至10 nm,碳酸盐(CO32-)质量分数由最初的0.07%增加至0.39%。这表明随着表面碱性物质的增加,Ni由NCM层状结构中的Ni3+/4+逐渐还原为Ni2+,并迁移至材料表面。对比1 a前后NCM811-Li的前三周期电压分布,初始电压由3.64 V增加至4.22 V,表明在充放电过程中,材料表面的碱性物质阻碍了Li+的脱出和嵌入。对比放置1 a前后的NCM811,当截止电压为4.4 V时,比容量由241 mA·h/g下降为231 mA·h/g;在0.1C倍率下,从54圈循环至314圈后,容量保持率由94%降低至88%;而在1C倍率下,从55圈循环至312圈时,容量保持率由93%降低至75%。材料表面的碱性物质在充放电、高温存储和过充时也会显得十分不稳定,很容易产气导致电芯鼓包[28-29]。相比NCM111,高镍型三元正极材料凭借高容量密度脱颖而出,但在使用过程中,NCM811却可能出现更快的容量衰减、更短的使用寿命以及较差的安全性。因此,高镍三元材料需要更高更严的储存要求,否则材料表面形成的碱性物质层将对Li+脱嵌产生重要影响。理想状态下物料表面似乎应该没有任何氢氧化物或者碳酸盐,然而这种理想状态却不是对材料最有利的,或者说在一定程度上是不可能达到的,因为越接近这种理想状态,材料表面的结构越会被破坏,而发生在表面甚至亚表面的结构变化对材料的电性能也是致命缺陷。HWANG等[30]利用选区衍射和对应区中O的电子能量损失谱分析,发现在NCA颗粒表面Li含量较低或Li空位较多时,材料表面易发生由层状到尖晶石结构最终转化为岩盐结构的相变现象。相变发生时,为使整体电荷趋于中性,伴随有过渡金属(尤其是Ni4+/3+)的还原和迁移、O的损失等现象[28,31-32],最终在表面形成新相和空隙,因此只有合理地控制表面Li不被过多流失,才有助于材料整体性能的改善。针对这一现象,PAULSEN等[33]提出表面“可溶性碱度平衡态”的概念,认为平衡态时的可溶性碱性物质(可溶性碱基)是材料的表面性质,而不是杂质。三元材料表面的可溶性碱性物质含量和材料的Ni含量、比表面积等表面形态相关,即每个材料表面的可溶性碱性物质含量存在一个平衡态,当含量低于平衡态时,材料表面将会形成碱性物质优先达到平衡态;当含量高于平衡态时,多出的部分则是杂质。值得注意的是,与可溶性碱性物质(如LiOH、LiHCO3、Li2CO3)不同,表面还存在NiCO3·2Ni(OH)2·xH2O等不溶性碱[15,27],这些不溶性碱不仅固化了过渡金属,还形成了难以处理的高阻抗层。因此,合理控制材料表面碱性物质的含量,才能使材料性能达到最优。
3 表面碱性物质的处理工艺研究
为保持高镍三元材料的高容量密度优势,同时减少电池产气、实现电池长使用寿命的目的,控制材料生产过程中表面碱性物质的含量显得十分重要。材料表面碱性物质最初来源于烧结成型过程,锂盐作为原料在高温煅烧过程中会有一定的挥发,在配料时会稍微提高Li与M的比例(即锂盐适当过量)来弥补烧结过程中造成的损失,因此会有少量的Li+残余在物料表面,吸附环境气氛中的CO2和H2O形成LiOH和Li2CO3等。尤其是针对高镍三元材料,目前普遍采用的是水洗降碱工艺,而该工艺又分成洗涤、干燥等过程,水洗除碱流程见图4。材料表面的物质、结构在整个过程动态变化,例如洗涤是利用材料表面碱性物质在溶液中的溶解性质进行降碱,而碱性物质的溶解程度直接影响降碱程度;随后在湿料的干燥过程中,洗涤后的干净表面将会受干燥条件的影响产生不同的变化。因此,选择合理的洗涤、干燥条件会减小材料表面发生的变异。
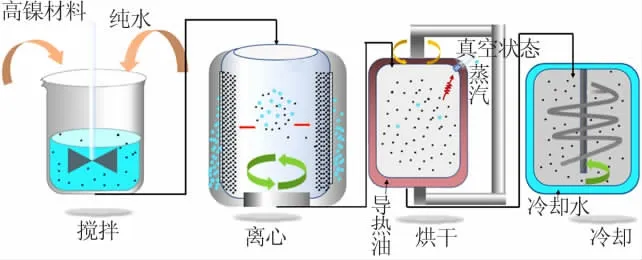
图4 水洗除碱流程图Fig.4 Flow diagram of alkali-reducing by washing
PRITZL等[34]使用去离子水分两次按相同工艺重复洗涤NCM-851005(巴斯夫)材料,每次洗涤结束后过滤、烘干。分别对两次洗涤后的浆液进行碱量滴定,由于OH-在常温水中的溶解度是CO32-的2倍,OH-本应在第一次洗涤后被完全去除,但实际滴定结果显示第二次水洗后的浆料中CO32-的含量几乎为0,而OH-仍然大量存在,推测在水洗过程中有额外的LiOH产生,即洗涤过程中物料表面发生了前文描述的Li+/H+的离子交换反应,因此过强的水洗程度会导致材料表面和层状结构中的Li+不断反应生成LiOH直至溶液呈饱和状态。实际上,除了OH-和CO32-在水中溶解外,Li+也会在水中大量地自发浸出溶解,相比Li+在水中的浸出率,过渡金属Ni、Co、Mn在水中的浸出率要低很多,其浸出率顺序为Li浸出率≫Ni浸出率>Co浸出率≈Mn浸出率[35-36],由于水洗过程中Li+/H+离子交换,PRITZL等和JEONG等分别发现水洗后的高镍NCM和LiCoO2表面存在NiOOH和CoOOH[34,37]。水洗后的材料暴露在空气中,其表面将更容易结合H2O和CO2形成碱性物质层,同时结构中阳离子混排加剧,最终导致NiO立方相的生成[38-39]。经研究,水洗后的烘干过程同样对材料表面结构产生较大影响,PRITZL等[34]提出当烘干温度达到180℃时,MOOH相(M=Ni、Co、Mn)能够向M3O4尖晶石相转变;当烘干温度继续升高至300℃时,将最终转变为MO岩盐相。同时,水洗后的NCM在25℃下的低温烘干后容量基本没有衰减,但在80~300℃下烘干时,材料比容量下降了20~30 mA·h/g,容量下降的主要原因是尖晶石相或岩盐相结构固化表面的Li,使其失去了活性。因此,除了简单的水洗降碱工艺,目前应用更多的是“水洗+低温烧结”复合工艺降碱,因为水洗后的三元正极材料到完全包装密封的整个过程中不可能做到完全隔绝CO2和H2O,水洗后的低温烧结工艺有助于进一步降低表面碱性物质含量使其保持在较低水平,同时还对材料表面结构有一定的修复作用。MARTINEZ等[40]对水洗前后的NCM811在300℃时进行热重分析,通过对比发现未水洗的NCM811在300℃时热重曲线有CO2特征峰出现,而水洗后该特征峰消失。这是由于LiHCO3的热稳定性差,脱离溶液后不能大量存在于材料表面,而Li2CO3的分解温度远大于300℃。因此,CO2的来源可能符合式(9)反应:
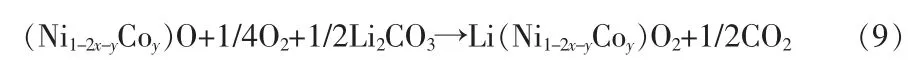
值得注意的是,M2+再次氧化为M3+,且有层状Li-M氧化物生成,该层状氧化物有利于材料容量性能的恢复[41]。
4 总结及展望
在空气中暴露时,高镍材料由于具有高表面活性,其表面容易生成LiOH、Li2CO3等碱性物质,这些碱性物质通过阻碍Li+扩散和降低容量对材料的循环性能产生了消极影响,同时活性材料表面的碱性物质将直接影响电池使用过程中的安全性能。目前水洗是最有效的降碱方法,但水洗强度直接影响水洗后材料表面的物质组成和结构性能,水洗时的固含量、搅拌时间,甚至有无超声使其分散更均匀,都对材料的粒径分布、表面形貌和电化学性能产生直接影响[42]。除了纯水洗涤,也可以采用其他溶剂对材料表面进行修饰[39],也有不少学者提出在对碱性物质水洗分离的同时进行表层包覆的方法,能起到消耗残留碱性物质并提升材料性能的目的[26,43]。后续的研究重点在于如何将水洗降碱和包覆更好地结合,使活性正极材料表面残留的碱性物质更好地甚至能直接转化为有助于Li+传导的包覆层,提高表面结构的稳定性和良好的电化学性能,但是在这个过程中离不开合适的后处理工艺,比如最优的烘干工艺、低温烧结工艺等。

