云南边境地区3种外来动物疫病流行情况及病原特性研究
赵文华,李富祥,尹 伟,杨仕标*
(1.云南省热带亚热带动物病毒病重点实验室/云南省畜牧兽医科学院,云南昆明 650224; 2.嵩明县杨桥街道农业综合服务中心,云南杨桥 651705)
小反刍兽疫(Peste des petits ruminants,PPR)是由小反刍兽疫病毒(Peste des petits ruminants virus,PPRV)引起的以感染动物发热、口炎、腹泻和肺炎为临床表现特征的一种急性或亚急性传染病。该病因快速传播和较高的病死率而被世界动物卫生组织(OIE)列为必须报告的动物疫病,在我国也将其列为为一类动物疫病[1-2]。目前,PPR主要在非洲和亚洲流行,主要流行毒株为谱系Ⅳ型,每年影响全球3 000万头动物,估计每年造成12亿~17亿美元的经济损失[3]。我国于2007年7月在西藏阿里地区首次发现小反刍兽疫疫情[4],因疫情发现早,处置果断,仅限于局部。2013年底,PPR再次沿河西走廊从新疆向全国范围快速暴发,至今仍有零星散发[5-6],严重威胁我国畜牧业的生产安全。
裂谷热(Rift Valley fever,RVF)是一种由蚊子传播的人兽共患疫病,其病原体是布尼亚病毒科白蛉病毒属的裂谷热病毒(Rift Valley fever virus,RVFV),该病严重威胁人类和牲畜健康[1,7]。 易感动物是绵羊、山羊、黄牛、水牛及一些野生动物。RVF最早于20世纪30年代初在肯尼亚东部裂谷省因导致感染羊的高流产率而被发现报道。近年来已有30多个国家发现RVF,其中绝大部分位于非洲[8-9]。该病毒具有跨境传播潜力。中国于2016年6月确诊了首例RVFV输入性人感染病例,该病通过入境人员、合法或者非法贸易活体动物及其产品,边境地区虫媒等因素传入我国的风险极大,存在着潜在的威胁[10]。目前尚未见有动物感染的报道。OIE将RVF列为必须报告的动物传染病。
施马伦贝格病毒(Schmallenberg virus,SBV)是一种正布尼亚病毒,于2011年11月在德国通过宏基因组检测首次被发现并报道,此后在欧洲多地确诊存在该病[11-12]。SBV主要是由库蠓传播,多种家畜和野生动物均易感染;感染牛、绵羊和山羊,引起短暂发热、腹泻、奶牛产奶量减少,更严重的是怀孕动物流产或后代畸形,可造成相当大的经济损失。至2013年9月下旬,共有27个欧洲国家存在SBV感染区;2016年-2017年,英国和法国暴发该病。目前我国尚无该病的报道。
云南省地处我国西南边陲,与东南亚多国接壤或者相邻,地理位置特殊。 PPRV、RVFV及SBV等3种重要的外来动物疫病通过人员往来、活体动物及其产品贸易、虫媒等因素传入云南边境地区的风险极高。为了有效地防控该3种外来动物疫病入侵,在边境地区外来动物疫病日常监测、海关进口活体牛、羊等及其制品检验检疫中需要对该3种病原实施检测。此外,是否存在PPR无临床症状带毒羊,一直是学者和兽医行业主管部门关注的问题。为了了解上述3种重要外来动物疫病在云南边境地区的流行情况,2019年11月,对昆明辖区内某大型牲畜交易市场及某规模化奶牛合作社随机采取绵羊、山羊、牛、马及驴等不同动物(包含境外动物)鼻拭子样本及血液样本进行病原核酸检测,并对检测阳性病原进行了病原学特性研究。现将研究结果报告如下。
1 材料与方法
1.1 材料
1.1.1 样本 对云南昆明辖区内某大型牲畜交易市场及某奶牛规模化合作社采集不同动物鼻拭子样本或血液样本,样本情况详见表1。
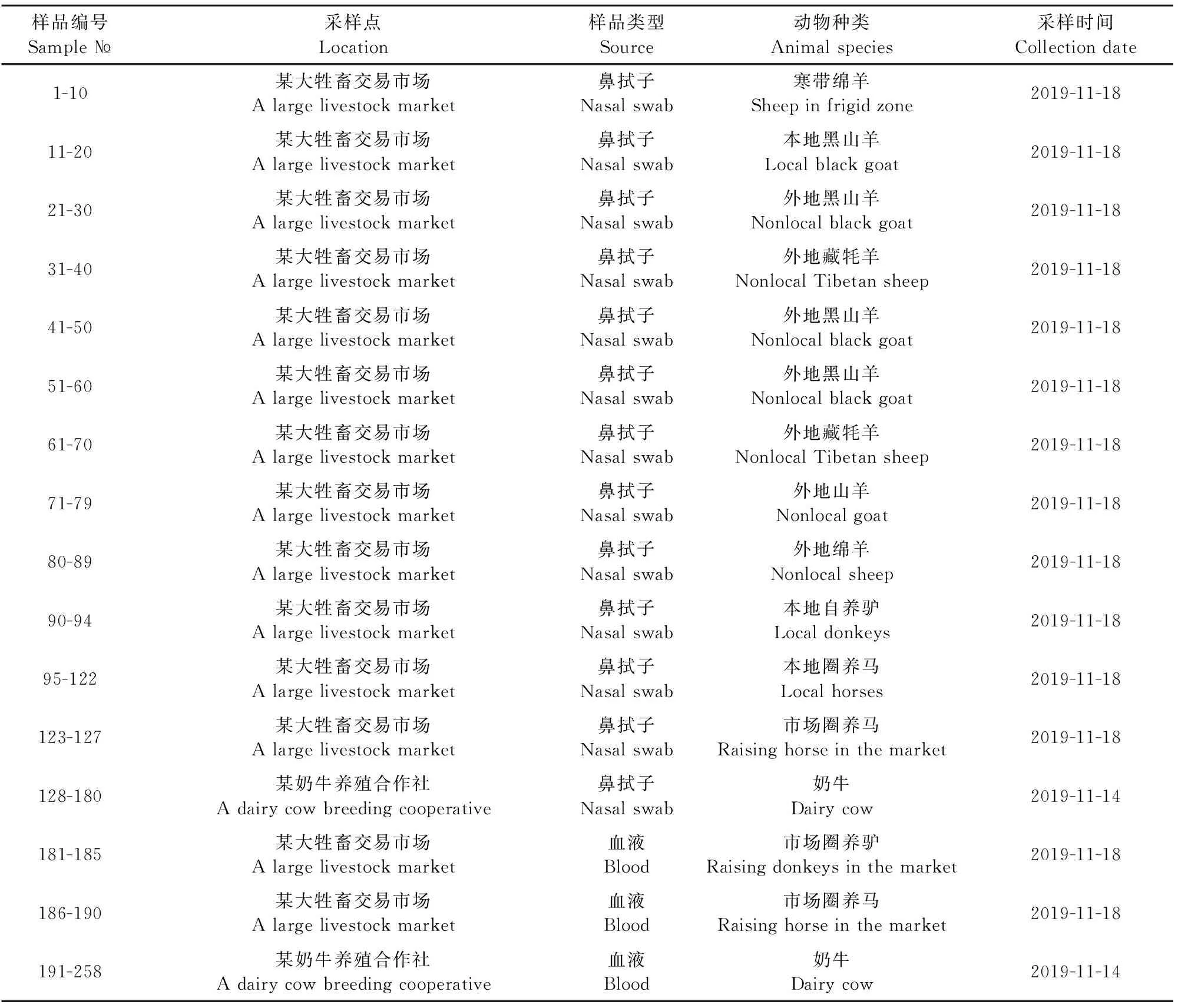
表1 样品信息表
1.1.2 试剂、耗材及仪器设备 采集用一次性无菌拭子,扬州洋生医药科技有限公司产品;一次性负压血样采集器及采集针,山东天爱医疗器械有限公司产品;8.5 mg/mL无菌生理盐水,实验室配制,用于采集鼻拭子样本及样本浸泡;TaKaRa MiniBest Viral RNA/DNA Extraction kit用于病毒核酸(DNA/RNA)的抽提, TaKaRa MiniBest Plasmid Purification Kit(9760)用于质粒样品的抽提,TaKaRa ExTaq(RR001A)用于普通PCR扩增, TaKaRa One Step RNA PCR Kit(RR024A)用于普通RT-PCR扩增,One Step PrimeScriptTMRT-PCR(Perfect Real Time,RR064A) 用于实时荧光定量RT-PCR,TaKaRa MiniBest Agarose Gel DNA Extraction Kit(9762)用于DNA胶回收,pMDTM18-T Vector Cloning Kit(6011)用于T载体构建;DNA标准DL 2 000、Goldview核酸染色剂,宝生物工程(大连)有限公司产品;GeneAmp PCR SYSTEM 9700普通PCR仪、ABI 7500 Fast 荧光定量PCR仪及荧光定量PCR反应管,ABI公司产品;Nanovue Plus微量分光光度仪,GE公司产品;Blowest Agarose,生工生物工程(上海)股份有限公司产品;氯仿、异丙醇、无水乙醇等其他试剂,均为分析纯试剂。
1.1.3 引物 根据参考文献[14-15]及GenBank相关序列,设计相关检测用引物及探针,详见表2。合成位于PPRV M基因位置的探针引物,用“Cy5-BHQ2”标记;合成位于RVFV NS基因位置的探针引物,用“FAM-TAMRA”标记;合成位于SBV NP基因位置的探针引物,用“VIC-BHQ1”标记;组成PPRV/RVFV/SBV三重实时荧光RT-PCR检测体系。PPRV FHF/FHR引物对位于PPRV基因组的F基因与H基因接头位置,用于阳性PPRV样本的普通RT-PCR鉴定。TaqMan探针及引物均由宝生物工程(大连)有限公司合成,级别均为HPLC级。将合成的引物/探针干粉用无RNAase酶的PCR级水进行溶解,引物/探针贮存浓度为100 pmol/μL,引物工作浓度为20 pmol/μL,探针工作浓度为10 pmol/μL。

表2 检测用探针引物
1.2 方法
1.2.1 样本采集及处理 在云南昆明辖区内某大型牲畜交易市场和某规模化奶牛场,共采集到258份不同来源的样品,其中,鼻拭子样品180份,包括羊89份、牛53份、马33份和驴5份鼻拭子样品;血凝块样本78份,包括牛68份、马5份和驴5份血凝块样品(表1)。鼻拭子样本于5 mL 8.5 g/L生理盐水中浸泡过夜后,每5个样品做成一个池样品抽提RNA,共计有36个池样品;血凝块样品研磨后亦每5个做成一个池样品抽提RNA,共计有14个池样品。检测结果为阳性的池样品再逐一抽提组成其每个单样品的RNA。
1.2.2 病毒基因组RNA提取 采集的鼻拭子样本加入5 mL生理盐水浸泡过夜,各取200 μL待用,采集的血液样本,取凝结后的血块加适量生理盐水研磨好各取200 μL待用。然后按照提取试剂盒说明书操作, 简述如下:待测样品各取200 μL,加入1.5 mL离心管中,然后加入200 μL的Solution A,室温放置5 min,再加入75 μL的Solution B,混匀后,12 000 r/min离心5 min。将上清液转移到新的2.0 mL收集管中,加入250 μL含10 mg/mL冰乙酸的异丙醇,混匀,再将上清液转移至吸附柱中,12 000 r/min离心1 min,弃滤液。将500 μL的Rinse A加入至吸附柱中,室温静置1 min,12 000 r/min离心1 min,弃滤液;再将800 μL的Rinse B加入至吸附柱中,12 000 r/min离心1 min,弃滤液,再次12 000 r/min离心1 min。最后将吸附柱安置于一新的1.5 mL的离心管上,在吸附柱膜的中央处加入50 μL的含20 mg/mL RNase Inhibitor的Elution buffer,室温静置3 min~ 5min,然后12 000 r/min离心洗脱DNA。弃去吸附柱, 将收集有RNA液体的离心管, 贮存于-70℃冰箱备用。
1.2.3 反应体系及反应程序 PPRV/RVFV/SBV三重实时荧光定量RT-PCR反应液配制,反应体系20 μL:2×One Step RT-PCR buffer Ⅲ 10.0 μL,TaKaRa ExTaqHS 0.4 μL,PrimeScript RT Enzyme Mix Ⅱ 0.4 μL,Rox Ⅱ 0.4 μL,Primer PPRV-M-tryF1 0.2 μL,Primer PPRV-M-tryR1 0.2 μL,PPRV-Probe-M 0.4 μL,Primer RVFV-tryF1 0.2 μL,Primer RVFV-tryR1 0.2 μL,RVFV-Probe1 0.4 μL, Primer SBV-tryF1 0.2 μL,Primer SBV-tryR1 0.2 μL,SBV-Probe1 0.4 μL,样品RNA 6.0 μL(或PPRV/RVFV/SBV阳性对照质粒DNA各2.0 μL、阴性对照H2O 6.0 μL),H2O 0.4 μL。反应液混匀后置7500 Fast荧光定量PCR仪上进行反应和荧光信号的检测,反应程序为:42 ℃ 5 min;95 ℃ 20 s;95 ℃ 5 s,60 ℃ 35 s,共43个循环。荧光信号检测在每个循环反应的60 ℃进行。
阳性PPRV样品RT-PCR反应液配制,反应体系为50 μL:10×One Step RNA PCR buffer 5.0 μL,MgCI210.0 μL,dNTP Mixture 5.0 μL,RNase Inhibitor 1.0 μL,AMV Reverse Transcriptase XL 1.0 μL,AMV-OptimizedTaq1.0 μL,Primer PPR-FHF 1.0 μL,Primer PPRV-FHR 1.0 μL, Sample RNA(或阳性对照RNA、阴性对照H2O )2.0 μL,H2O 23.0 μL。反应各组分加入混匀后置ABI 9700普通PCR仪进行反应,反应程序为:42 ℃ 30 min; 95℃ 2 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 1 min,共35个循环;72 ℃ 10 min。反应完毕,用20 g/L琼脂糖凝胶进行电泳,在紫外灯下检测扩增结果。
1.2.4 PPRV阳性样品的胶回收、克隆及序列测定分析 将扩增出的PPRV阳性样本F-H基因接头部位片段首先进行胶回收纯化,然后克隆连接至pMD-18T Vector,对获得的阳性克隆进行序列测定和分析,具体详细操作步骤参见相关的参考文献[16-17]。用DNA Star软件对所测序列数据进行分析。
2 结果
2.1 样品PPRV/RVFV/SBV三重荧光实时定量RT-PCR检测结果
用本实验室已经建立的PPRV/RVFV/SBV三重荧光实时定量RT-PCR方法对1.2.1所述50个池样品进行检测,在阴性和阳性对照都成立的情况下,检测到PPRV阳性池样品1个(图1),通过进一步对该阳性池样品每个组成单样品的检测,最后确定采集自大型牲畜交易市场的32号藏牦羊鼻拭子样本为PPRV核酸阳性。而所有的样品池中,在绵羊、山羊、奶牛、马及驴中均未检测到RVFV及SBV核酸阳性样本。
2.2 PPRV阳性样本F-H基因接头部位RT-PCR扩增及核苷酸序列测定
用表2所设计的PPRV-FHF/ PPRV-FHR引物对对三重荧光定量RT-PCR检出的PPRV阳性32号鼻拭子RNA样本进行常规PPRV RT-PCR扩增,有739 bp预期大小片段扩出(图2)。将阳性片段胶回收纯化、克隆至pMD18T-Vector进行序列测定,测得的核苷酸序列已递交GenBank,序列号(accession №)为MT109378。
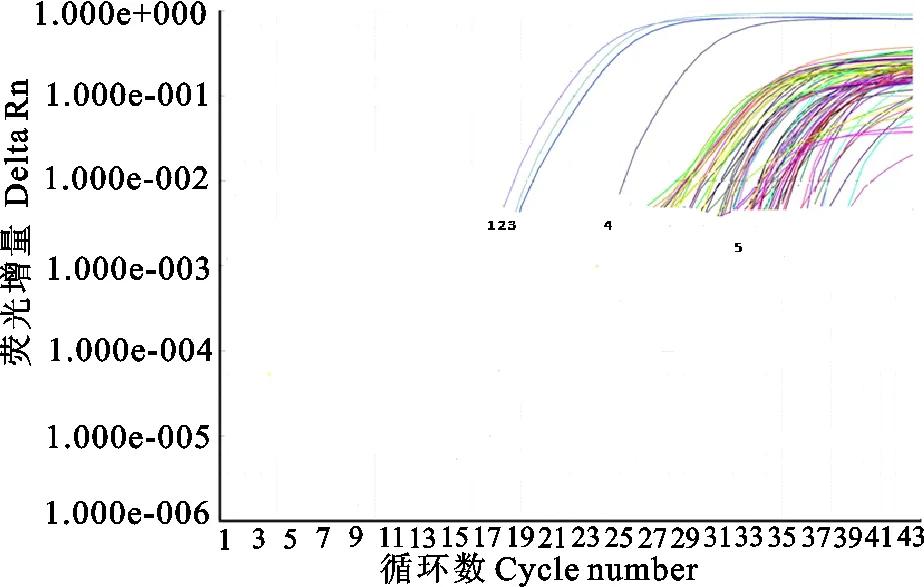
1.PPRV阳性对照;2.RVFV阳性对照;3.SBV阳性对照;4.PPRV阳性样本;5.阴性对照及阴性样本
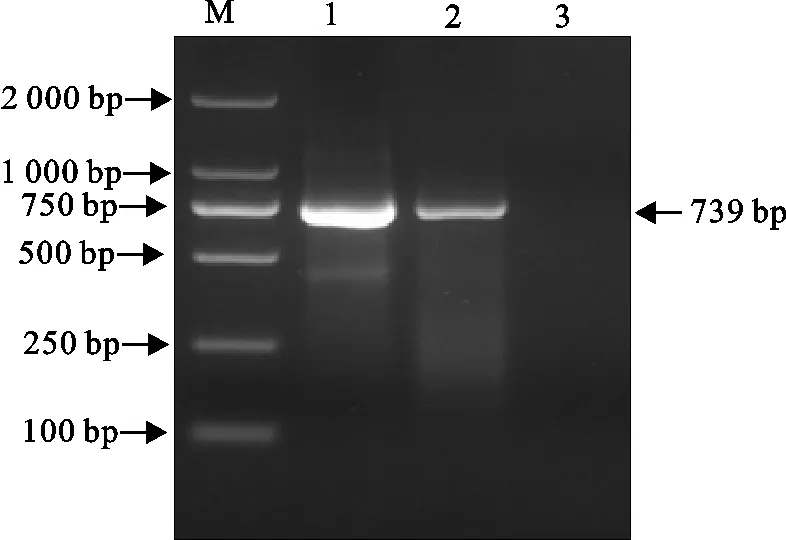
M.DNA 标准DL 2 000;1.32号样本;2.阳性对照;3.阴性对照
2.3 序列遗传进化分析
序列测定所检测出的32号羊鼻拭子F-H基因接头部位核苷酸序列通过与PPRV各基因型参考毒株序列比对,发现其属于基因谱系Ⅳ型(图3);与各基因型参考序列同源性在85%~99.2%之间(图4),与2013年在新疆伊犁山羊中检测到的毒株(KM091959)及2014年在吉林家养山羊检测到的毒株(KM816619)核苷酸同源性最高,为99.2%。遗传进化树构建及同源性比对所用的PPRV参考毒株情况详见表3。

表3 PPRV参考毒株情况表
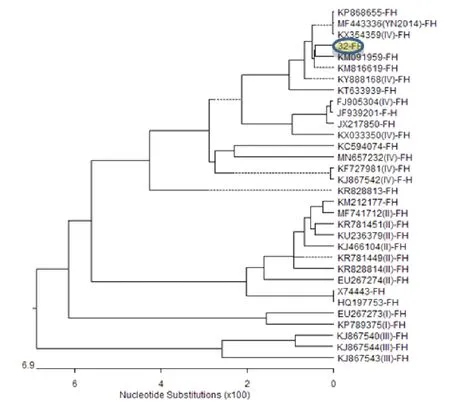
图3 32号鼻拭子样品与PPRV参考毒株F-H接头部位核苷酸序列遗传进化树
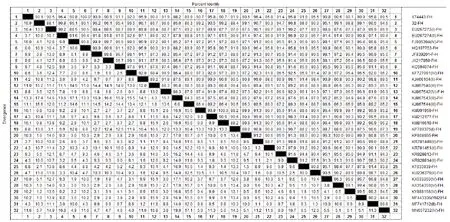
图4 32号鼻拭子样品与PPRV参考序列F-H接头部位核苷酸同源性比对
3 讨论
PPR、SBV和RVF是3种重要的外来动物疫病,均具有跨境传播的特征,其中,RVF为非常严重的人畜共患病,公共卫生意义特别重大。虽然,自2014年以来,PPR已经在我国流行,但目前我国依然按照外来动物疫病管理。云南地处我国西南边陲,与东南亚多个国家接壤或者相邻,与南亚多国相近,是多种跨境动物疫病传入我国的主要门户。PPR、SBV和RVF等3种外来动物疫病,通过人员往来、合法和非法的活体动物及其产品贸易、生物媒介等传入云南边境地区的风险极大,对其实施检测和监测具有重要的意义。
为评估上述3种外来动物疫病传入云南边境地区的风险,在云南昆明辖区内某大牲畜交易市场和某规模化奶牛场,共采集自羊、牛、马和驴等4种不同动物总计258份样品进行核酸检测。检测结果表明,在昆明交易羊中仍存在PPRV,通过基因测序比对,确认为目前流行基因谱系Ⅳ型。本次检测未检测到RVFV和SBV核酸阳性样品,表明在有限的采样范围内,目前云南羊、牛、马和驴等4种家畜尚未有该两类病毒。
本次检测到的PPRV核酸阳性样本,应用普通RT-PCR扩增F-H基因接头位置序列,并进一步完成了核苷酸序列测序比对,确定其为PPRV谱系Ⅳ型毒株,与2013年新疆伊犁山羊毒株(KM091959)及2014年吉林家养山羊毒株(KM816619)核苷酸同源性最高,达到99.2%。该项结果提示,云南边境地区交易的临床健康山羊中存在携带PPRV的情况。PPR无症状感染一直为行业学者和动物卫生管理部门所关注,应该引起足够的重视。本次检测的毒株尚未完成全基因组测序比对和致病性研究,待实验室条件成熟,以及动物卫生管理部门审批后进一步完成。
本研究中所检测的258份样本中均未检测到RVFV和SBV核酸阳性样本。在云南边境地区,人员往来、合法和非法的活体动物及其产品贸易、生物媒介等RVFV和SBV传播因素是存在的;而且,云南热带亚热带气候条件特别适合该2种病原的生态条件,该2种外来动物疫病传入云南边境地区的风险很大,应时刻保持警惕,加强监测预警。

