和厚朴酚对非酒精性脂肪肝模型大鼠的改善作用
陆少君 ,蔡肇栩 ,陈文健,刘瑶
(1.广东药科大学实验动物中心,广东广州 510006;2.肇庆市第一人民医院药学部,广东肇庆 526000;3.广州市妇女儿童医疗中心儿科研究所,广东广州 510006)
非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)是指在无过量饮酒史的情况下,肝组织学的改变类似于酒精性肝病,表现特征主要为肝细胞内脂肪过度沉积和脂肪变性[1]。近年来随着世界范围内糖尿病和肥胖发病率的上升,NAFLD发展迅速,现已成为世界性最常见的肝脏疾病之一。全球流行病学研究显示[2],西方国家成年人中NAFLD 患病率约为20%~30%,而仅在美国,总人口的27%~34% 患有NAFLD,其中儿童占10%,75%~92%的病态肥胖患者也都患有NAFLD,这些NAFLD患者中有10%~15%发展为肝细胞癌。我国患病率低于西方国家,约为15%[3],但随着肥胖人群增加与代谢综合征(metabolic syndrome,MS)的流行,患病率呈持续上升趋势,已成为仅次于病毒性肝炎的第二大慢性肝病,给人们日常生活及社会带来极大负担。因此,寻找改善和治疗NAFLD 的药物具有十分重要的意义。
中药厚朴具有消除胸腹满闷、止痛、健胃、止咳、祛除水毒、活血化瘀等作用[4]。和厚朴酚(honokiol,HNK)是中药厚朴中提取纯化的主要有效化学成分,相对分子质量为266,分子式为C18H18O2,其化学结构如图1。属于一种带有烯丙基的连苯二酚类化合物[5]。现代医学研究发现,HNK 具有抗炎[6]、抗衰老[7]、改善胃肠功能紊乱[8]及抗肿瘤[9]等广泛的药理作用,但关于HNK 对灌服高糖高脂乳剂[10]复制的NAFLD 大鼠模型的作用研究尚未见报道。因此,本研究拟用高糖高脂乳剂制备NAFLD 大鼠模型,以中药单体HNK干预,探讨HNK对NAFLD大鼠模型的改善作用。

图1 和厚朴酚化学结构Figure 1 Chemical structure of honokiol
1 材料
1.1 实验动物
SPF级雄性SD大鼠,6周龄,广东省医学实验动物中心提供,生产许可证号:SCⅩK(粤)2018-0002。
1.2 药物及试剂
HNK(广州合诚化学有限公司);辛伐他汀片(杭州默沙东制药有限公司);羧甲基纤维素钠(CMC-Na,天津市大茂化学试剂厂);葡萄糖(广州化学试剂厂);三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、游离脂肪酸(FFA)检测试剂盒(南京建成生物工程研究所);胰岛素(FINS)检测试剂盒[罗氏诊断产品(上海)有限公司]。
1.3 主要仪器
血糖仪及配套试纸[强生(中国)医疗器材有限公司];FA2004B 电子天平(上海精科天美);TC-120智能程控生物组织自动脱水机、TB-718D 生物组织自动包埋机、TB-718生物组织自动包埋机冷台、TK-218Ⅱ型恒温摊片烤片机、TR-180I型生物组织全自动染色机(湖北泰维科技公司);RM2235 石蜡切片机(德国leica公司);BA310正置显微镜及Motic Images Plus 3.0图像采集系统(麦克奥迪)。
2 方法
2.1 药物配制
辛伐他汀片及HNK 用0.5%CMC-Na 混悬后使用。
2.2 动物造模、分组及给药
6 周龄雄性SD 大鼠60 只,适应性饲养3 d,随机选取12 只大鼠作为正常对照组,灌服10 mL/kg生理盐水,其余大鼠灌服等量高糖高脂乳剂复制NAFLD 大鼠模型。2 周后所有动物以乙醚麻醉,静脉采血取血清测定TC 值,按TC 值把造模大鼠随机分成模型对照组、辛伐他汀阳性组(8 mg/kg)及HNK高、低剂量组(200、50 mg/kg)。分组后上午造模给药,下午治疗给药,正常对照组及模型对照组给予等量的0.5%CMC-Na溶液,给药体积为10 mL/kg,连续给药6周,期间所有大鼠给予普通饲料喂养。
2.3 指标观察及测定
2.3.1 一般情况 实验过程中,观察各组大鼠的行为、精神状态、毛发、排泄物等情况。
2.3.2 OGTT 试验 末次给药前各组动物禁食不禁水12 h,尾静脉取血测定空腹血糖(FBG),随即灌服2 g/kg 的葡萄糖,给药体积为10 mL/kg,测定30、60、120 min 时间点的血糖值。以时间点为横坐标,血糖值为纵坐标,绘制曲线,统计分析血糖曲线下面积(AUC)。
2.3.3 血清中生化指标检测 末次给药后各组动物禁食不禁水12 h,麻醉后静脉取血,3 500 r/min 离心15 min 分离血清,测定大鼠血清中TC、TG、HDL-C、LDL-C、FFA 及FINS 含量,计算胰岛素抵抗指数(HOMA-IR),HOMA-IR=FINS×FBG/22.5。
2.3.4 脏器系数 脱臼处死大鼠取肝脏、胰腺,称质量并计算脏器系数,脏器系数=脏器湿质量(g)/体质量(g)×100%
2.3.5 肝组织病理形态学检查 各组动物取相同部位肝组织,用10%(φ)甲醛溶液固定,常规脱水、包埋、切片、苏木精-伊红(HE)染色,于显微镜下观察肝组织中肝细胞脂肪变性程度,小叶炎症及肝细胞气球样变,参照文献[11]评分标准进行NAFLD 活动度积分(non-alcoholic fatty liver disease activity score,NAS)评分。
2.4 统计学处理
以SPSS 22.0 软件进行数据处理,实验数据均用表示,各组均数间比较采用单因素方差分析,P<0.05为差异有统计学意义。
3 结果
3.1 一般情况
实验期间正常对照组大鼠生长活动状态良好,毛色光亮,精力充沛,排泄物未见异常。模型对照组动物精神低迷,毛发蓬乱无光泽,喜团聚蜷卧,大便不成型且气味较臭。辛伐他汀组及HNK 给药组较模型对照组活动状态好,毛色有光泽,仅个别出现行动迟缓,皮毛欠光泽,拉稀便的现象。
3.2 HNK对NAFLD大鼠肝脏的影响
3.2.1 各组大鼠肝脏大体观 正常对照组大鼠肝脏形态正常,色泽鲜红,被膜光滑有弹性,边缘锐利。模型对照组肝脏呈弥漫性肿大、被膜紧绷、土黄色、质脆,边缘钝厚,切面油腻,是典型的脂肪肝病变,肝脏系数显著升高(P<0.01)。与模型对照组相比,HNK 高、低剂量组及辛伐他汀组大鼠肝脏色泽及病变均有明显改善。见表1及图2。
表1 HNK对NAFLD大鼠活动度积分的影响Table1 Effect of HNK on the activity score of rats with nonalcoholic fatty liver(,n=12)

表1 HNK对NAFLD大鼠活动度积分的影响Table1 Effect of HNK on the activity score of rats with nonalcoholic fatty liver(,n=12)
与正常对照组比较:△△P<0.01;与模型对照组比较:*P<0.05,**P<0.01。

图2 和厚朴酚对NAFLD大鼠肝脏的影响(HE,400×)Figure 2 Effects of HNK on liver of rats with nonalcoholic fatty liver disease(HE,400×)
3.2.2 各组大鼠肝组织病理改变 镜下结果显示正常对照组肝小叶结构完整,轮廓清晰可见,肝窦正常,肝索以中央静脉为中心呈放射状整齐排列,肝细胞胞质均匀,呈多边形,无变性;模型对照组肝小叶结构不清,可见淋巴细胞和浆细胞的炎性浸润,细胞核偏移,肝窦数量减少,肝索排列紊乱,肝细胞内有明显大小不等的脂滴空泡;辛伐他汀组及HNK高、低剂量组炎症细胞浸润现象明显减轻,脂肪空泡明显减少,肝细胞脂肪变性明显改善,结果详见图2。表1 统计结果显示:模型对照组的脂肪变、小叶内炎症、气球样变评分及总评分NAS均显著高于正常对照组(P<0.01);NAFLD 模型鼠在给予辛伐他汀及HNK 治疗后,脂肪变、小叶内炎症及气球样变评分均有不同程度的下降(P<0.01 或P<0.05),NAS 评分显著小于模型对照组(P<0.01)。结果表明HNK能改善NAFLD大鼠肝脏的肝细胞损伤。
3.3 HNK对NAFLD大鼠血脂水平的影响
表2结果显示:与正常对照组比较,模型对照组血清中TC、TG、LDL-C、FFA 水平显著性升高(P<0.01);与模型对照组比较,HNK 高、低剂量组血清中TG、FFA 水平显著性下降(P<0.01),HDL-C 显著升高(P<0.01),高剂量HNK 能显著降低血清中TC水平(P<0.05),低剂量HNK 则能有效控制NAFLD大鼠血清中的LDL-C 水平(P<0.01)。表明HNK 对NAFLD大鼠的血脂紊乱有较好的调节效果。
表2 HNK对NAFLD大鼠血脂水平的影响Table 2 Effect of HNK on blood lipid level in NAFLD rats(,n=12)
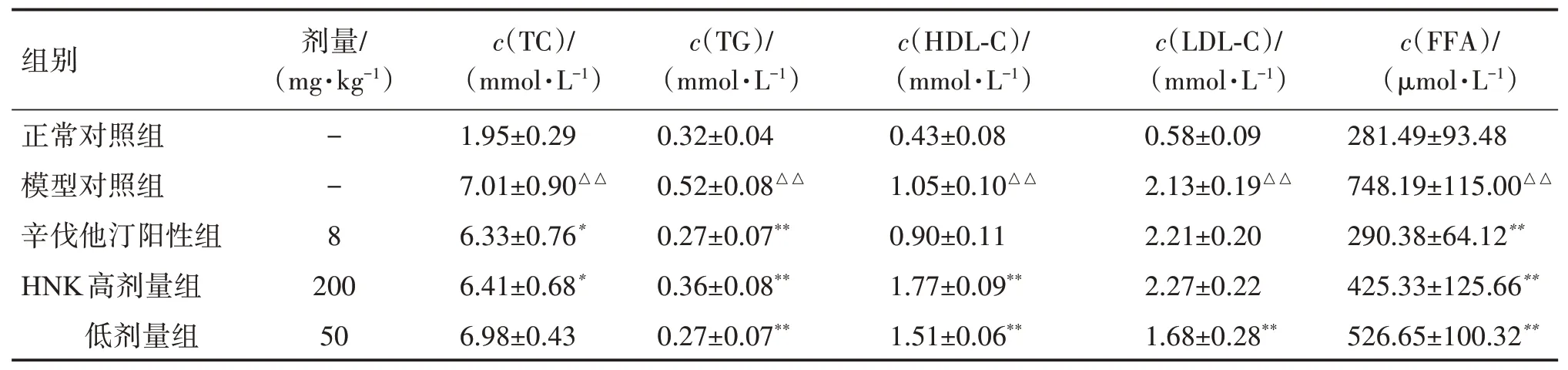
表2 HNK对NAFLD大鼠血脂水平的影响Table 2 Effect of HNK on blood lipid level in NAFLD rats(,n=12)
与正常对照组比较:△△P<0.01;与模型对照组比较:*P<0.05,**P<0.01。
3.4 HNK 对NAFLD 大鼠血糖、血清FINS、HOMAIR的影响
表3 结果显示:模型对照组120 min 血糖水平、AUC 显著性高于正常对照组(P<0.01);与模型对照组比较,HNK 高、低剂量组120 min 时血糖及AUC显著性降低(P<0.01 或P<0.05)。表4 结果显示:与正常对照组比较,模型对照组的胰腺系数、FINS 水平及HOMA-IR 显著性升高(P<0.01);与模型对照组比较,HNK 高、低剂量组的胰腺系数及HOMA-IR显著性下降(P<0.01 或P<0.05)。表明HNK 能改善NAFLD 模型鼠因胰腺炎及胰腺中脂肪的蓄积引起的胰腺肥大,增加口服糖耐量,减轻胰岛素抵抗。
表3 HNK对NAFLD大鼠血糖的影响Table 3 Effect of HNK on blood glucose in NAFLD rats(,n=12)

表3 HNK对NAFLD大鼠血糖的影响Table 3 Effect of HNK on blood glucose in NAFLD rats(,n=12)
与正常对照组比较:△△P<0.01;与模型对照组比较:*P<0.05,**P<0.01。
表4 HNK对NAFLD大鼠FINS水平和HOMA-IR 指数的影响Table 4 Effect of HNK on FINS level and HOMA-IR index in rats with nonalcoholic fatty liver disease(,n=12)
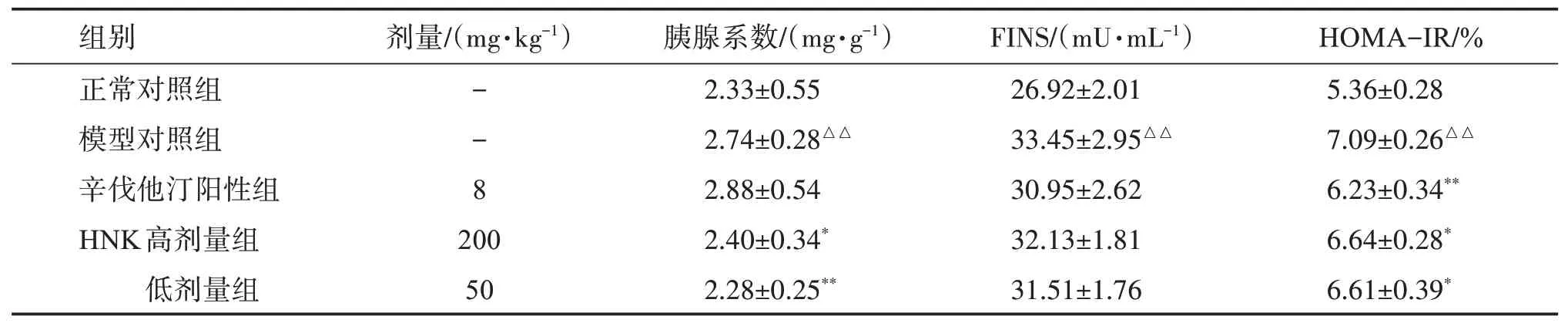
表4 HNK对NAFLD大鼠FINS水平和HOMA-IR 指数的影响Table 4 Effect of HNK on FINS level and HOMA-IR index in rats with nonalcoholic fatty liver disease(,n=12)
与正常对照组比较:△△P<0.01;与模型对照组比较:*P<0.05,**P<0.01。
4 讨论
NAFLD 属于一种具有高发病率的代谢紊乱性疾病,是最常见的肝脏疾病之一,其发病是一个多因素、多环节相互作用的过程。目前NAFLD的确切发病机制仍未被阐明,缺乏明确、系统的药物治疗策略,因此治疗NAFLD的药物研发依然任重而道远。
糖脂代谢紊乱包括胰岛素抵抗(IR)、糖耐量异常和脂质代谢改变,被认为是NAFLD 分子发病机制[12-13]。当机体饮食过度导致营养过剩时,脂质转录因子包括碳水化合物反应元件结合蛋白(ChREBP)以及甾醇调节元件结合蛋白-1c(SREBP-1c)上调,导致脂肪生成基因的表达增加,乙酰辅酶a 羧化酶(ACC)升高,促进新生脂肪生成(NDL),抑制肝内脂肪酸氧化作用来驱动脂肪变性[14]。1998年Day和Jame[15]提出的“二次打击”学说机制也认为高脂饮食患者由于摄入过量脂肪,引起血浆中游离的脂肪酸增加,导致胰岛素抵抗,当机体产生胰岛素抵抗时,其血液中的TG、LDL-C、极低密度脂蛋白胆固醇都会发生明显升高[16],进而产生脂质代谢紊乱。肝脏积聚了大量脂肪后,脂质会因为肝内自由基生成增多而过氧化,肝细胞也因此而凋亡、坏死,最终演变成脂肪性肝炎、肝细胞坏死、肝纤维化甚至肝硬化和肝癌。本研究结果表明,8 周高糖高脂乳剂诱导的NAFLD 大鼠血脂水平,肝脏、胰腺系数,AUC,血清FINS 含量及HOMA-IR 均显著升高并出现典型的脂肪肝病样变,与李易水等[17]所制备的高脂饮食的动物模型血脂水平、病理病变吻合。HNK 干预后,能降低血清TG、TC、LDL-C 及FFA,升高HDL-C,脂肪肝病样变明显改善,120 min 的血糖几乎能恢复到初始血糖,表明HNK能调节血脂紊乱,有效对抗高糖高脂乳剂引起的肝脏损伤,改善葡萄糖调节受损和胰岛素抵抗。
HNK 是一种安全、有效的强抗氧化剂[18],并有很好的抗炎效果[8-19]。高脂饮食的大鼠肝脏中过氧化产物丙二醛(MDA)升高,超氧化物歧化酶(SOD)水平降低,氧化应激增加,抗氧化能力下降[20],血清或肝脏中IL-1β、IL-6、IL-18、TNF-α等细胞因子亦会显著增加[21-23]。因此,笔者认为HNK 可能抑制了NAFLD 模型大鼠机体内乳酸脱氢酶(HDL)和转氨酶的释放,有效控制肝细胞死亡和脂质过氧化,产生较高活性氧并消耗细胞内的谷胱甘肽,同时减少了促炎症因子TNF-α及脂肪细胞因子FFA 的产生,从而起到肝脏细胞保护的作用。
综上所述,HNK 对NAFLD 大鼠模型有调节血脂紊乱、改善肝脏损伤及胰岛素抵抗的作用,但HNK对NAFLD大鼠模型的改善作用是一个多因素参与的复杂过程,其具体的作用机制有待更深入的探究。本研究为应用HNK 治疗NAFLD 提供了实验依据。

