枣瘿蚊图尔病毒(DjTV-2a)PCR检测方法的建立
贺鹏鹏 马光皇 刘语涵 张来斌 肖海兵 杨明禄


摘 要:為了建立枣瘿蚊图尔病毒(DjTV-2a)的 PCR 检测方法,通过提取枣瘿蚊总基因组 DNA 和设计 DiTV-2a 特异性引物,以DNA模板(80,100,120 ng),引物浓度(0.7,0.8,0.9 μmol·L-1),dNTP(0.2,0.3,0.4 mmol·L-1),Taq酶(1.25,1.35,1.45 U)为变量,采用正交设计筛选最佳 PCR 反应体系,建立与优化 DjTV-2a 的 PCR 检测方法。结果表明:正交设计的9组 PCR 反应体系均能够扩增和检测该病毒,且DNA模板100 ng,引物0.7 μmol·L-1,dNTPs 0.4 mmol·L-1和Taq酶 1.35U反应体系扩增效果最佳;对最佳 PCR 反应体系进行退火温度(46,48,50,52,54,56 ℃)优化,发现52 ℃为引物最佳退火温度。综上分析,在 50 μL 反应体系下,引物退火温度为52 ℃,模板 DNA 量100 ng,引物0.7 μmol·L-1,dNTPs 0.4 mmol·L-1,Taq酶 1.35 U是 DiTV-2a 的最佳PCR扩增体系,可用于该病毒的检测。
关键词:枣瘿蚊;枣瘿蚊图尔病毒;PCR
中图分类号:S476 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2021.11.018
Establishment of PCR Method for Detection of Dasineura jujubifolia Toursvirus 2 (DjTV-2a)
HE Pengpeng1,2, MA Guanghuang1,2, LIU Yuhan1,2, ZHANG Laibing1,2, XIAO Haibing1,2,3, YANG Minglu1,2,3
(1.College of Plant Science, Tarim University, Alar, Xijiang 843300, China; 2.Southern Xinjiang Key Laboratory of IPM of Tarim University, Alar, Xijiang 843300, China; 3.Scientific Observing and Experimental Station of Crop Pests in Alar.Ministry of Agriculture, Alar, Xinjiang 843300, China)
Abstract:To establish a PCR detection method for Dasineura jujubifolia toursvirus 2 (DjTV-2a), the experiment extracted the total genomic DNA of Dasineura jujubifolia, designed DiTV-2a specific primers, the DNA template (80, 100, 120 ng) and the primer concentration (0.7, 0.8, 0.9 μmol·L-1), dNTP (0.2, 0.3, 0.4 mmol·L-1) and Taq enzyme (1.25, 1.35, 1.45 U) were as variables, screening the optimum PCR reaction system to establish and optimize the PCR detection method of DjTV-2a by the orthogonal design. The results showed that all the nine group of PCR reaction systems from the orthogonal design could amplify and detect the virus, but the reaction system of 100 ng DNA template, 0.7 μmol·L-1 primers, 0.4 mmol·L-1 dNTPs and 1.35U Taq enzyme had the best amplification effect. For the best PCR reaction system, the optimum annealing temperature of the primers were 52 ℃ in the six treatment including 46, 48, 50, 52, 54, 56 ℃. In summary, in a 50 μL reaction system, 52 ℃ primer annealing temperature, 100 ng DNA template, 0.7 μmol·L-1 primer, 0.4 mmol·L-1 dNTPs and 1.35 U Taq enzyme is the optimum PCR amplification system for DiTV-2a which can be used for the detection of the virus.
Key words: Dasineura jujubifolia; Dasineura jujubifolia toursvirus 2(DjTV-2a) ; PCR
枣瘿蚊(Dasineura jujubifolia)又名枣叶瘿蚊[1],广泛分布于我国枣产区。该虫1966年首次于山东地区发现并报道,鉴定为 Contarinia Sp.[2];也有 Contarinia datifolia Jiang和Dasineura datifolia 等名称被使用[3-6]。随着新疆红枣产业的发展,枣瘿蚊在新疆红枣产区为害猖獗[7-8],连年造成红枣座果率下降、产果品质下跌的严重影响,导致果农损失严重[9]。课题组在研究枣瘿蚊线粒体基因组时,发现了一种双链环状昆虫病毒基因组,经进一步鉴定为枣瘿蚊图尔病毒2(Dasineura jujubifolia toursvirus 2,DjTV-2a)[10],这种病毒是是囊泡病毒科图尔病毒属的第二位成员和该科唯一寄生双翅目昆虫的种类,可能是枣瘿蚊的重要天敌之一,对枣瘿蚊为害扩散起到抑制作用。一般认为它们在田间常由寄生蜂传播[11],因此研究其分布范围及寄主媒介有重要意义,但枣瘿蚊幼虫感染后症状不明显,从表观上很难进行区分,所以建立分子检测方法十分必要。
本研究拟通过设计特异性引物和优化反应体系以建立 DjTV-2a 的 PCR 检测方法,为进一步开展 DjTV-2a 相关研究提供技术支持。
1 材料和方法
1.1 试虫
枣瘿蚊幼虫采自塔里木大学枣园,十二团十一连枣园,阿克苏市新和县,哈密市,张掖市。
1.2 试剂与仪器
TBE 缓冲液(实验室配制);琼脂糖(BIOWEST);10×PCR buffer、Taq 酶、DNA Marker(康为世纪);柱式 DNA 提取试剂盒(生工生物工程股份有限公司)等。
1.3 仪器
基因扩增仪( BSW-6T-II 上海启步生物科技有限公司);紫外凝胶成像仪( Gel Doc XR+上海旦鼎国际贸易有限公司);高速离心机( PICO21 Thermo Fisher);高通量组织研磨器(SCIENTZ-48宁波新芝生物科技股份有限公司);电泳仪(DYCP-32B北京六一生物科技有限公司);電热恒温水浴锅(DK-80上海精宏实验设备有限公司)等。
1.4 试验方法
1.4.1 DNA提取 鉴于枣瘿蚊虫体较小,本试验采取两种 DNA 提取方法。PCR 缓冲液提取法[12]:取3头病虫分别放入标记好的3个1.5 mL EP 离心管中,加入10 μL PCR缓冲液,放置于 20 ℃ 冷冻2~3 min后,用移液枪枪头研磨匀浆;研磨结束后再次加入40 μL PCR缓冲液和3 μL蛋白酶K,以上操作均需在冰上进行。涡旋振荡使样品混匀后,将离心管置于水浴锅中,56 ℃ 水浴 2 h 后(水浴期间多次翻转离心管),95 ℃ 水浴5 min,水浴结束后以5 000 r·min-1离心10 min,-20 ℃保存备用。试剂盒提取法:取同样头数试虫分别进行 DNA 提取,根据试剂盒说明进行。
1.4.2 DNA检测 使用微量核酸检测仪分别检测提取的核酸质量和浓度,并进行琼脂糖凝胶电泳检测。
1.4.3 引物设计 使用primer 5根据 DjTV-2a 病毒衣壳蛋白(Capsid protein,CP)基因序列设计特异性引物,引物由生工生物工程(上海)股份有限公司合成,预计扩增 DNA 片段长度为 396 bp,引物序列:上游引物(F)5-AGCACTTCCACACACTGAGA-3,下游引物(R)5-AGTACTAGCAAAATGTCCACCA-3。
1.4.4 PCR反应体系优化 使用提取的枣瘿蚊图尔病毒 DNA 为模板,对 DNA 模板用量、引物浓度、dNTP 浓度、Taq 酶用量4个因素进行正交试验。
PCR反应程序:预变性95 ℃ 3 min;变性95 ℃ 30 s、退火54 ℃ 30 s、延伸72 ℃ 30 s,35个循环;后延伸72 ℃ 3 min。
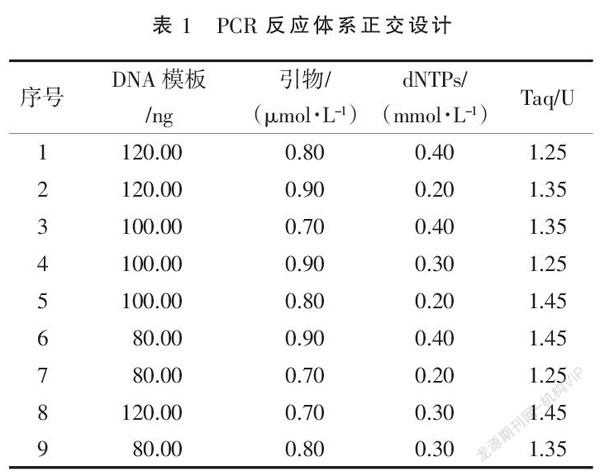
1.4.5 PCR反应体系设计 反应体系采用L9(34)正交设计(表1),对dNTP和模板等用量进行优化,每组重复3次。
1.4.6 退火温度优化 以期获得最佳反应体系,针对引物退火温度进行筛选,根据引物 Tm 值,设置退火温度46~56 ℃,设置梯度为46,48,50,52,54,56 ℃。
1.4.7 灵敏度检测 将所使用 DNA 模板按梯度稀释:5,52,53,54,55倍,后进行凝胶电泳检测。
1.4.8 琼脂糖凝胶电泳及测序 取 PCR 产物、DNA Marker 5 μL混合上样液 1 μL 加入到点样孔中,于 2% 琼脂糖凝胶100 V 30 min进行电泳;电泳结果于凝胶成像系统中观察并保存。将条带单一、清晰的 PCR 产物送往上海生工测序。
1.5 数据分析
测序序列在 NCBI 进行 Blast 分析,根据 PCR 扩增产物电泳条带位置、数量及弥散情况等进行检测方法分析。
1.6 PCR检测方法的应用
使用上述完善的PCR检测体系,对塔里木大学枣园,十二团十一连枣园,阿克苏市新和县,哈密市,张掖市虫样进行PCR检测。
2 结果与分析
2.1 DNA提取方法
PCR缓冲液提取法与试剂盒提取法的电泳结果详见图1。PCR 缓冲液提取法所测得的核酸浓度分别是7.5,10.3,8.6 ng·μL-1,A260/A280值在2.0左右;试剂盒提取测得的核酸浓度分别是47.9,60.7,56.3 ng·μL-1,A260/A280值在1.8左右,经凝胶电泳检测条带清晰。因此,本试验采用试剂盒提取方法。
2.2 PCR扩增及序列分析
PCR 扩增目标产物为396 bp,电泳图谱显示位置正确(图2),经 NCBI 数据库 Blast分析发现与 DjTV-2a 病毒衣壳蛋白(Capsid protein,CP)基因相似度100%,引物特异性较好。
2.3 正交设计结果
正交设计的9组扩增结果(图2)差异显著,不同试验体系中不同组分对实验结果得影响各不相同,试验中引物用量对结果影响较大,表现在不同扩增条带的差异;其中第3组结果所得条带最为清晰,第7组结果所得条带则显示不明显;确定最优体系为:模板100 ng,10×PCR buffer 5 μL,引物0.70 μmol·L-1,dNTPs 0.40 mmol·L-1,Taq酶 1.35 U。
2.4 退火温度
由图3得知,随着引物退火温度的改变,PCR产物条带差异明显,在退火温度在46~56 ℃电泳条带可见,但在52 ℃(10-12泳道)所得条带最为清晰明亮,稳定性最好,没有出现引物二聚体和条带弥散的现象,因此在优化体系中选择52 ℃为最佳退火温度。2.5 灵敏度检测
对模板DNA进行不同浓度的稀释,发现随着稀释条带亮度下降,由图得知当稀释倍数达到54时,扩增条带呈现不清晰,但仍能看到相应条带(图4)。2.6 優化体系检验
利用上述所获得的优化体系进行PCR扩增,结果(图5)得到清晰稳定的扩增条带,说明优化体系在 50 μL 反应体系下,10×PCR buffer 5 μL,引物最佳退火温度为52 ℃,模板 DNA 量100 ng,引物0.7 μmol·L-1,dNTPs 0.4 mmol·L-1,Taq酶 1.35U稳定,适合作为PCR检测枣瘿蚊图尔病毒的方法;并将产物送检测序,序列结果与该病毒基因序列一致。
2.7 检测结果
使用优化后的PCR反应条件,对各个采集地点和塔里木大学不同采集月份的虫样进行检测,发现:此病毒在塔里木大学和十二团均有发现,且塔里木大学校园内检测阳性率达到10.15%,其余地域暂时没有病毒流行(表2);此病毒6月份开始发生,7月份在塔里木大学枣园内大流行,此时检测阳性率为10.5%(表3)。
3 结论与讨论
PCR反应体系中,模板DNA的质量是后续试验的关键[13],本研究用PCR缓冲液法和试剂盒提取法进行比较,在检测后发现试剂盒提取法所得核酸含量较高。PCR缓冲液法提取DNA缺少漂洗和除杂的过程,经检测OD值也不理想,可能杂质较高没考虑作为优化体系模板使用,而试剂盒法有蛋白质、其他杂质的的分离过程,没有有机物污染,获得基因组DNA质量较高[14],通常模板用量过高条带可能出现拖尾,用量过低,扩增条带则会不清晰[15-18],而且模板DNA若是杂质过多,则会影响Taq酶的活性,引物用量过高或设计原因会产生二聚体和非特异性扩增,而引物用量过低,则会产生扩增产物减少等现象[19-20]。通过PCR试剂组分正交设计与反应条件优化,引物0.70 μmol·L-1,dNTPs 0.4 mmol·L-1,Taq酶 1.35 U的50 μL反应体系和52 ℃退火温度扩增效果较好。
经过对采集地和塔里木大学内不同采集月份的虫样进行检测,发现塔里木大学内虫样阳性率最高,周边团场次之,继续对塔里木大学内不同月份虫样进行检测后,发现6月有病毒流行迹象,7月是此病毒大发生的时期,猜测这可能与寄生蜂的出现有关,6月份伴随枣瘿蚊寄生蜂的出现也加速此病毒的传播速度与传播范围。
此病毒具有枣瘿蚊生物防治的应用潜力,因此该PCR检测方法用于后续枣瘿蚊图尔病毒种群分布及媒介寄主鉴定等研究工作,对揭示其传播生物学具有重要意义。
参考文献:
[1] JIAO K L, HAN P J, YANG M L, et al. A new species of gall midge (Diptera: Cecidomyiidae) attacking jujube, Ziziphus jujuba in China[J]. Zootaxa, 2017, 4247(4): 487-493.
[2] 章宗江. 枣树的一种新害虫——枣瘿蚊的研究[J]. 山东农业科学, 1966(2): 51-54.
[3] 袁青锋, 周运刚, 郑新疆, 等. 4种杀虫剂防控红枣枣瘿蚊效果比较[J]. 中国植保导刊, 2015, 35(12): 58-59.
[4] 张仁福, 于江南, 斯迪克·米吉提, 等. 枣瘿蚊幼虫空间分布型及抽样技术研究[J]. 新疆农业大学学报, 2010, 33(1): 23-26.
[5] 卜文俊. 中国瘿蚊科(双翅目)昆虫分类研究[D]. 天津: 南开大学, 1990.
[6] 江兴培. 中国瘿蚊科分类初步研究[D]. 重庆: 西南农业大学, 1990.
[7] 訾莉莉. 阿拉尔垦区枣树“两虫一病”的防治研究[D]. 阿拉尔: 塔里木大学, 2018.
[8] 许瑛. 阿拉尔市枣园4种病虫害发生动态及黑斑病对果实品质的影响[D]. 石河子: 石河子大学, 2017.
[9] 毕海燕, 朱晓锋, 阿布都克尤木·卡德尔, 等. 不同药剂对枣瘿蚊的防治效果评价[J]. 新疆农业科学, 2014, 51(5): 915-919.
[10] WANG J, YANG M, XIAO H, et al. Genome analysis of Dasineura jujubifolia toursvirus 2, a novel ascovirus[J]. Virologica Sinica, 2020, 35(2): 134-142.
[11] ARAI E, ISHII K, ISHII H, et al. An ascovirus isolated from Spodoptera litura (Noctuidae: Lepidoptera) transmitted by the generalist endoparasitoid Meteorus pulchricornis (Braconidae: Hymenoptera)[J]. The Journal of General Virology, 2018, 99(4): 574-584.
[12] 宋月, 樊永亮, 武丽娟, 等. 蚜虫内共生菌基因组DNA提取方法的比较和优化[J]. 植物保护学报, 2014, 41(6): 643-648.
[13] 高丽云, 陈杰, 胡小龙, 等. 金铁锁SSR-PCR反应体系的建立与优化[J]. 云南农业大学学报:自然科学, 2019, 34(6): 1024-1032.
[14] 萨姆布鲁克 J, 拉塞尔 DW. 分子克隆实验指南[M]. 黄培堂, 译. 3版. 北京: 科学出版社, 2002.
[15] 王梅, 赵晨迪, 胡忠良, 等. CYP2C19基因多态性PCR扩增体系的正交优化与验证[J]. 基因组学与应用生物学, 2019, 38(5): 1990-1996.
[16] 谢家楠, 郭建军, 金道超. 白背飞虱ISSR-PCR反应体系构建的正交设计优化[J]. 植物保护, 2014, 40(2): 109-112.
[17] 刘永刚, 漆永红, 赵丽娟, 等. 桃蚜基因组DNA提取及SSR反应体系优化和应用[J]. 植物保护, 2009, 35(4): 96-100.
[18] 张敏哲, 庞保平, 周晓榕, 等. 宽翅曲背蝗SSR反应体系的优化[J]. 内蒙古农业大学学报(自然科学版), 2013, 34(3): 26-31.
[19] 徐显异, 陆婷, 田嘉, 等. 橡胶草及其近缘种ISSR反应体系及扩增程序的优化[J]. 分子植物育种, 2019, 17(12): 4007-4015.
[20] 贾新平, 孙晓波, 梁丽建, 等. 二月兰SSR-PCR反应体系的优化及引物筛选[J]. 中国农学通报, 2017, 33(5): 40-46.
收稿日期:2021-08-04
基金项目:兵团财政科技计划资助(2020DA003,2019DA001));塔里木大学研究生科研创新项目(TDGRI202019)
作者简介:贺鹏鹏(1995—),男,河南商丘人,在读硕士生,主要從事农业昆虫与害虫防治方面研究。
通讯作者简介:杨明禄(1976—),男,山东夏津人,教授,主要从事农业昆虫与害虫防治方面研究。

