次氯酸消毒液对猪源病原体的消杀效果
肖琦 赵霞玲 钱雯娴 朱家平 张冯禧 尹力鸿 温立斌 何孔旺
摘要:为评价次氯酸消毒液(以下简称消毒液)对猪源病原体的消杀作用,以猪场常见的5种病原菌和5种病毒为研究对象,测试消毒液在不同浓度和不同作用时间下的消杀效果。悬液定量杀菌试验结果表明,消毒液原液(次氯酸含量为210 mg/L)和1 ∶2倍稀释消毒液(次氯酸含量为105 mg/L),作用30 s即可杀灭猪链球菌2型(SS2)、猪传染性胸膜肺炎放线杆菌(APP)、副猪嗜血杆菌(HPS)、猪丹毒杆菌(ER)和猪大肠杆菌(ETEC);1 ∶4倍稀释消毒液(次氯酸含量为52.5 mg/L)作用1 min能杀灭HPS、ER和ETEC,作用5 min能杀灭SS2和APP,杀灭对数值均>7.00,杀灭率均为100%。病毒灭活试验结果表明,消毒液原液作用1 min对猪流行性腹泻病毒(PEDV)、猪细小病毒(PPV)的平均灭活对数值均≥5.00,杀灭率均≥99.999%;1 ∶2倍稀释消毒液作用1 min对PEDV的平均灭活对数值为4.00、杀灭率为99.990%;消毒液原液作用5 min和10 min,对猪繁殖与呼吸综合征病毒(PRRSV)的杀灭率为99.899%,对猪伪狂犬病病毒(PRV)的杀滅率为92.921%,对猪圆环病毒2型(PCV2)的杀灭率为90.00%。表明次氯酸消毒液在推荐浓度下对猪场常见病原菌有快速高效的消杀效果,对PEDV和PPV等病毒亦有良好的消杀作用。
关键词:次氯酸;猪;细菌;病毒;消毒
中图分类号:S855.99 文献标志码: A
文章编号:1002-1302(2021)21-0170-04
收稿日期:2021-05-15
基金项目:江苏现代农业(生猪)产业技术体系生物安全创新团队(编号:JATS[2020]382);江苏省农业重大技术协同推广计划(编号:2019-SJ-009-04-01)。
作者简介:肖 琦(1980—),女,辽宁丹东人,博士,助理研究员,主要从事猪病与人兽共患病防控研究。E-mail:xiaoqi_2122@163.com。
通信作者:何孔旺,硕士,研究员,主要从事猪病与人兽共患病防控研究。E-mail:kwh2003@263.net。
消毒是猪场重要的生物安全措施之一。猪场常用的消毒方法有物理消毒法、化学消毒法和生物消毒法等,其中化学消毒法最为常用[1]。化学消毒剂的正确选择和使用是决定猪场消毒效果的关键。含氯类消毒剂是一种高效消毒剂,对细菌和病毒有强大的杀灭作用[2]。临床常用的含氯消毒剂包括次氯酸钠(如84消毒液)、次氯酸钙(漂白粉)、二氯异氰尿酸钠、三氯异氰尿酸钠等[3]。次氯酸消毒液是一种新型的含氯消毒剂,不仅具有广谱抗菌、杀菌效率高的特点,而且具有腐蚀性小、极少刺激性气味、高安全性、不污染环境等优点[4-5],有望替代刺激性较强的次氯酸钠、二氯异氰尿酸钠等传统含氯消毒剂。高晓东等使用次氯酸消毒液对社区及医院内皮肤软组织感染的病原体杀灭率进行了检测,发现其对革兰阳性菌、革兰阴性菌、真菌、分枝杆菌和厌氧菌均能达到7个lg值的杀灭率[6]。刘文等在规模化猪舍内用次氯酸消毒液(微酸性电解水,有效氯浓度为90 mg/L)喷雾消毒,可有效减少空气中金黄色葡萄球菌的数量,消毒后的猪舍内空气微生物在3 d内能维持较低的水平[7]。但目前次氯酸消毒液在猪场的使用还不广泛,也缺乏次氯酸消毒液对猪源病原菌和病毒杀灭效果的相关研究。本试验以次氯酸含量为210 mg/L的消毒液为研究对象,在试验条件下研究其对猪场常见的猪链球菌2型(SS2)、猪传染性胸膜肺炎放线杆菌5型(APP5)、副猪嗜血杆菌4型(HPS4)、猪丹毒杆菌(ER)、猪大肠杆菌(ETEC)等5种病原菌和猪圆环病毒2型(PCV2)、猪伪狂犬病毒(PRV)、猪流行性腹泻病毒(PEDV)、猪细小病毒(PPV)、猪繁殖与呼吸综合征病毒(PRRSV)等5种病毒的杀灭作用,为猪场消毒剂的选择和使用提供参考依据。
1 材料与方法
1.1 次氯酸消毒液
易凯欧次氯酸消毒液(以下简称消毒液)由鹤鸣(上海)环境科技有限公司生产并提供,生产日期为2020年9月6日,次氯酸含量为210 mg/L,pH值为6.2。
1.2 菌株、毒株及细胞
猪链球菌2型ZY05株(SS2 ZY05株)、猪传染性胸膜肺炎放线杆菌5型KL株(APP5 KL株)、副猪嗜血杆菌4型JS株(HPS4 JS株)、猪丹毒杆菌ES株(ER ES株)、猪大肠杆菌O139株(ETEC O139株)、猪圆环病毒2型P58株(PCV2 P58株)、猪伪狂犬病毒B株(PRV B株)、猪流行性腹泻病毒JS2012株(PEDV JS2012株)、猪细小病毒BJ株(PPV BJ株)以及PK15细胞、Marc145细胞、ST细胞、Vero细胞,均由江苏省农业科学院兽医研究所保存;猪繁殖与呼吸综合征病毒疫苗毒GDr180株(PRRSV GDr180株)由广东永顺生物制药股份有限公司提供。
1.3 主要试剂
Todd Hewitt肉汤(THB)培养基购自美国BD公司,THB培养基、THB+0.01%NAD培养基、THB+0.01%NAD+5%小牛血清培养基、THB+5%小牛血清培养基、LB培养基按照配方配制;高糖DMEM培养液、胰酶购自Gibico公司;新生牛血清购自浙江天杭生物科技股份有限公司;Champagne Taq DNA Polymerase、2×AceQ qPCR Probe Master Mix、Green Taq Mix购自南京诺唯赞生物科技有限公司;Premix Ex Taq(Probe qPCR)购自宝生物工程(大连)有限公司;HiPure Total RNA Mini Kit 总RNA小提试剂盒(双柱型)、HiPure Universal DNA Kit 通用型DNA抽提试剂盒购自广州美基生物科技有限公司;硫代硫酸钠购自上海源叶生物科技有限公司,用无菌ddH2O将硫代硫酸钠配制成终浓度为10.5%的中和剂原液,用0.22 μm的滤膜过滤,备用。
1.4 悬液定量杀菌试验
试验在室温下进行,所有液体使用前恢复至室温。参照文献[8-9]设计试验。每组重复3次,取平均值。
1.4.1 菌种复苏 取50 μL冻存菌液,接种到 5 mL 液体培养基中,置于37 ℃ 200 r/min培养至对数生长期,进行菌液计数。
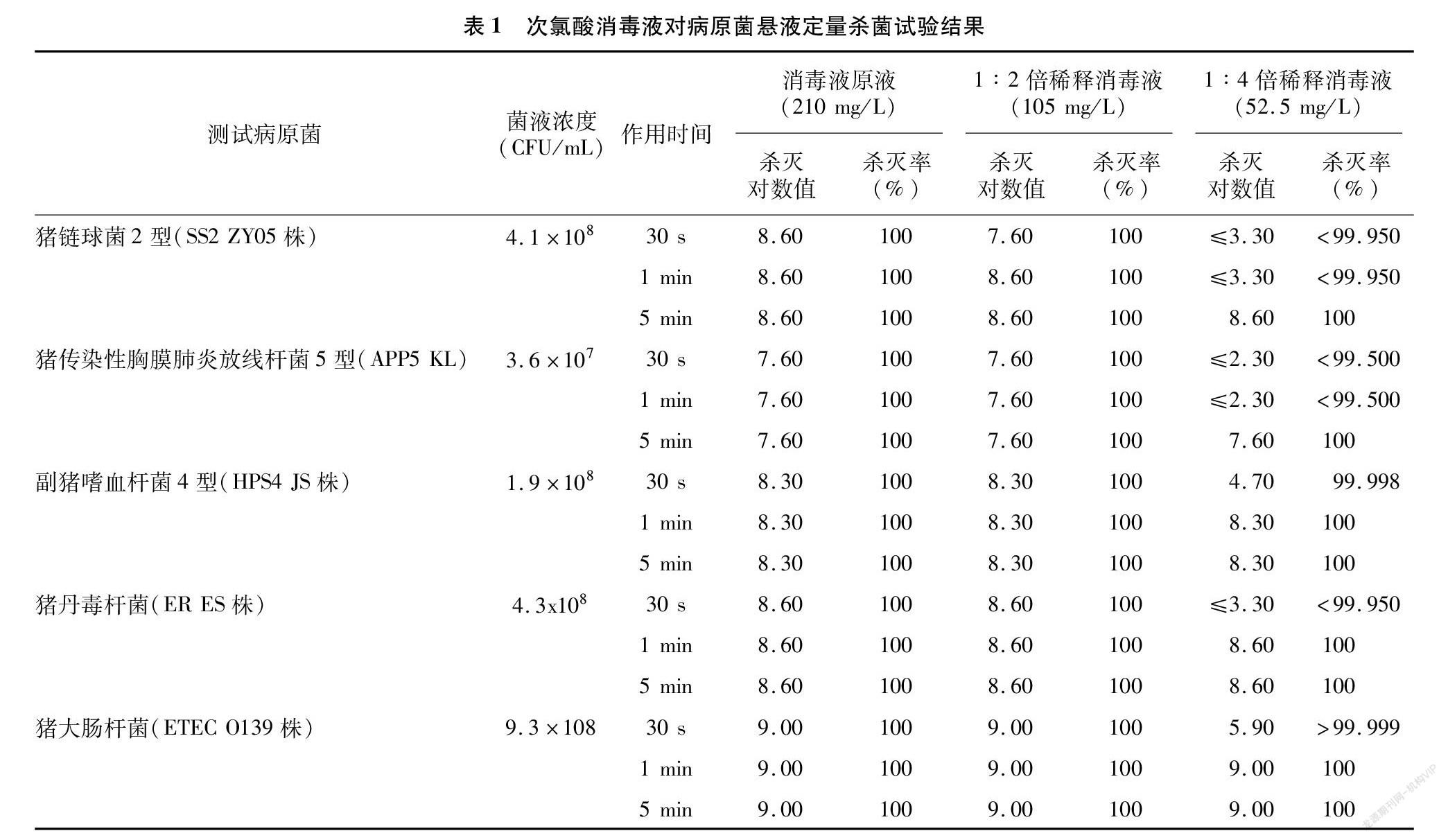
1.4.2 试验组 每种受试菌共设9个消毒液+菌悬液的试验组。1~3组为消毒液原液,4~6组为用无菌ddH2O进行1 ∶2倍稀释的消毒液,7~9组为用无菌ddH2O进行1 ∶4倍稀释的消毒液,每组取消毒液4.5 mL,加入0.5 mL菌液,在混匀仪上混匀,作用一定时间后(1、4、7组作用30 s,2、5、8组作用1 min,3、6、9组作用5 min),加入250 μL中和剂原液,使中和剂的终浓度为0.5%,混匀,作用 10 min 后,菌液计数。
1.4.3 对照组 共设4个对照组。稀释液+菌悬液对照组(阳性对照):取无菌ddH2O 4.5 mL,加入0.5 mL菌液,作用5 min后,加入250 μL无菌ddH2O,作用10 min后,菌液计数。
中和剂+菌悬液对照组:取无菌ddH2O 4.5 mL,加入0.5 mL菌液,作用5 min后,加入 250 μL 中和剂原液,混匀,作用10 min后,菌液计数。
(消毒液+中和剂)+菌悬液对照组:取消毒液原液4.5 mL,加入0.5 mL无菌ddH2O,加入250 μL中和剂原液,混匀,作用10 min后,加入0.5 mL菌悬液,作用5 min后,菌液计数。
稀释液+中和剂+培养基对照组(阴性对照):取无菌ddH2O 4.5 mL,加入0.5 mL培养基,加入250 μL中和剂原液,作用10 min后,菌液计数。
1.5 病毒灭活试验
试验在室温下进行,所有液体使用前恢复至室温。参照文献[8]设计试验。每组重复3次,取平均值。
1.5.1 病毒培养 将PCV2、PRV、PEDV、PPV、PRRSV毒株分别在PK15细胞、ST细胞、Vero细胞、PK15细胞、Marc145细胞上培养,并测定各毒株的TCID50。
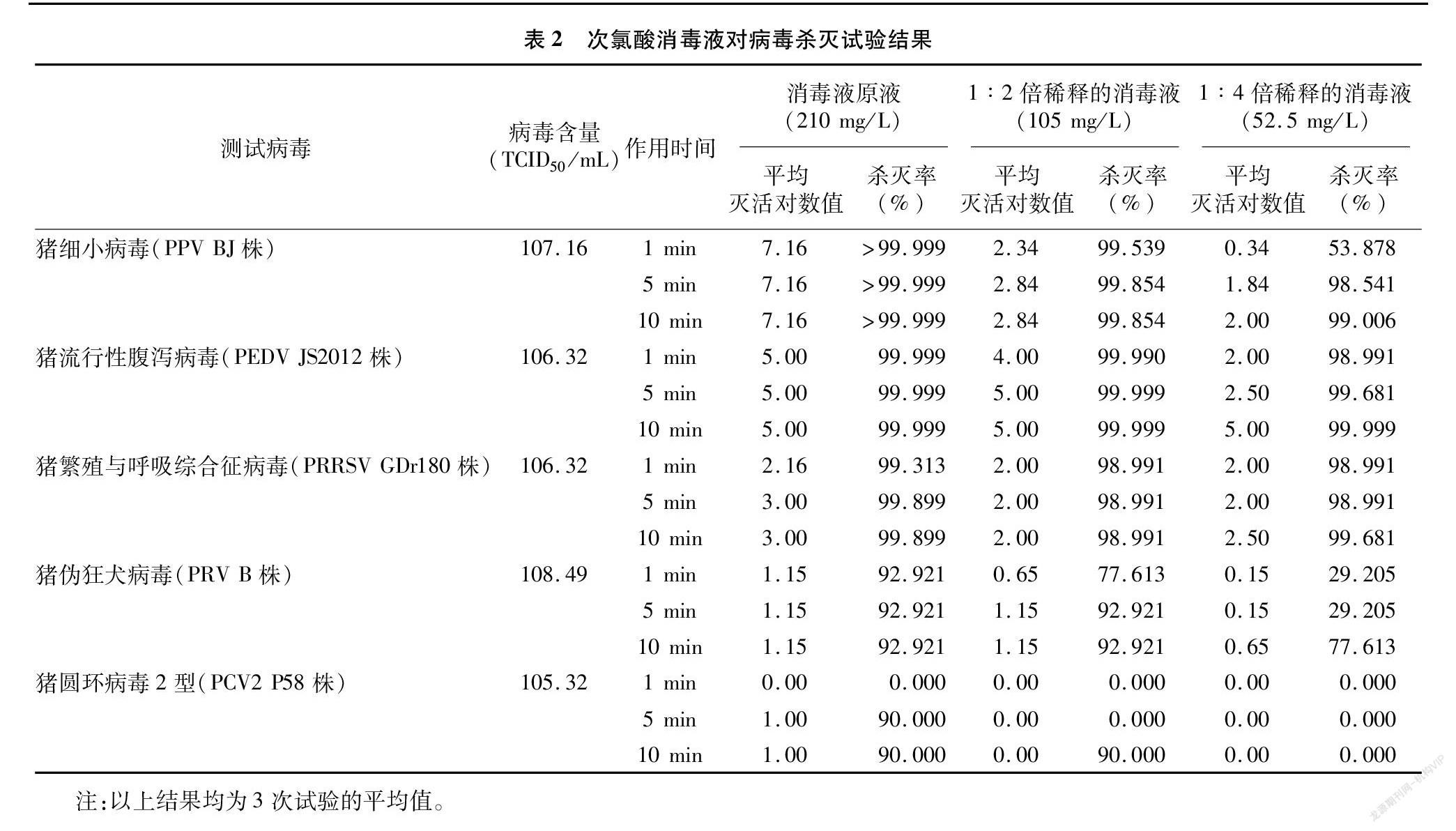
1.5.2 试验组 每种病毒共设9个试验组。1~3组使用消毒液原液,4~6组使用用无血清高糖DMEM培养液进行1 ∶2倍稀释的消毒液,7~9组使用用无血清高糖DMEM培养液进行1 ∶4倍稀释的消毒液,每组取消毒液40 μL,加入40 μL病毒原液,在混匀仪上混匀,作用一定的时间后(1、4、7组作用1 min,2、5、8组作用5 min,3、6、9组作用 10 min),迅速加入9倍体积(720 μL)病毒培养液,作为10-1稀释组,然后用病毒培养液依次做10倍倍比稀释,每个稀释度接种96孔细胞培养板中的4个孔,每孔150 μL,置于37 ℃ 5% CO2培养箱中静置培养,测TCID50。
1.5.3 对照组 共设3个对照组。
病毒对照组(阳性对照):取40 μL病毒培养液,加入40 μL病毒原液,加入9倍体积(720 μL)病毒培养液,作为10-1稀释组,然后用病毒培养液依次做10倍倍比稀释,每个稀释度接种96孔细胞培养板中的4个孔,每孔150 μL,置于37 ℃ 5% CO2培养箱中静置培养,测TCID50。
消毒液对照组:取消毒液原液40 μL,加入 40 μL 病毒培养液,加入9倍体积(720 μL)病毒培养液,接种96孔细胞培养板中的4个孔,每孔 150 μL,置于37 ℃ 5% CO2培养箱中静置培养。
空白细胞对照组(阴性对照):验证不接毒细胞是否可以正常生长。未接种病毒的细胞,在含有2%小牛血清的高糖DMEM细胞培养液中培養。
2 结果与分析
2.1 悬液定量杀菌试验
由表1可见,消毒液原液(次氯酸含量为 210 mg/L)和1 ∶2倍稀释消毒液(次氯酸含量为 105 mg/L),作用30 s、1 min、5 min,对SS2 ZY05株、APP5 KL株、HPS4 JS株、ER ES株和ETEC O139株的杀灭对数值均>7.00,杀灭率均为100%;1 ∶4倍稀释消毒液(次氯酸含量为52.5 mg/L)作用 1 min 对HPS4 JS株、ER ES株和ETEC O139株,作用 5 min 对SS2ZY05株和APP5 KL株,杀灭对数值亦均>7.00,杀灭率均为100%。
2.2 病毒灭活试验
由表2可见,消毒液原液(次氯酸含量为 210 mg/L)与病毒液作用1、5、10 min对PEDV JS2012株和PPV BJ株的平均灭活对数值均≥5.0、杀灭率≥99.999%;1 ∶2倍稀释的消毒液(次氯酸含量为105 mg/L)作用5 min和10 min、1 ∶4 倍稀释的消毒液(次氯酸含量为52.5 mg/L)作用10 min对PEDV JS2012株的平均灭活对数值亦均为5.00、杀灭率为99.999%;1 ∶2倍稀释的消毒液作用 1 min 对PEDV JS2012株的平均灭活对数值为4.00、杀灭率为99.990%。而消毒液原液作用 5 min 和10 min对PRRSV GDr180株的平均灭活对数值为3.00,杀灭率为99.899%;对PRV B株的平均灭活对数值为1.15,杀灭率为92.921%;对PCV2 P58株的平均灭活对数值为1.00,杀灭率为90.00%。
3 讨论
猪场常用的化学消毒剂主要有碱类消毒剂、含氯消毒剂、含碘消毒剂、季铵盐类消毒剂、醛类消毒剂、过氧化物类消毒剂、酚类消毒剂、醇类消毒剂等[1]。其中,含氯消毒剂是指以次氯酸(有效氯)为主要杀菌成分的一类消毒剂,主要包括次氯酸钠、次氯酸钙、 液氯、二氯异氰脲酸钠、三氯异氰脲酸和次氯酸等[3]。次氯酸消杀病原微生物的作用原理主要包括:对微生物细胞壁、细胞膜造成一定程度的破坏;破坏细胞内存在的大量蛋白类物质,同时,也可对细胞核中的核苷酸造成破坏;通过破坏微生物的电子传递链及各种代谢中的关键酶, 对微生物的代谢造成严重的影响;次氯酸与微生物反应后可生成活性氧物质、氯胺,这些物质同样可对微生物造成杀灭作用[10]。但由于次氯酸钠、二氯异氰脲酸钠等传统含氯消毒剂均具有较强的刺激性和腐蚀性,对消毒对象有一定的毒性,从而限制了含氯消毒剂的临床广泛应用。因此,一种新型的含氯消毒剂——次氯酸消毒剂应运而生。次氯酸消毒剂又叫弱酸性次氯酸水或微酸性次氯酸水,中华人民共和国国家标准《含氯消毒剂卫生要求》中明确次氯酸消毒剂的定义为“消毒液原液中含有稳定的次氯酸的消毒剂”[11],它可以广谱抵抗微生物,在有效的抗菌浓度范围内,对哺乳动物细胞无刺激性、无致敏、细胞毒性较低,而且环境友好[4]。而易凯欧次氯酸消毒液就是一种次氯酸消毒剂。
一种消毒剂的杀灭效果,通常以杀灭对数值或杀灭率来进行评价,杀灭对数值是指当微生物的数量以对数表示时,消毒前后微生物减少的对数值;而杀灭率是指在微生物杀灭试验中,用百分率表示微生物数量减少的值。一种消毒剂在悬液定量杀菌试验中,细菌各次试验的杀灭对数值均≥5.00,相当于传染性丧失程度为99.999%时,可判定该消毒剂对细菌消毒合格;而病毒消杀试验中,病毒各次试验的平均灭活对数值≥4.00时,相当于传染性丧失程度为99.99%时,可判定该消毒剂对病毒消毒合格。而杀灭率为99.9%、99%、和90%时,则表明消毒剂的消杀能力依次降低[8,12]。而杀灭率低于90%时则表明该消毒剂消杀病原微生物能力很低,不能用于临床消毒。本研究中,易凯欧次氯酸消毒液在次氯酸含量为105 mg/L时,能在30 s内高效杀灭所试5种常见猪源病原菌,杀灭对数值均≥7.00,而当次氯酸含量为52.5 mg/L时,延长作用时间至1~5 min亦能高效杀灭常见猪源病原菌;而对5种猪源病毒,易凯欧次氯酸消毒液的灭活效果却存在一定的差异,次氯酸含量为210 mg/L时消毒液可快速高效灭活PEDV和PPV,平均灭活对数值亦≥5.0;而对PRRSV、PRV和PCV2则表现为中效或低效灭活作用。表明次氯酸消毒液在推荐浓度下对猪场常见病原菌有快速高效的杀灭效果,对PEDV和PPV等病毒亦有良好的消杀作用,可用于猪场日常消毒。
参考文献:
[1]祁梦南,孙 元,仇华吉. 消毒剂的抗病毒研究进展[J]. 中国动物传染病学报,2021,43(9):972-977,1007.
[2]王凤书.消毒剂及杀灭微生物效能研究现状[J]. 医学理论与实践,2007,20(6):657-659.
[3]丁建华,云田田,夏庆勋,等. 次氯酸消毒剂的研究动态及应用[J]. 中国洗涤用品工业,2020(增刊1):214-218.
[4]黄育红,林立旺,陈路瑶,等. 弱酸性次氯酸消毒液杀菌性能和腐蚀性的试验研究[J]. 预防医学论坛,2014,20(9):691-692,704.
[5]王 勝,李其松,吴春阳,等. 非洲猪瘟压力下的猪场消毒剂的选择[J]. 猪业科学,2020,37(5):136-139.
[6]高晓东,胡必杰,鲍 容.次氯酸消毒液对皮肤软组织感染常见病原体体外杀菌试验效果分析[J]. 中华医院感染学杂志,2017,
27(8):1714-1716.
[7]刘 文,蒲施桦,林保忠,等. 微酸性电解水对猪场空气消毒效果的研究[J]. 猪业科学,2015,32(2):89-90.
[8]中华人民共和国卫生部. 消毒技术规范:卫法监发[2002]282号[S]. 2002:15-29,32-37.
[9]国家市场监督管理总局,国家标准化管理委员会.消毒剂实验室杀菌效果检验方法:GB/T 38502—2020[S]. 北京:中国标准出版社,2020.
[10]程亚光,辛鹏举,苏 静,等. 次氯酸对微生物作用的研究现状[J]. 中国消毒学杂志,2019,36(6):470-474.
[11]国家市场监督管理总局,国家标准化管理委员会.含氯消毒剂卫生要求:GB/T 36758—2018[S]. 北京:中国标准出版社,2018.
[12]Juszkiewicz M,Walczak M,Mazur-Panasiuk N,et al. Effectiveness of chemical compounds used against African swine fever virus in commercial available disinfectants[J]. Pathogens ,2020,9(11):878.

