6个紫花苜蓿品种根系形态结构对低磷胁迫的响应
潘新雅, 李军保, 陈 阳, 王鹏飞, 卫先伟, 李 瑞, 刘佳茜, 郑智龙, 徐炳成,4, 王 智,4*
(1. 西北农林科技大学草业与草原学院, 陕西 杨凌 712100; 2. 西北农林科技大学黄土高原土壤侵蚀与旱地农业国家重点实验室, 陕西 杨凌 712100; 3. 陕西省林业科学院, 陕西 西安 710000; 4. 中国科学院水利部水土保持研究所, 陕西 杨凌 712100)
紫花苜蓿(MedicagosativaL.)是黄土高原半干旱地区人工草地建设中最主要的多年生豆科牧草[1],然而该区苜蓿产量低、品质差、品种单一,优质苜蓿品种极其短缺,严重限制了草食畜牧业的发展[2-3]。磷是植物生长的三大必需元素之一,参与植物体内物质合成和各种生理生化过程,在植物生长过程中起着重要的作用[4]。紫花苜蓿是喜磷植物,其生产所需有效磷浓度一般为10~15 mg·kg-1[5],而黄土高原半干旱区土壤有效磷含量低,约为2.4 mg·kg-1[6];加之该区干旱少雨的环境特点,施用的磷肥在土壤中流动性差,极易被金属离子固定[7],磷亏缺是限制黄土高原半干旱地区苜蓿生长的关键因素。因此,如何提高苜蓿磷效率和耐低磷能力,是选育优质乡土苜蓿品种和解决饲草资源短缺现状亟待解决的科学问题。
根系是植物吸收养分的器官,也是最早感受到土壤低磷胁迫的重要部位[8],其早期的发育状况直接影响植物根系系统建成和整个生育期对养分的吸收与利用[9]。在低磷环境下,植物通过调控根系形态和构型,如促进侧根的生长、增加根毛的数量和长度等来促进对磷素的吸收[10]。不同植物根系对低磷胁迫的响应不同,玉米(ZeamaysL.)通过增加表层土壤中侧根的数量来提高根系对土壤磷素的吸收能力[11],番茄(SolanumlycopersicumL.)通过增加总根长、根表面积和根体积来应对低磷胁迫[12]。同时,根系对土壤中营养物质的吸收能力还受到其解剖结构的调控,根系解剖结构是根系发育水平的直接体现[13],皮层细胞层数、导管数量和中柱直径占根直径的比例等,都会影响根系对养分的吸收与运输[14]。通过SimRoot植物功能-结构模型分析表明,在低磷土壤中,根系通气组织的形成使玉米和菜豆的磷吸收量分别提高70%和14%[15],由此可见,根系解剖结构在磷吸收过程中也发挥着重要的作用。紫花苜蓿生长早期根系形态与解剖结构的发育有着紧密的联系[13]。然而,在以往苜蓿根系对低磷胁迫响应的研究中,大多集中于根系形态特征[16],缺乏对根系形态与解剖结构的综合考虑,根系形态与解剖结构间的相互关系及其对磷吸收和利用效率的影响尚不清晰。
本研究以6个紫花苜蓿品种为研究对象,采用营养液砂培法,研究低磷胁迫对苜蓿苗期根系形态、解剖结构和磷效率的影响,阐明根系形态和解剖结构变化对磷效率的影响,从根系形态和解剖结构的角度揭示苜蓿对低磷胁迫的响应策略,以期为耐低磷苜蓿品种的选育提供科学依据。
1 材料与方法
1.1 试验材料
采用在正常磷水平下(0.5 mmol·L-1)[17-18]3个磷吸收效率高(‘冰驰’、‘甘农4号’和‘陇东苜蓿’)和3个磷吸收效率低(‘赛迪’、‘甘农1号’和‘新疆大叶’)的紫花苜蓿品种为供试材料,信息见表1。

表1 供试苜蓿品种及其来源Table 1 Name and source of alfalfa cultivars in the experiment
1.2 试验设计
试验于2019年6—7月在陕西杨凌黄土高原土壤侵蚀与旱地农业国家重点实验室的人工气候室内进行。采用营养液砂培法,选用高40 cm,宽20 cm的培养钵,每钵装入7.5 kg经超纯水淋洗过的石英砂。选取饱满、大小一致的种子,冲洗消毒后[19](0.1%的HgCI2溶液消毒30 min后,用无菌水冲洗3次,每次10 min),在铺有湿润无菌滤纸的培养皿上发芽(25℃)。待胚根长约2 cm左右,选取长势一致的健康幼苗移栽于培养钵中,置于人工气候室培养,昼/夜温度为25℃/20℃,湿度65%,光照时间7∶00—19∶00,光照强度800 μmol·m-2·s-1。设置0.5 mmol·L-1(对照,CK)和0.05 mmol·L-1[16-18](低磷,LP)2个磷水平,磷以NH4H2PO4形式均匀混合到营养液中,低磷处理中的氮用NH4NO3来补足。幼苗移栽后,每钵浇入1 L的1/4Hoagland营养液(pH值为5.8,表2),每隔3 d补浇200 mL新配置的1/4Hoagland营养液,每隔7 d用超纯水淋洗一次培养钵。每培养钵1株植株,每处理6个生物学重复,共72个培养钵,完全随机排列。培养30 d(苗期)后取样测定各项指标。
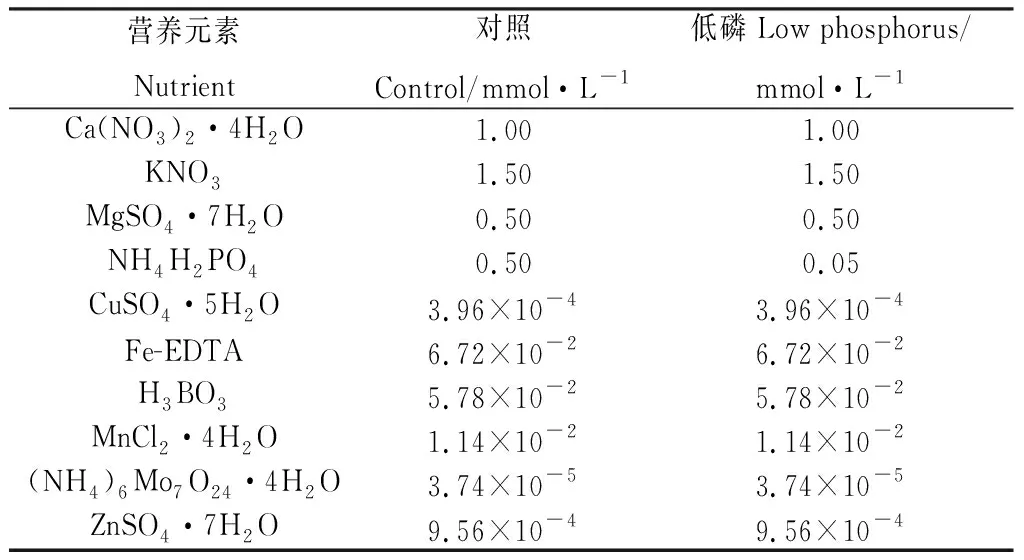
表2 1/4Hoagland营养液配方Table 2 Formula of 1/4 Hogland nutrient solution
1.3 测定项目与方法
根系形态指标:植株收获后,将地上部与根系剪断分开,用去离子水清洗干净后,使根分开不重叠,并摆放置于专用根盘。采用EPSON双面扫描仪(Perfection V800 Photo)进行扫描,并用根系分析软件(Win RHIZO Pro 2009b)对扫描图片进行分析,从而获取相应的根系形态数据:根系直径、根系长度、根系表面积和根系体积。
根系解剖结构:采用常规石蜡切片技术制作根系石蜡切片[20]。截取根茎连接点向下5 cm处的1 cm长的主根根段,用FAA固定液固定后,经酒精系列脱水,二甲苯透明,石蜡包埋后,LEICA全自动切片机切片。切片厚度为5 μm,充分烤片后,用甲苯胺蓝进行染色。在MoticBA410型光学显微镜下观察,用Motic Images Advanced 3.2软件拍照保存。并用ROOTSCAN 2.4软件分析图片,从而获取相应的根系解剖结构数据:皮层细胞层数、皮层细胞大小、横截面积、中柱面积、中柱直径、次生木质部面积占中柱面积比例、导管面积、导管数量和导管直径。
生物量的测定:扫描完的根系和地上部分放入烘箱105℃下杀青30 min后,75℃烘干至恒重并分别称重。
下列指标计算公式[21]:
根冠比=根干重/地上部分干重;比根长=根系长度/根干重;比根表面积=根系表面积/根干重
磷浓度测定:把烘干的植物根和茎叶粉碎混匀,称取0.3~0.5 g,用H2SO4-H2O2消煮后采用钼锑抗比色法[22](UV-2600紫外可见分光光度计,日本)测定磷浓度。
磷效率计算[23]:
磷吸收效率(mg·plant-1)= 磷浓度(mg·g-1)×植株干重(g·plant-1) 磷利用效率(g·mg-1)= 植株干重(g·plant-1)/吸磷量(mg)
1.4 数据统计与分析
采用隶属函数法[24],分别计算测定指标的耐低磷系数:
耐低磷系数= 低磷处理下性状测得值/对照处理下性状测得值
(1)
Xj=a1jR1j+ a2jR2j+…+ aijRiji,j=1,2,3,…,n
(2)
式中,Xj表示第j个综合指标值,aij表示各单一指标的特征值所对应的特征向量,Rij为各单一指标的耐低磷系数标准化值。
不同苜蓿品种综合指标的隶属函数值计算:
(3)
式中,μ(Xj)表示第j个综合指标的隶属函数值,Xj表示第j个综合指标值;Xmax表示第j个综合指标的最大值,Xmin表示第j个综合指标的最小值。
各综合指标权重的计算:
(4)
式中,Wj表示第j个综合指标在所有综合指标中的重要程度及权重;Pj为各品种第j个综合指标的贡献率。
耐低磷综合评价值的计算:
(5)
式中,D表示在低磷胁迫条件下各品种耐低磷能力的综合评价值。
采用SPSS 21.0软件进行统计分析,用单因素方差分析(One-way ANOVA)和新复极差法(Duncan)检验不同品种间根系形态、根系解剖结构、磷效率和生物量的差异(P<0.05),用独立样本T检验分析同一品种不同磷处理间根系形态、根系解剖结构、磷效率和生物量的差异。利用Origin 2018软件作图,其中根系形态、解剖结构、磷效率及地上生物量间的皮尔森相关性用R 4.0.0进行分析并作图。
2 结果与分析
2.1 苜蓿根系形态对低磷胁迫的响应
由图1所示,低磷胁迫下,‘赛迪’的根系直径和根系体积与对照相比分别增加了14.4%和5.3%,而‘冰驰’、‘甘农1号’、‘甘农4号’、‘陇东苜蓿’和‘新疆大叶’的根系直径分别降低了56.8%,4.0%,45.2%,40.6%和7.6%,根系体积分别降低了88.7%,64.2%,82.0%,65.1%和56.9%;‘赛迪’与‘冰驰’的根系直径无显著差异,但显著高于其余4个苜蓿品种(P<0.05),‘新疆大叶’的根系直径最小;‘赛迪’的根系体积显著高于其余5个苜蓿品种(P<0.05),‘甘农1号’的根系体积最小。
低磷胁迫降低了6个苜蓿品种的根系长度和表面积,与对照相比,‘赛迪’、‘冰驰’、‘甘农1号’、‘甘农4号’、‘陇东苜蓿’和‘新疆大叶’的根系长度分别降低了14.5%,87.1%,60.6%,81.2%,57.0%和49.7%,根系表面积分别降低了5.0%,89.1%,61.9%,81.7%,60.5%和53.3%;6个苜蓿品种中,根系长度和表面积最大的是‘赛迪’,最小的是‘新疆大叶’,‘赛迪’与‘甘农4号’和‘陇东苜蓿’的根系表面积无显著差异,但显著高于其余3个苜蓿品种(P<0.05),各品种间的根系长度无显著差异。
与对照相比,‘陇东苜蓿’和‘新疆大叶’的比根长在低磷胁迫下分别增加了43.5%和4.1%,而其余4个苜蓿品种的比根长则有不同程度的降低;与对照相比,‘陇东苜蓿’的比根表面积增加了32.9%,其余5个苜蓿品种的比根表面积均降低;6个苜蓿品种中,比根长和比根表面积最大的是‘陇东苜蓿’,最小的是‘赛迪’。上述结果表明,各苜蓿品种的根系长度、表面积和体积对低磷胁迫的响应最为敏感;低磷胁迫对‘赛迪’根系形态的抑制程度低于其余5个苜蓿品种。
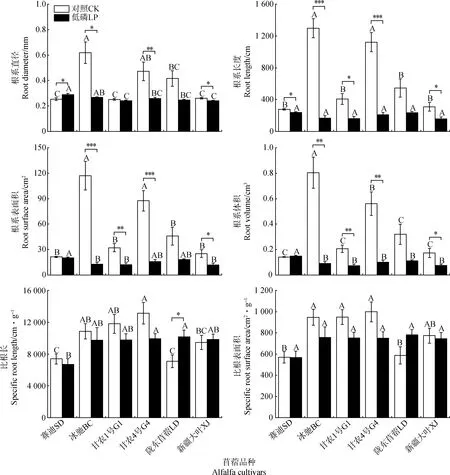
图1 低磷胁迫对苜蓿根系形态的影响Fig.1 Effects of phosphorus deficiency on alfalfa root morphology注:不同大写字母表示同一磷素处理下不同品种间差异达到显著水平(P<0.05);*,**和***表示同一品种不同磷素处理间差异达到5%,1%和0.1%显著水平。下同Note:different capital letters indicate significant difference among different genotypes under the same phosphorus level at 0.05 level;*,** and *** indicate significant difference among different phosphorus levels in the same cultivar at 5%,1% and 0.1% probability levels,respectively. The same as below
2.2 苜蓿根系解剖结构对低磷胁迫的响应
各苜蓿品种根系解剖结构对低磷胁迫呈现出了多样化的响应特征,其中各苜蓿品种的导管直径、中柱直径及其占根直径的比例对低磷胁迫的响应最为敏感(图2和图3)。与对照相比,‘甘农4号’的皮层细胞层数在低磷胁迫下显著降低了43.4%(P<0.01),而其余5个苜蓿品种变化不显著;其中,皮层细胞层数最多和最少的分别是‘冰驰’和‘甘农4号’。同时,除‘冰驰’和‘新疆大叶’的皮层细胞显著变小外(P<0.05),其余4个苜蓿品种皮层细胞大小与对照相比变化不显著;在6个苜蓿品种中,皮层细胞最大和最小的分别是‘甘农4号’和‘甘农1号’。
低磷胁迫下,6个苜蓿品种的中柱直径及其占根直径比例与对照相比均降低,其中‘冰驰’两指标的下降程度最大,分别降低了62.7%和34.9%;在6个苜蓿品种中,‘赛迪’的中柱直径及其占根直径比例最大,‘甘农1号’的中柱直径其占根直径比例最小。‘赛迪’的次生木质部面积占中柱面积比例与对照相比显著降低了70.6%(P<0.05),其余5个苜蓿品种均增加。除‘赛迪’和‘陇东苜蓿’的导管面积占横截面积比例与对照相比显著降低外(P<0.05),其余4个品种均无显著变化,其中‘赛迪’的导管面积占横截面积比例下降幅度最大。与对照相比,‘甘农1号’和‘陇东苜蓿’的导管数量在低磷胁迫下增加了5.2%和7.0%,而其余4个品种的导管数量均降低。此外,各苜蓿品种的导管直径在低磷胁迫均表现为下降趋势,其中‘冰驰’的下降程度最大,为63.3%;导管直径最大和最小的分别是‘甘农4号’和‘甘农1号’,但各品种间的导管数量和导管直径无显著差异。综上所述,在解剖结构层面,导管直径、中柱直径及其占根直径的比例是各苜蓿品种响应低磷胁迫的主要途径。
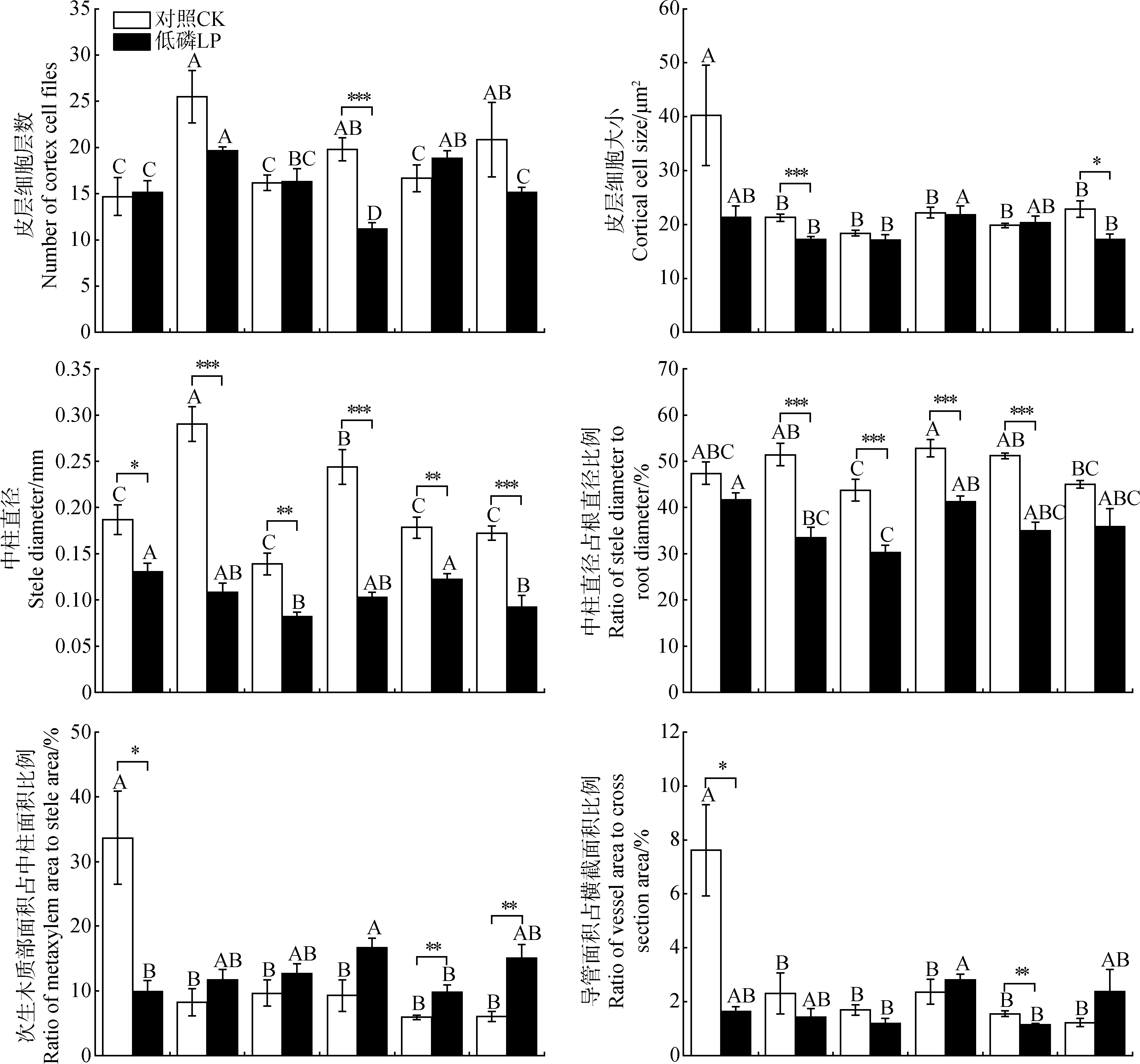
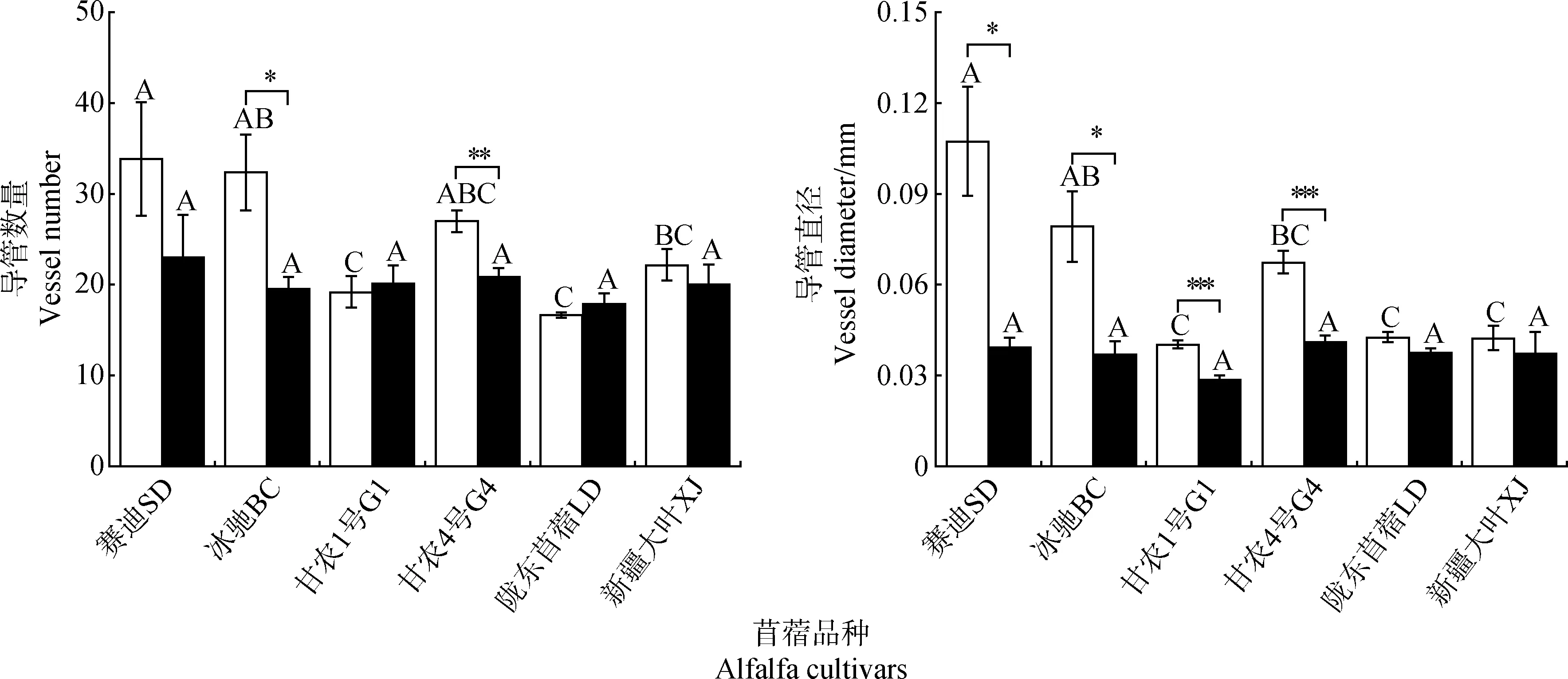
图2 低磷胁迫对苜蓿根系解剖结构的影响Fig.2 Effects of phosphorus deficiency on alfalfa root anatomical structure

图3 两种磷水平下6个苜蓿品种的根系解剖结构图Fig.3 Root anatomical structure of six alfalfa cultivars under two phosphorus levels
2.3 不同苜蓿品种磷效率对低磷胁迫的响应
由图4所示,低磷胁迫下,‘赛迪’、‘冰驰’、‘甘农1号’、‘甘农4号’、‘陇东苜蓿’和‘新疆大叶’的磷吸收效率与对照相比分别降低了56.9%,80.2%,43.0%,65.7%,62.2%和64.1%;‘甘农4号’与‘陇东苜蓿’的磷吸收效率差异不显著,但显著高于其余4个苜蓿品种(P<0.05),‘甘农1号’的磷吸收效率最低。低磷胁迫下,‘赛迪’的磷利用效率与对照相比显著增加了46.3%(P<0.001),而其余5个苜蓿品种的磷利用效率均显著降低(P<0.001),其中‘甘农4号’下降比例最大;‘赛迪’的磷利用效率显著高于其余5个品种(P<0.05),‘甘农4号’的磷利用效率最小。由上述结果可知,除‘赛迪’的磷利用效率显著增加外(P<0.001),低磷胁迫显著抑制了苜蓿对磷的吸收(P<0.05)与利用(P<0.001)。
2.4 低磷胁迫对不同苜蓿品种生物量的影响
由图5所示,低磷胁迫下,除‘赛迪’无显著变化外,其余5个品种的根干重、地上部干重和整株干重与对照相比均显著降低(P<0.01),且‘冰驰’降低的程度均最大;同时,‘赛迪’的根干重、地上部干重和整株干重在各品种中均在较高的水平。与对照相比,‘赛迪’、‘冰驰’、‘甘农1号’、‘甘农4号’、‘陇东苜蓿’和‘新疆大叶’的根冠比在低磷胁迫下分别增加了58.4%,4.3%,21.1%,10.8%,24.3%和54.6%,根冠比最大和最小的分别是‘赛迪’和‘甘农4号’。由上述结果可知,通过增加光合产物在根系中的分配与根冠比可能是‘赛迪’在低磷胁迫下生长受抑制程度最小的因素之一。

图4 低磷胁迫对苜蓿植株磷效率的影响Fig.4 Effects of phosphorus deficiency on alfalfa phosphorus efficiency
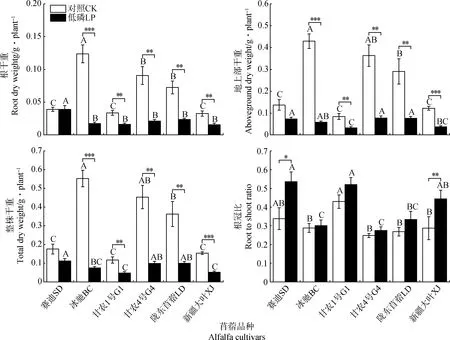
图5 低磷胁迫对苜蓿干物质积累和根冠比的影响Fig.5 Effects of phosphorus deficiency on alfalfa dry weight accumulation and root to shoot ratio
2.5 苜蓿根系形态、解剖结构、磷效率及地上生物量间的相互关系
相关性分析表明(图6),根系直径、长度、表面积和体积与中柱直径及其占根直径比例、导管数量和导管直径呈极显著正相关(P<0.01),且皮层细胞层数与根系长度呈极显著正相关(P<0.01),与根系表面积和体积呈显著正相关(P<0.05)。磷吸收效率与根系直径、长度、表面积、体积、中柱直径及其占根直径比例、皮层细胞层数和导管直径呈极显著正相关(P<0.01),与导管数量呈显著正相关(P<0.05);中柱直径占根直径比例与磷利用效率呈显著正相关(P<0.05);与磷吸收和利用效率相关性最强的根系性状分别是根系长度和中柱直径占根直径比例。此外,地上部生物量与磷吸收效率呈极显著正相关(P<0.01),与磷利用效率呈显著正相关(P<0.05)。
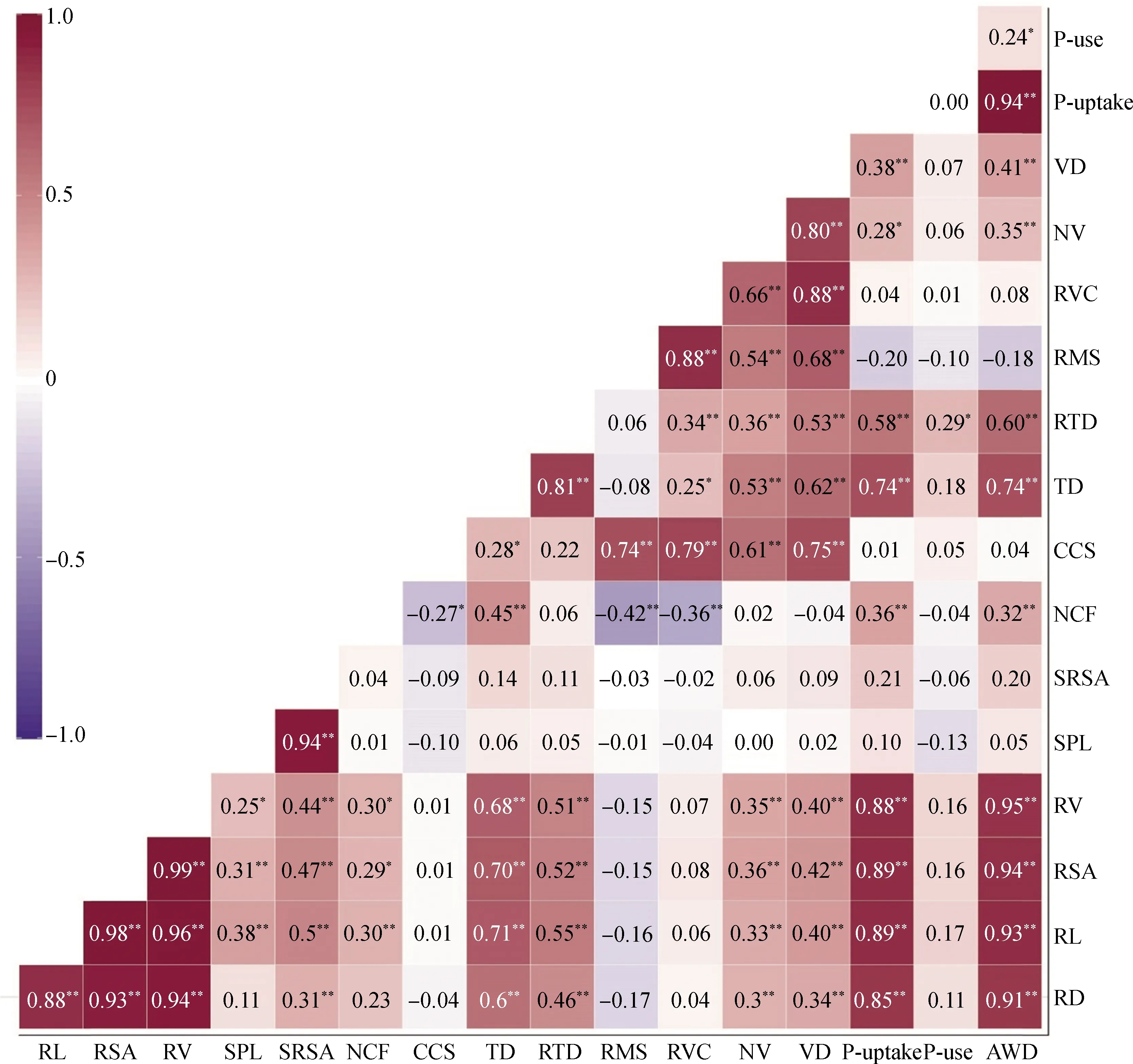
图6 苜蓿根系形态、解剖结构、磷效率及地上生物量间的皮尔森相关性分析Fig.6 Pearson′s correlation matrix among root morphology,anatomical structure,phosphorus efficiency and shoot biomass of alfalfa注:RD,根系直径;RL,根系长度;RSA,根系表面积;RV,根系体积;SPL,比根长;SRSA,比根表面积;NCF,皮层细胞层数;CCS,皮层细胞大小;TD,中柱直径;RTD,中柱直径占根直径比例;RMS,次生木质部面积占中柱面积比例;RVC,导管面积占横截面积比例;NV,导管数量;VD,导管直径;P-uptake,磷吸收效率;P-use,磷利用效率;AWD,地上部分干重,下同。*表示显著相关(P<0.05);**表示极显著相关(P<0.01)Note:RD,root diameter;RL,root length;RSA,root surface area;RV,root volume;SPL,specific root length;SRSA,specific root surface area;NCF,number of cortex cell files;CCS,cortical cell size;TD,stele diameter;RTD,ratio of stele diameter to root diameter;RMS,ratio of metaxylem area to stele area;RVC,ratio of vessel area to cross section area;NV,vessel number;VD,vessel diameter;P-uptake,phosphorus uptake efficiency;P-use,phosphorus uptake efficiency,AWD,aboveground dry weight,the same as below. *means significant correlation at the 0.05 level;**means significant correlation at the 0.01 level
2.6 不同苜蓿品种耐低磷能力的综合评价
各苜蓿品种在对照条件与低磷胁迫下各性状都存在差异,为消除品种间固有的差异,采用耐低磷系数计算方法,将20个单项指标的耐低磷系数进行主成分分析(表4),以便准确地评价不同品种对低磷胁迫的适应性。第1主成分的贡献率为38.868%,载荷较高的是根直径、总根长、根表面积、根体积、磷利用效率、地上部干重、地下部干重和整株干重,反映了根系形态和生物量因子;第2主成分贡献率为16.552%,载荷较高的是中柱直径、中柱直径占根直径比例、导管面积和导管直径,反映了根系解剖结构因子。前6个主成分累计贡献率达89.489%,说明这6个主成分可代表原始数据所提供的绝大部分信息。这样可以将20个单项指标转化为6个相互独立的综合指标,利用公式(2),(3),(4),(5)可计算出6个苜蓿品种的D值(表5),并根据D值大小对其耐低磷性进行排序,结果为‘赛迪’>‘甘农1号’>‘陇东苜蓿’>‘新疆大叶’>‘甘农4号’>‘冰驰’。

表3 各综合指标特征值及贡献率Table 3 The eigenvalue and contribution of each comprehensive index

表4 6个苜蓿品种的综合评价值及排序Table 4 The comprehensive evaluation value and rank of six alfalfa cultivars
3 讨论
磷亏缺是黄土高原半干旱地区苜蓿生长的重要限制因素,根系是连接植物与土壤的纽带,是植物吸收磷的主要器官[25]。本研究揭示了紫花苜蓿根系外部形态与解剖结构的变化对磷效率的影响,并通过隶属函数综合评价6个苜蓿品种的耐低磷能力,结果为‘赛迪’>‘新疆大叶’>‘甘农1号’>‘陇东苜蓿’>‘甘农4号’>‘冰驰’。
根系形态和解剖结构特征的可塑性变化与植株磷效率密切相关[14,17],根系长度、表面积和体积可反映植物根系与土壤的接触面积[26],是根系吸收能力的直接体现[27]。在本研究中,6个苜蓿品种的根系长度、表面积和体积与磷吸收效率呈极显著正相关(P<0.01),低磷胁迫下,三者受抑制程度越大,磷吸收效率降低的程度也越大。根冠比增加是植物耐低磷能力的重要体现,当受到低磷胁迫时,植物通常会将光合产物优先用于根的生长,以保证植株生长对养分的需求[17]。低磷胁迫使6个苜蓿品种的根冠比均呈现不同程度的增大,与李丹竹等[16]对紫花苜蓿的研究结果一致。‘赛迪’在低磷胁迫下的根干重无明显变化,且在6个苜蓿品种中根冠比最高,说明‘赛迪’能够在低磷胁迫下维持根系的生长,这可能是其耐低磷的原因之一。同时,相关性分析表明,6个苜蓿品种的磷吸收效率与导管直径、中柱直径及其占根直径的比例也呈极显著正相关(P<0.01)。导管是根系输送水分和无机物质的结构,导管直径影响根系对土壤无机物质的输导能力,而中柱直径决定了养分在根中的径向运输距离,导管和中柱直径越大,根系输导能力越强[28-30]。本研究中,各苜蓿品种的导管直径、中柱直径及其占根直径的比例在低磷胁迫下均呈现出了降低的趋势。可见,低磷胁迫主要通过降低苜蓿根系长度、表面积与体积限制其根系对土壤中磷素的吸收,同时降低导管直径、中柱直径及其占根直径比例来限制磷素在苜蓿根系内部的运移与输导,从而造成苜蓿磷吸收效率及其生物量的积累受到抑制[13]。苜蓿根系吸收的磷素减少,不能及时转运到地上部,光合作用等受到抑制,导致分配到根系的光合产物减少,不能正常供应根系在土壤勘探过程中所需的能量,由此造成了低效吸收和转运的循环体系[26]。此外,较少的皮层细胞层数可以降低根系中养分的径向运输阻力[14],本研究中,只有‘甘农4号’的皮层细胞层数在低磷胁迫下显著减少(P<0.001),这可能是其磷吸收效率高于其余5个苜蓿品种的原因之一。由此可知,苜蓿对于磷的吸收是其根系外部形态特征与内部解剖结构共同作用的结果。
植物的磷效率不仅受到磷吸收效率的影响,还受到磷利用效率的影响[31]。本研究表明,仅‘赛迪’的磷利用效率与对照相比显著增加(P<0.001),而其余5个苜蓿品种的磷利用效率均显著降低(P<0.001);在苜蓿根系外部形态与解剖结构各指标中,只有中柱直径占根直径比例与磷利用效率显著正相关(P<0.05),这与De Bauw等对水稻(OryzasativaL.)的研究结果一致[14]。中柱直径占根直径的比例越大,养分运输的径向阻力越小,根系能更快的将养分运输到植株各个器官,从而促进植株体内养分的循环利用[32]。低磷胁迫下,‘赛迪’中柱直径占根直径比例大于其余5个苜蓿品种,且受影响程度最小,而其它苜蓿品种均有较大程度的下降,这可能是导致‘赛迪’磷利用效率增加和其余品种磷利用效率显著降低(P<0.001)的原因之一。此外,磷利用效率还与植物地上部生理活动有着密切的关系,如通过释放液泡中的磷和转移衰老组织中的磷等提高磷利用效率以维持体内磷浓度的平衡[33]。因此,‘赛迪’磷利用效率在低磷胁迫下显著增加(P<0.001)的原因还有待进一步研究。
4 结论
低磷胁迫主要通过降低根系长度、表面积和体积以及导管直径、中柱直径及其占根直径比例限制苜蓿根系对磷的吸收与利用,各根系性状受抑制程度与磷吸收效率降低的程度呈正相关关系。其中,影响6个紫花苜蓿品种磷吸收和利用效率最关键的根系性状分别是根系长度和中柱直径占根直径的比例。6个苜蓿品种中,‘赛迪’主要通过增加根冠比来维持根系在低磷环境下的生长,提高磷利用效率,从而表现出较强的耐低磷能力。此外,本研究重点关注了苜蓿苗期根系形态与解剖结构对磷效率的影响,关于苜蓿根系构型随生育期的动态变化对磷吸收的影响仍需进一步的研究。

