丛枝菌根真菌对干旱胁迫下鹅绒委陵菜生理指标的影响
齐晨汐, 易观涛, 付晓璇, 王海龙, 王佳琳, 吴建慧
(东北林业大学, 黑龙江 哈尔滨 150040)
干旱是世界性环境问题,全球有三分之一以上的地区为干旱或半干旱地区,其他地区植物在生长季也会遭受不同程度的干旱胁迫[1],在诸多非生物胁迫中,干旱胁迫对植物的危害程度占主要地位。陈爱萍等[2]研究发现,在中度和重度干旱胁迫下伊犁绢蒿幼苗地上部分生长受到严重抑制。干旱胁迫会诱导植物活性氧的累积,降低植物水势,从而引起植物吸收矿质营养能力下降,阻碍植物生长,甚至导致植物死亡[3]。为了减缓干旱胁迫对植物的伤害,国内外有许多学者取得了相关成果,如喷施生长素[4]、喷施赤霉素[5]、用有机物(硝普纳)处理[6]、用硅处理[7]、加入AMF[8]处理等。关于AMF对干旱胁迫下植物生理生化的影响近年已有一些相关报道。张伟珍等[9]发现,AMF可以通过提高植物的可溶性糖、可溶性蛋白等渗透调节物质的积累,从而提高细胞液浓度、降低细胞渗透势、防止细胞脱水、细胞水势降低,与外界形成较高的水势差,提高细胞吸水或保水能力[10]。AMF能与柑橘(Citrusreticulatablanco)形成共生体,其抗旱性高于未接种AMF的柑橘[11]。秦子娴等[12]研究发现,接种了AMF的玉米(ZeamaysL.)在土壤有效磷含量较高时可提高玉米的抗旱性,提高了SOD,POD相对活性,降低MDA的含量。综上所述,AMF与植物体共生可以促进宿主植物对水分的吸收与利用,促进植物光合作用,从而提高植物对干旱胁迫的抵抗能力。
鹅绒委陵菜,又名蕨麻,蔷薇科(Rosaceae)委陵菜属(Potentilla)多年生草本植物,是一种匍匐茎型莲座状植物,具有较高观赏价值。鹅绒委陵菜较耐粗放管理、高度适应不良环境、维护成本较低、分布范围广[13]。在国外对鹅绒委陵菜的研究主要是药理作用和无性繁殖,我国对鹅绒委陵菜的研究多集中在引种驯化[14]、重金属胁迫[15]、组织培养[16]、药理作用[17]等方面,鹅绒委陵菜在园林中常用作北方干旱地带的草坪草,而有关鹅绒委陵菜-AMF共生体应答干旱逆境的机制未见报道。本研究通过自然控水方法,对接种AMF的委陵菜响应干旱胁迫的生理特性进行测定分析,旨在揭示鹅绒委陵菜的耐旱机制及其在干旱地区的园林应用提供理论依据。
1 材料与方法
1.1 试验材料
在东北林业大学园林学院苗圃培养鹅绒委陵菜幼苗,待株高为4~5 cm时收割取回。从北京市农林科学院购回根内根生囊霉接种物,包含有菌根片段、真菌菌丝和孢子等,孢子量约为18 个·g-1。泥炭土、珍珠岩、蛭石、腐殖土等购自黑龙江省哈尔滨市花卉市场。
1.2 试验方法
1.2.1试验设计 选取生长一致、发育正常的鹅绒委陵菜幼苗,用清水培养3~5 d。
AMF接种处理:将所购基质泥炭土、珍珠岩和蛭石按3∶1∶1比例混合拌匀后置于高压灭菌锅中,120℃,240 KPa灭菌处理3 h。将经过高温高压灭菌处理的基质土置于口径为18 cm的花盆中,精确称取根内根生囊霉接种物25 g均匀置于处理组2 cm表层基质。
将鹅绒委陵菜幼苗随机等分为两组:对照组(CK)和处理组(T),CK栽植在未接种根内根生囊霉的灭菌土壤中,T栽植在接种根内根生囊霉的灭菌土壤。每隔3 d浇一次水正常养护,80 d后测定鹅绒委陵菜菌根侵染率,让侵染后的植株及CK自然失水(CK组与T组连续12 d不浇水),让其自然干旱,在干旱胁迫0 d,3 d,6 d,9 d,12 d时两组分别取样并测定其相应生理指标。
1.2.2菌根侵染率的测定 从基质中挖出鹅绒委陵菜后,用清水轻轻冲洗根部,将根部附带的杂质等冲洗干净至根部呈黄白色,注意控制水流速度和人为操作手法,以免破坏根系。根系清洗干净后,取新鲜根样,准确剪取1 cm不同粗细的根段保存FAA固定液(70%酒精:17.5 mol·L-1冰醋酸:38%甲醛=18∶1∶1)中,标记后可放入4℃冰箱内进行密封保存。
剪取接种根内根生囊霉的鹅绒委陵菜100个根段,用10%氢氧化钾溶液在90℃水浴锅消解60 min至透明状,用蒸馏水清洗两遍,再用2%的盐酸酸化至少30 min后用蒸馏水清洗两遍,用H2O2和蒸馏水再各清洗两遍,用碱解离-Trypan blue色法[18]进行染色,乳酸甘油溶液进行脱色处理后制片,用根段观测法和网格十字交叉法进行观察,按照《菌根学》[19]测定菌根侵染率。
1.2.3生理指标的测定 以鹅绒委陵菜叶片为试验材料,通过利用硫代巴比妥酸测定法测定MDA质量摩尔浓度;利用氮蓝四唑法测定SOD活性;利用愈创木酚方法测定POD活性;通过考马斯亮蓝G-250染色法测定可溶性蛋白含量[20]。
1.3 数据分析
通过利用MYCOCALC.EXE软件计算菌根侵染率。利用SPSS软件对侵染率生理指标进行Duncans单因素方差多重比较分析,差异显著水平为0.05。利用Microsoft Excel软件对鹅绒委陵菜在AMF侵染后的生理指标进行数据分析与处理。
2 结果与分析
2.1 鹅绒委陵菜根与菌根共生的结构特征
经查阅文献[21-22]鉴定鹅绒委陵菜与菌根共生的丛枝结构为重楼型(Paris type,简写为P型)丛枝结构。由图1所示,根内根生囊霉的菌丝沿着植物根系表面生长并形成多处分支、多个入侵点(图1a-1e)。菌丝根据结构不同可分为有隔菌丝(图1a)和无隔菌丝(图1d);菌丝弯曲缠绕自由生长,可扩展为胞间菌丝(图1c)和胞内菌丝(图1e);而根内根生囊霉的菌丝体以二叉分支方式生长,得到二叉状菌丝H(图1e),连续以二叉分支方式生长,可形成树状结构。根内根生囊霉存在有大量泡囊(图1d-1i),且在相对较老的根中有较多的孢囊(图1i);泡囊形态多为椭圆形,也有圆形、异形、不规则形等(图1f-1i);根内根生囊霉菌丝体侵染植物根外层细胞后会导致被侵染植物根系表面有明显的隆起,影响鹅绒委陵菜的根活力水平(即根系代谢水平),从而影响整个植物的生命活动强度。
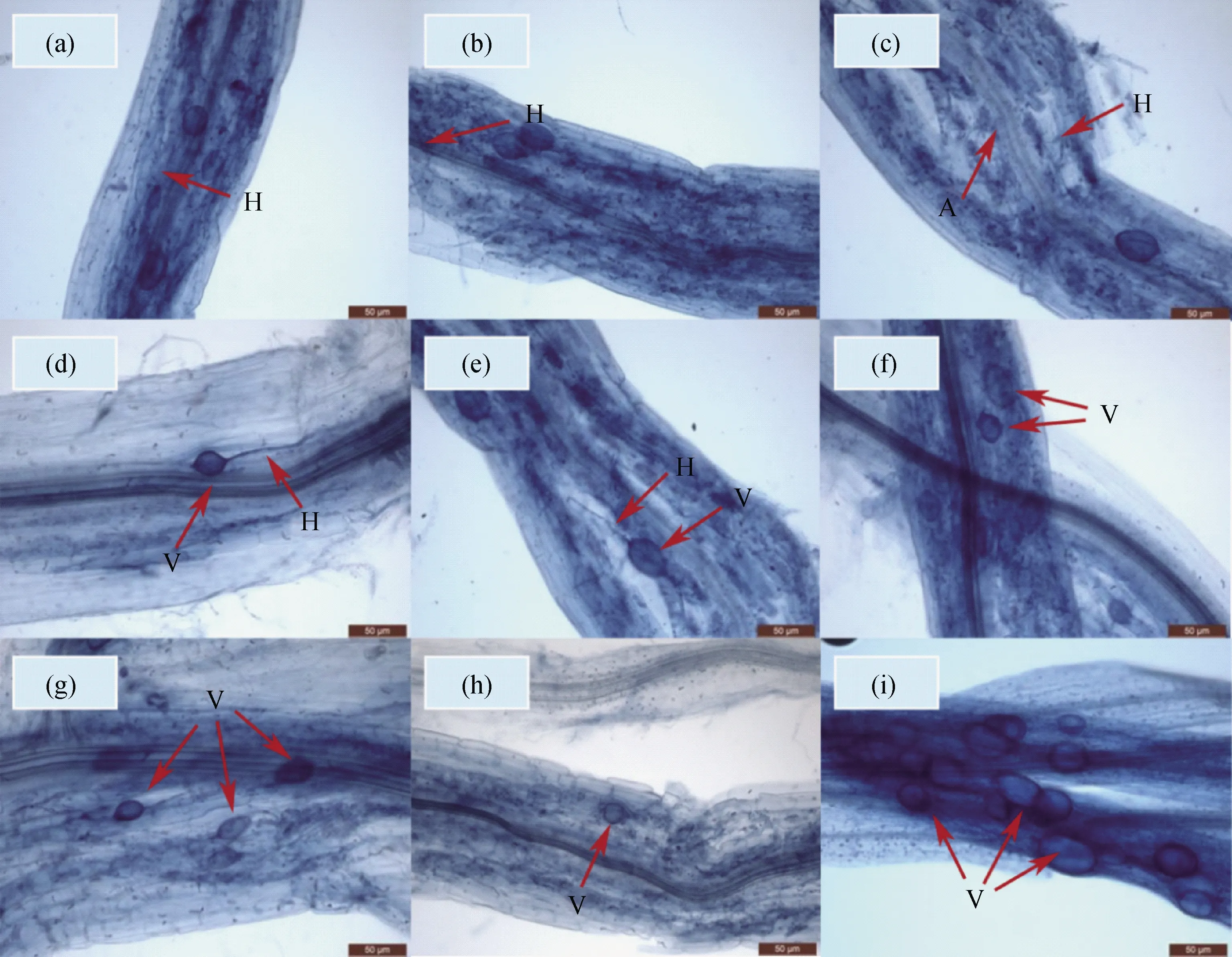
图1 鹅绒委陵菜AMF菌根显微结构Fig.1 Microstructure of AM mycorrhiza in Potentilla anserina注:(a)有隔菌丝H;(b)菌丝侵入点H;(c)已消解成斑点状丛枝A及有隔菌丝H;(d)无隔菌丝H及泡囊V;(e)二叉状菌丝H及顶端膨大成泡囊V;(f)异形泡囊V;(g)不规则泡囊V;(h)圆形泡囊V;(i)不规则泡囊VNote:(a)Septate hyphae H;(b)Hyphal invasion point H;(c) Been digested into Arbuscular and septate hyphae H;(d) Hyphae H and vesicles without septum;(e) Bifurcate hyphae H and apical expanded V;(f) Heterocyst V;(g) Irregular vesicle V;(h) Round vesicle V;(i) Irregular vesicle V
2.2 鹅绒委陵菜根围AMF侵染状况
由表1可知,菌根类型均为P型。在干旱胁迫天数为0 d、不接菌的对照处理中,未发现有菌根真菌的侵染,即侵染率为0;在干旱胁迫天数为0 d、接种根内根生囊霉的鹅绒委陵菜菌根侵染率极高,达到91.07%;对于处理组,随着干旱胁迫程度逐渐增加,根系的菌根侵染率表现为下降,表明干旱会影响土壤中AMF的正常生长。

表1 干旱胁迫下AMF对鹅绒委陵菜菌根侵染率的影响Table 1 Effects of AM fungi on mycorrhizal infection rate of Potentilla anserina under drought stress
2.3 AM真菌对干旱胁迫下鹅绒委陵菜生理特性的影响
2.3.1AM真菌对干旱胁迫下鹅绒委陵菜丙二醛含量的影响 由图2可知,CK的鹅绒委陵菜在干旱胁迫第9 d时,MDA的含量最高,高达25.41 μmol·g-1;而T在干旱胁迫9 d时MDA的含量显著低于CK(P<0.05),降低了15.89%;在干旱胁迫第12 d时,T的MDA含量也低于CK;由此可见,AMF会减轻细胞受到损伤的程度。
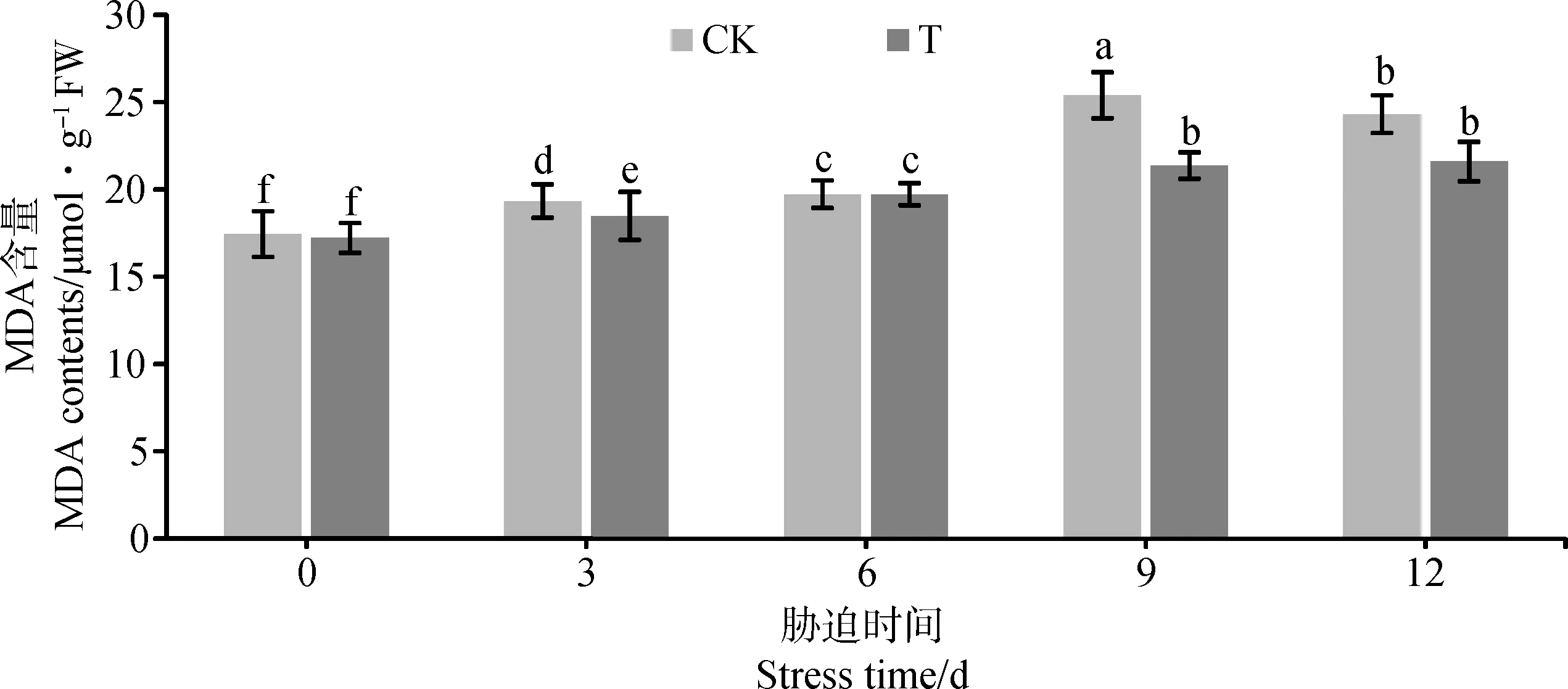
图2 AMF对干旱胁迫下鹅绒委陵菜MDA的影响Fig.2 Effects of AM fungi on MDA tolerance of Potentilla anserina under drought stress
2.3.2AM真菌对干旱胁迫下鹅绒委陵菜酶活性的影响 由图3可知,SOD的活性随着干旱处理时间的延长呈现先升高后降低的趋势。CK和T的SOD活性在第9 d时达到最大值,分别为14.65 U·g-1和19.36 U·g-1,和其他胁迫时间相比差异显著(P<0.05);且T的SOD的活性始终高于CK,说明接菌后显著提高了植株体内的SOD活性水平,比CK更有效地清除体内活性氧,进而保护自身细胞免受损害。

图3 AMF对干旱胁迫下鹅绒委陵菜SOD的影响Fig.3 Effect of AM fungi on SOD of Potentilla anserina under drought stress
由图4所示,POD的活性随着干旱胁迫时间的增加呈现先升高后降低的趋势。CK和T的POD活性在第9 d时达到最大值,分别达到791 U·g-1和1 029 U·g-1,T的POD的活性比CK高30.00%,和其他胁迫时间相比差异显著(P<0.05);且T的POD的活性始终高于CK,说明接菌后减轻了氧化物对鹅绒委陵菜的伤害,从而降低了干旱胁迫对鹅绒委陵菜的伤害程度。
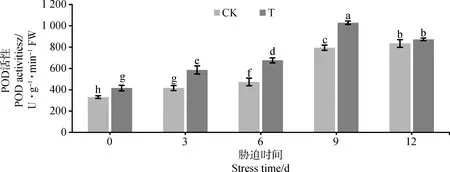
图4 AMF对干旱胁迫下鹅绒委陵菜POD的影响Fig.4 Effect of AM fungi on POD tolerance of Potentilla anserina under drought stress
2.3.3AM真菌对鹅绒委陵菜耐受干旱胁迫可溶性蛋白的影响 由图5所示,干旱胁迫初期(前3 d),可溶性蛋白含量变化不明显;在干旱胁迫第6 d时,CK和T的可溶性蛋白含量明显提高并达到最大值,分别达到2.21 mg·g-1和2.47 mg·g-1;而CK在胁迫12 d时可溶性蛋白含量显著低于T(P<0.05),降低了34.59%;由此可见,AMF能够加强鹅绒委陵菜细胞的保水能力,对其起到保护作用。

图5 AMF对干旱胁迫下鹅绒委陵菜可溶性蛋白含量的影响Fig.5 Effects of AM fungi on soluble proteins of Potentilla anserina under drought stress
3 讨论
3.1 干旱胁迫下接种AM真菌的菌根侵染率
根系是植物的重要器官,吸收水分和矿物质养分,稳固和储存同化物[23],植物对养分吸收效率与根系构型有关[24]。本试验通过对鹅绒委陵菜接种根内根生囊霉,发现接种根内根生囊霉的鹅绒委陵菜菌根侵染率达91.07%,侵染率高,易与鹅绒委陵菜形成共生关系。这与吴强盛等[25]研究认为接种AMF可对白三叶(TrifoliumrepensL.)根系构型及参数起促进效应与本文研究结果基本一致。
3.2 AM真菌对干旱胁迫下鹅绒委陵菜生理特性的影响
MDA是细胞膜脂过氧化产物之一,植物体内MDA含量的高低在一定程度上反映了脂膜过氧化作用水平和膜结构的受害程度[26],以及植物的抗逆性强弱,其中MDA含量越高则植物氧化程度越高,即细胞所受损害程度越大。在本试验中,随着干旱胁迫程度的增加,鹅绒委陵菜体内的MDA含量呈上升趋势,这与张玉曼等[27]的研究中发现所受胁迫程度越深的狗尾草其体内MDA含量越高一致。且T的MDA含量始终低于CK,即AMF能够阻碍干旱胁迫对鹅绒委陵菜植株的伤害,从而增强植株的抗旱性。
SOD和POD是普遍存在于植物体内、极为重要的抗氧化酶,防止逆境产生的自由基对细胞膜产生不利影响[28]。研究表明,SOD和POD活性与生物机体的免疫水平密切相关[29],体内SOD,POD活性较高的植物抗逆性较强[30]。随着干旱强度的增加,CK和T的SOD,POD的活性均增加;在植株受到干旱胁迫时,体内活性氧数量会增加,说明鹅绒委陵菜会对干旱胁迫做出应答反应;但当植株所受逆境胁迫超过承受能力时,会损伤细胞。在干旱中期和后期(6~12 d),T的酶活性始终高于CK,说明接菌后能够增加SOD,POD活性,即降低了干旱胁迫对鹅绒委陵菜的伤害程度,保护了自身细胞。
可溶性蛋白为重要的渗透调节物质和营养物质,它们的增加和积累能提高细胞的保水能力,对细胞的生命物质及生物膜起到保护作用,即可溶性蛋白的含量是判断植物抗旱性的重要指标之一[31]。随着干旱胁迫强度的增加,CK和T的可溶性蛋白的含量均降低。在高强度干旱胁迫下,植物生物膜脂氧化加剧,破坏了细胞膜结构的完整性[32]。而在CK和T的干旱胁迫中期和后期(6~12 d),T的可溶性蛋白含量显著高于CK,这与罗方舟等[33]的研究发现可溶性蛋白质在一定程度的干旱胁迫下,通过参与植物体内的渗透调节以抵御干旱胁迫一致。这说明AMF能够提高鹅绒委陵菜细胞的持水性,从而提高了植物的抗旱性。此与赵匠等[34]发现AM真菌在盐胁迫下能通过促进黄檗(PhellodendronamurenseRupr.)可溶性蛋白分泌提高黄檗抗逆性的研究结果一致。
4 结论
综上所述,鹅绒委陵菜接种AMF后,AMF能够侵染鹅绒委陵菜根系并与鹅绒委陵菜建立良好的共生关系;在干旱胁迫下,接种AMF的鹅绒委陵菜能够有效的降低MDA含量、增强SOD和POD活性并增加可溶性蛋白的含量。以上生理指标的变化体现了AMF在一定程度上能够增强鹅绒委陵菜的抗旱能力,有效减缓了干旱胁迫对鹅绒委陵菜所造成的伤害。鹅绒委陵菜在干旱胁迫下,能够利用接种AMF提高其抗旱性。

