阻止艾滋病在脑中复制贝克曼研究所用外泌体携药入血脑屏障傥蠢椿蛴糜谏窬系统疾病治疗

2021年6月3日,联合国艾滋病规划署发布的一则新闻标题属实瞩目:四十年抗艾经验表明,到2030年终结艾滋病可以实现。
且不论联合国艾滋病规划署的雄心壮志能否在10年后实现,现有的难题仍旧是人类不得不面对的。
人类免疫缺陷病毒(艾滋病毒,HIV)是一种感染人类免疫系统细胞的慢性病毒。20%的艾滋病患者感染艾滋病毒后,病毒会穿越血脑屏障进入人类大脑,并在大脑中繁殖,导致患者产生艾滋病毒相关神经认知障碍(HAND)。
然而,抗逆转录病毒药物却受限于血脑屏障,无法进入,这也导致了艾滋病毒不能在血液中复制,却可以在脑中复制。为此,科学家们一直在尝试解决穿越血脑屏障的问题。
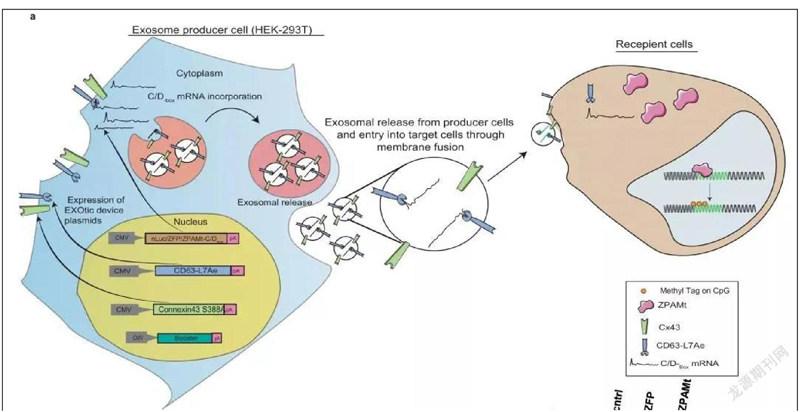
近日,美国贝克曼研究所基因治疗中心的研究人员使用外泌体将抗HIV蛋白递送到感染 艾滋病毒的小鼠的细胞中。这种蛋白质可以附着在艾滋病毒的遗传物质上并阻止其复制,结果表明,小鼠骨髓、脾脏和大脑中的艾滋病毒水平显著降低。
相关文章以题为“Exosome-mediatedstableepigeneticrepression of HIV-1”发表在《自然·电子学》上。
阻止大脑中艾滋病毒的复制
人类免疫缺陷病毒-1 (HIV-1) 是人类免疫缺陷病毒最常见的致病株。一旦进入人体后,它们会将RNA遗传物质转化为DNA并将其整合到宿主细胞的DNA中,然后病毒会劫持细胞的RNA和产生蛋白质的机器来制造新的副本。
阻断艾滋病毒复制的药物称为抗逆转录病毒疗法(ART),旨在将体内的病毒载量降低到无法检测到的水平,使其无法传播给未感染的个体。这种方式已被证明在抑制病毒方面非常成功,使许多艾滋病毒患者能够过上健康长寿的生活。然而,接受ART的人的细胞DNA中仍然有病毒基因组的拷贝库。一旦治疗停止,这些“原病毒”就会重新激活,产生新的病毒颗粒。此外,抗逆转录病毒药物耐药性的出现可能会挑战抗病毒治疗的疗效。
另一方面,在艾滋病患者体内,脂多糖(lipopolysaccharide ,LPS)含量会显著升高,这是一种肠道正常菌群中的组成成分。LPS进入血液后会侵蚀血脑屏障血管,导致血脑屏障出现裂缝,感染艾滋病毒的细胞乘机进入大脑。
目前,业内提出了控制艾滋病毒的“阻止和锁定”机制,即病毒DNA被阻止复制并有效地锁定在其宿主的DNA内。
此前曾有报道,病毒5 '长末端重复序列(LTR) 的高甲基化会导致艾滋病毒感染细胞模型以及一些长期接受ART治疗的个体出现潜伏期。研究人员推断5'LTR的靶向DNA甲基化可能代表“阻断和锁定”策略的有希望的途径。
因此,研究人员猜测表观遗传蛋白,如DNA甲基转移酶3A(DNMT3A),可用于下调HIV-1转录。他们开发了一种靶向HIV-1启动子的锌指蛋白 (ZFP-362),该蛋白与DNA甲基转移酶3A的活性结构域融合,可以诱导长期稳定的HIV-1表观遗传抑制。
“我们开发的ZPAMt蛋白(上述蛋白融合体)被包装到外泌体纳米颗粒中,可以进入细胞,并通过表观遗传学的方式使艾滋病毒沉默,”该研究的作者、来自美国加州大学洛杉矶分校的教授凯文·莫里斯博士说,“我们的研究表明,这些纳米颗粒可以系统地‘阻断和锁定艾滋病毒达。这是第一次成功地将‘阻断和锁定用于在大脑中治疗艾滋病毒。”
其中, ZPAMt蛋白被设计为附着在病毒复制所必须的LTR区域,该蛋白质中有一个表观遗传标记,可以改变病毒遗传信息的表达方式。它的作用是抑制遗传信息的表达,从而使病毒无法分裂和繁殖。
当研究人员对感染艾滋病毒的小鼠进行基于外泌体的治疗时,他们发现外泌体递送的蛋白质能够使感染艾滋病毒的细胞沉默。此外,感染艾滋病毒的小鼠表现出骨髓、脾脏和大脑中艾滋病毒表达的抑制。
作者表示,这项创新技术不仅可以治疗艾滋病,还可以治疗其他疾病,包括影响大脑的疾病,如阿尔茨海默症和帕金森症。
目前,这项研究仅在小鼠身上进行过测试,作者称目前没有资金支持其进行人体试验。
10年内终结过于理想
“我们开发的ZPAMt蛋白(上述蛋白融合体)被包装到外泌体纳米顆粒中,可以进入细胞,并通过表观遗传学的方式使艾滋病毒沉默,”该研究的作者、来自美国加州大学洛杉矶分校的教授凯文·莫里斯博士说,“我们的研究表明,这些纳米颗粒可以系统地‘阻断和锁定艾滋病毒表达。这是第一次成功地将‘阻断和锁定用于在大脑中治疗艾滋病毒。”
其中,ZPAMt蛋白被设计为附着在病毒复制所必须的LTR区域,该蛋白质中有一个表观遗传标记,可以改变病毒遗传信息的表达方式。它的作用是抑制遗传信息的表达,从而使病毒无法分裂和繁殖。
当研究人员对感染艾滋病毒的小鼠进行基于外泌体的治疗时,他们发现外泌体递送的蛋白质能够使感染艾滋病毒的细胞沉默。此外,感染艾滋病毒的小鼠表现出骨髓、脾脏和大脑中艾滋病毒表达的抑制。
作者表示,这项创新技术不仅可以治疗艾滋病毒,还可以治疗其他疾病,包括影响大脑的疾病,如阿尔茨海默症和帕金森症。
目前,这项研究仅在小鼠身上进行过测试,作者称目前没有资金支持其进行人体试验。
但是,全球在获得ART治疗上存在不平等,特别是对于低收入国家的人口。2021年7月,世卫组织发布的一份报告指出,2020年170万感染艾滋病毒的儿童中约有46%没有接受治疗,并且约有15万儿童是新感染的。
简而言之,仅靠ART不足以帮助我们战胜艾滋病。因此,开发艾滋病毒预防性疫苗已被很多公司提上日程。但艾滋病毒的多样性和病毒的免疫逃避策略,使艾滋病毒成为“我们这一代最大的生物医学挑战”。
在艾滋病疫苗开发思路的三波浪潮之中,其科学范式都侧重于刺激免疫系统产生能够灭活病毒的中和抗体。
其中,在以靶向T细胞的思路中,由美国和泰国皇家政府之间达成合作——RV144试验。他们在2003年9月到2009年8月在泰国招募了16,402名成年人。这项试验是唯一能够证明任何真实世界有效性措施的候选药物,其预防艾滋病毒感染的有效性为31.2%,但31%仍与获得监管部门批准所需的数字相去甚远。
以莫德纳、强生为代表的则是基于刺激免疫系统的B细胞产生针对病毒的广泛中和抗体(bnAbs)。
目前, 莫德纳开展了一项人体临床试验,该公司希望在9月底之前招募56名没有艾滋病的健康成年人,以测试疫苗的安全性和基本免疫反应。
而强生的一项名为Imbokodo的艾滋病疫苗IIb期临床试验因未能提供足够保护力而失败。强生的第二项名为Mosaico的研究将继续进行,该研究将在美洲和欧洲的男男性行为者和跨性别者中测试不同成分的艾滋病疫苗方案。
目前,全世界正在进行20多项艾滋病疫苗试验。在这个疫苗学的“新时代”,最终能否解决“ 我们这一代最大的生物医学挑战”?只有时间才能证明一切。 (综合整理报道)(编辑/多洛米)

