青蒿提取物对泌乳奶牛瘤胃发酵参数及微生物区系的影响
余诗强 熊安然 潘予琮 汪 悦 张亚静 蒋林树* 熊本海*
(1.北京农学院动物科学技术学院,奶牛营养学北京市重点实验室,北京 102206;2.中国农业科学院北京畜牧兽医研究所,北京 100193;3.河北省高碑店市职教中心,保定 074000)
奶牛瘤胃是一个大型生物反应器,瘤胃中的微生物能够帮助奶牛将大量不能被宿主直接利用的物质转化成能被利用的高质量的营养素,如消化宿主动物不能消化的纤维素、半纤维素等物质,显著增加饲粮中总能的可利用程度;同时宿主-瘤胃-微生物相互作用参与机体许多重要的生理过程,因此瘤胃微生物区系的组成与结构影响宿主对饲粮营养物质的消化与吸收[1-2]。长期以来,大量研究一直致力于改善饲粮配方和使用饲料添加剂来优化、调节瘤胃的菌群结构,以此促进瘤胃发酵,提高饲粮中营养物质的利用效率[3]。植物提取物作为新型饲料添加剂,具有绿色、无毒、无残留等优点,能解决抗生素带来的药物残留等问题,是替代抗生素优选物质[4],同时,植物提取物可以调节反刍动物瘤胃菌群结构,改善瘤胃发酵、减少甲烷排放、提高动物的饲粮利用率和生产性能[5]。
青蒿(ArtemisiaannuaL.),又名草蒿、香蒿等,是菊科艾属一年生草本植物,其富含植物营养活性物质,例如单萜、倍半萜和酚类等化合物,生物学功能广泛[6]。青蒿在世界各地分布广泛,可以被动物食用,具有改善畜产品品质,增强动物机体抗菌、抗炎、抗氧化和免疫调节能力[7-8]。青蒿是一种非常规饲料,其无毒无害、无耐药性,在畜牧生产上应用广泛,是营造动物安全养殖环境的理想饲料资源[9],饲粮中添加适量青蒿提取物能调节机体免疫功能,提高肠道消化酶活性,增强机体抗病能力,提高动物的生产性能[10]。在奶牛饲粮中添加120 g/d的青蒿提取物能显著改善奶牛机体的脂质代谢途径,提高乳腺上皮细胞活性,激活腺苷酸活化蛋白激酶-哺乳动物雷帕霉素靶蛋白(AMPK-mTOR)信号通路,促进奶牛乳汁中乳脂合成[11],其能提高奶牛体外发酵试验中瘤胃液氨态氮(NH3-N)浓度和干物质消化率,降低中性洗涤纤维含量和乙丙比,并抑制甲烷产生[12]。青蒿提取物能改善反刍动物瘤胃发酵,促进短链脂肪酸(SCFA)生成,提高代谢能(ME)、泌乳净能(NEL)和有机物消化率,在抑制甲烷产生方面具有积极作用[13]。但目前青蒿提取物对奶牛瘤胃发酵的影响尚未见报道。因此,本试验拟通过饲养试验深入研究青蒿提取物对瘤胃发酵参数和微生物区系的影响,以期为青蒿提取物在奶牛生产实践中的应用提供理论依据。
1 材料与方法
1.1 试验材料
本试验所用的青蒿提取物为棕黄色粉末,选购自陕西某天然制品有限公司,其主要成分和含量如下:青蒿素39.0%,粗灰分13.0%,粗纤维27.9%,粗蛋白质6.3%,水分5.0%,多糖8.3%,挥发油0.5%。
1.2 试验动物及饲养管理
选取健康、泌乳中期、体况相似、胎次为2~4胎、日产奶量为(33.0±3.9)kg/d的荷斯坦奶牛20头为试验动物。试验牛采用散栏带卧床式饲养,每天07:00、13:00和18:00对奶牛进行投料,09:30、15:30、21:30进行挤奶。试验期间奶牛自由采食,自由饮水,牛舍每天清扫、清粪。基础饲粮参照NRC(2001)奶牛饲养标准配制,以全混合日粮(TMR)形式饲喂,基础饲粮组成及营养水平见表1。
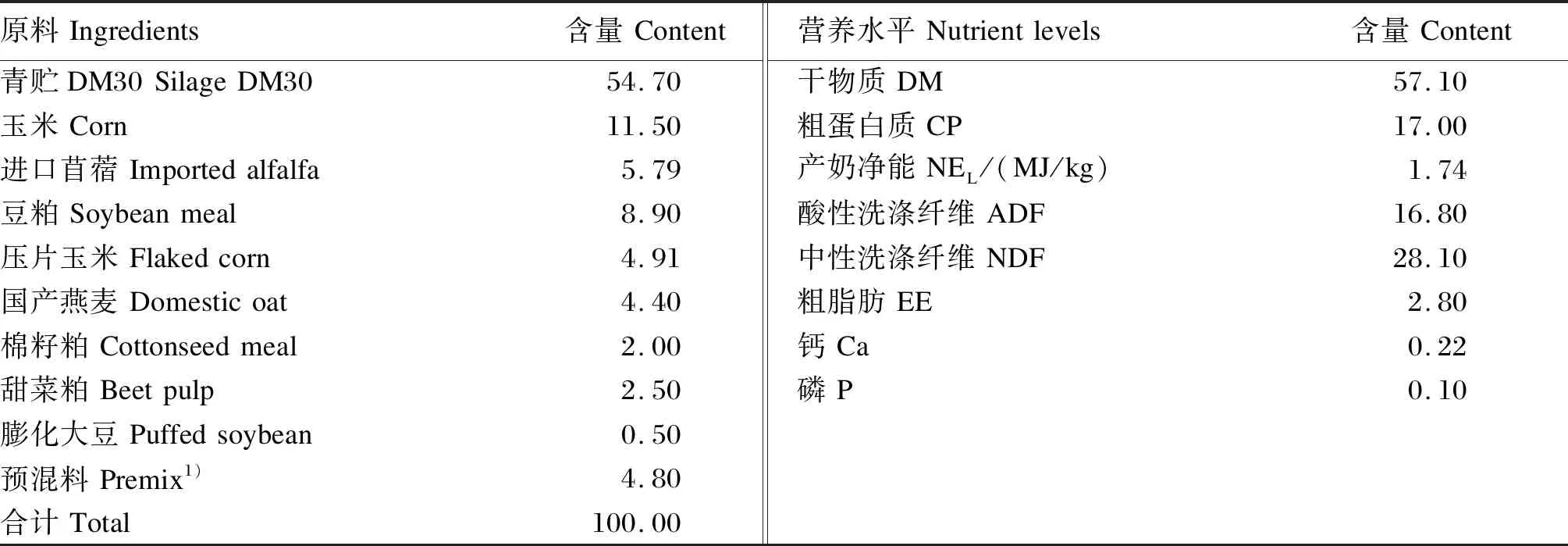
表1 基础饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of the basal diet (DM basis) %
1.3 试验设计
本研究于2019年5—7月在奶牛营养学北京市重点实验室延庆基地进行。试验牛随机分为4组(1个对照组和3个试验组),每组5头,对照组饲喂基础饲粮,试验组饲喂在基础饲粮中分别添加0.25%[50 g/(d·头)]、0.50% [100 g/(d·头)]、0.75% [150 g/(d·头)]青蒿提取物的试验饲粮。试验期45 d,其中预试期10 d,正试期35 d。
1.4 样品采集与测定
1.4.1 瘤胃液的采集
在正试期的第35天,于晨饲前1 h经口腔采集瘤胃液,使用灭菌的4层纱布进行过滤分装于15 mL离心管和5 mL冻存管中,保存于-80 ℃备用,用于NH3-N、挥发性脂肪酸(VFA)浓度和瘤胃菌群的测定。
1.4.2 样品测定
pH:使用PHS-10型便捷式pH计测定。
NH3-N浓度:参照王加启[14]的比色法测定。
VFA浓度:采用内标法测定。使用安捷伦7890B型号气相色谱仪测定。色谱条件为FID检测器,流速为30 mL/min的N2作为载气,空气发生器提供流速为40 mL/min的氢气,空气流速400 mL/min,总流量为54 mL/min,吹扫流量3 mL/min,分流比50∶1,线速度为27.8 cm/s,DB-FFAP(15 m×0.32 mm×0.25 μm)填充柱,柱温180 ℃,检测温度280 ℃,进样口温度250 ℃,进样量2 μL。
1.4.3 瘤胃菌群多样性
1)将-80 ℃下保存的瘤胃液样品置于无菌操作台,并放入冰水混合物中解冻后,根据Power Soil DNA Isolation Kit试剂盒说明书进行总DNA提取。
2)使用细菌V3~V4区域引物338F(5’-ACTCCTACGGGAGGCAGCAG-3’)、806R(5’-GGACTACHVGGGTWTCTAAT-3’)进行PCR扩增。具体PCR反应体系及反应条件见表2。为避免试验误差,检测的瘤胃液样本均设3个重复,并将重复样本的PCR扩增得到的产物混匀,进行凝胶电泳定量质检。

表2 PCR反应体系及反应条件Table 2 PCR reaction system and reaction conditions
3)构建瘤胃细菌区系16S rRNA基因文库,为目的DNA片段两端加上特定的接头序列。
4)基于Illumina平台的Hiseq双端测序,Illumina HiSeq测序得到的原始图像数据文件,经碱基识别(base calling)分析转化为原始测序序列(sequenced reads),结果以FASTQ(fq)文件格式存储,其中包含测序序列(reads)的序列信息以及其对应的测序质量信息。
5)根据PE reads之间的Overlap关系,将Hiseq测序得到的双端序列数据拼接(merge)成1条序列Tags,同时对reads的质量和merge的效果进行质控过滤。主要有3个步骤:第1步,PE reads拼接,使用FLASH v1.2.7软件,通过overlap对每个样品的reads进行拼接,得到的拼接序列即原始Tags数据(raw Tags);第2步,Tags过滤,使用Trimmomatic v0.33软件,对拼接得到的raw Tag进行过滤,得到高质量的Tags数据(clean Tags);第3步,去除嵌合体,使用UCHIME v4.2软件,鉴定并去除嵌合体序列,得到最终有效数据(effective Tags)。质控过滤后,利用QIIME(version 1.8.0)软件中UCLUST对Tags按照97%相似性水平进行聚类,得到每个样品的操作分类单元(OTU)。通过OTU的代表序列与微生物参考数据库比对,进行物种注释,分析α-多样性,利用R语言工具绘制稀释性曲线和Venn图。使用QIIME软件进行β-多样性分析,绘制主坐标分析(PCoA)图。不同组差异性利用CAA和Heatmap图进行分析。
1.5 数据分析
数据经Excel 2016进行初步整理后,采用SPSS 20.0统计软件进行方差分析,组间比较采用Duncan氏法进行多重比较,并以P<0.05为差异显著性判断标准。
2 结果与分析
2.1 饲喂青蒿提取物对奶牛瘤胃发酵参数的影响
由表3可知,与对照组相比,添加0.25%青蒿提取物,瘤胃液NH3-N和丙酸浓度显著升高(P<0.05),乙丙比显著降低(P<0.05),瘤胃液pH、总挥发性脂肪酸、乙酸、丁酸、异丁酸、异戊酸和戊酸浓度无显著变化(P>0.05);添加0.50%青蒿提取物,瘤胃液丙酸、异丁酸和戊酸浓度显著升高(P<0.05),乙丙比显著降低(P<0.05),瘤胃液pH、NH3-N、总挥发性脂肪酸、乙酸、异戊酸和丁酸浓度无显著变化(P>0.05);添加0.75%青蒿提取物,瘤胃液总挥发性脂肪酸、丙酸、丁酸和戊酸浓度显著升高(P<0.05),乙酸、异丁酸浓度和乙丙比显著降低(P<0.05),瘤胃液pH、异戊酸和NH3-N浓度无显著变化(P>0.05)。
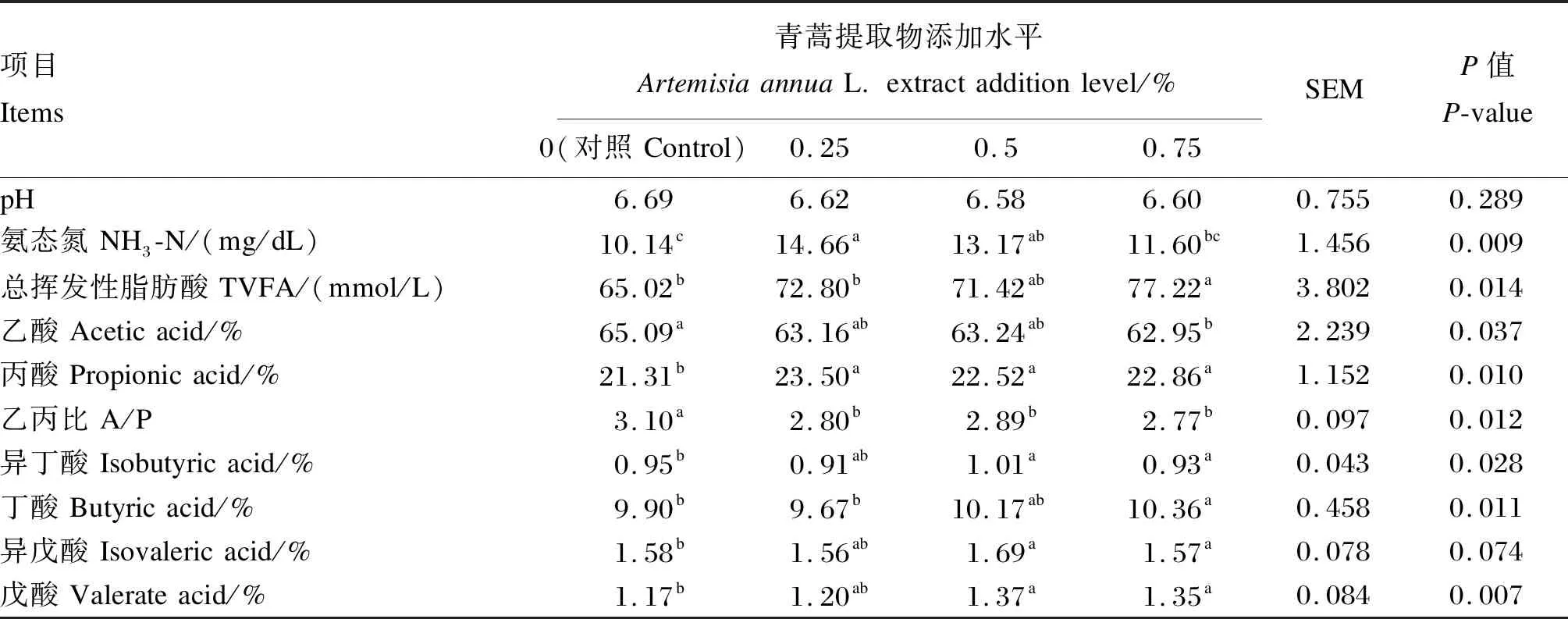
表3 青蒿提取物对奶牛瘤胃发酵参数的影响Table 3 Effect of Artemisia annua L.extract on rumen fermentation parameters of dairy cows
2.2 饲喂青蒿提取物对奶牛瘤胃微生物区系的影响
2.2.1 青蒿提取物对奶牛瘤胃细菌群落多样性的影响
2.2.1.1 凝胶电泳分析
由凝胶电泳结果(图1)可知,对24个瘤胃液样品(根据饲喂青蒿提取物对奶牛瘤胃常规发酵参数的影响进行剂量筛选,最终以添加水平0.75%为试验组进行高通量测序,共24个瘤胃液样品)进行16S rRNA基因的V3~V4区进行PCR扩增,产物条带正确清晰、浓度合适,质量满足建库要求。
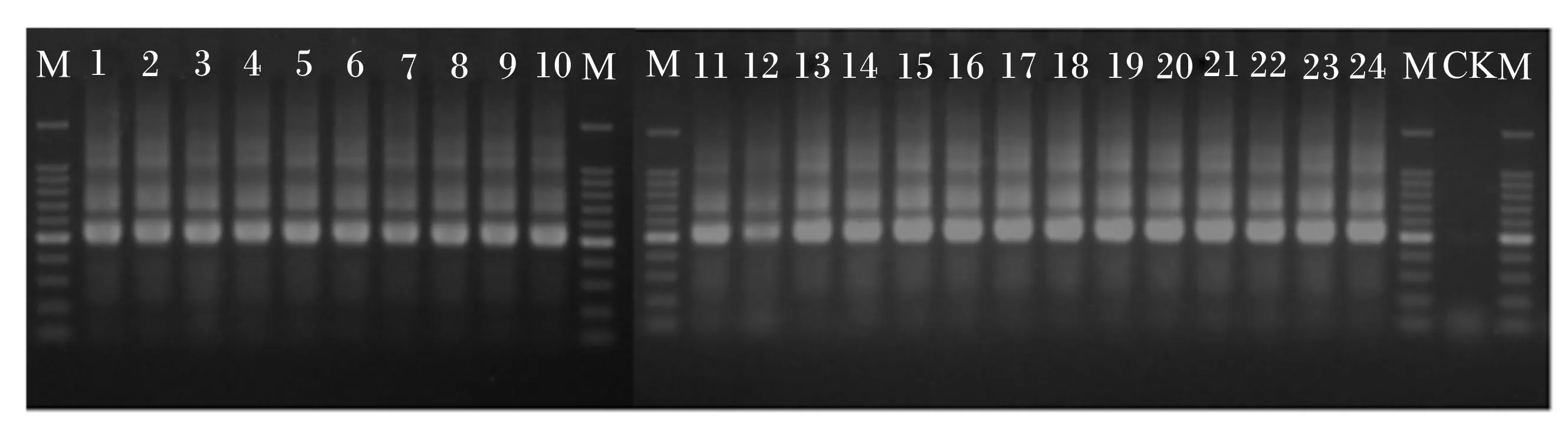
M:标记;1~24:24个样品;CK:以纯水为空白。M:marker;1 to 24:24 samples;CK:pure water was used as blank.图1 PCR扩增样品琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoresis of PCR amplified samples
2.2.1.2 细菌群落多样性分析
基于16S rRNA基因测序数据,绘制瘤胃液菌群样本的稀释曲线和物种积累曲线,图2中各样本曲线均达到平台期,说明测序数量已经足够包含样本中绝大部分微生物信息。由Coverage指数可知,各样本的覆盖率达到99%以上(表4),故可以准确地反映瘤胃中微生物群落的种类和结构多样性。本试验测序以97%的相似性阈值将序列划分为不同的OTU,在瘤胃液菌群中获得969个有效OTU,对照组与试验组(0.75%青蒿提取物组)共享969个OTU,对照组独享0个OTU,试验组独享5个OTU。由表4可知,与对照组相比,添加0.75%青蒿提取物显著提高了Ace指数和Chao1指数(P<0.05),Shannon指数和Simpson指数无显著变化(P>0.05)。
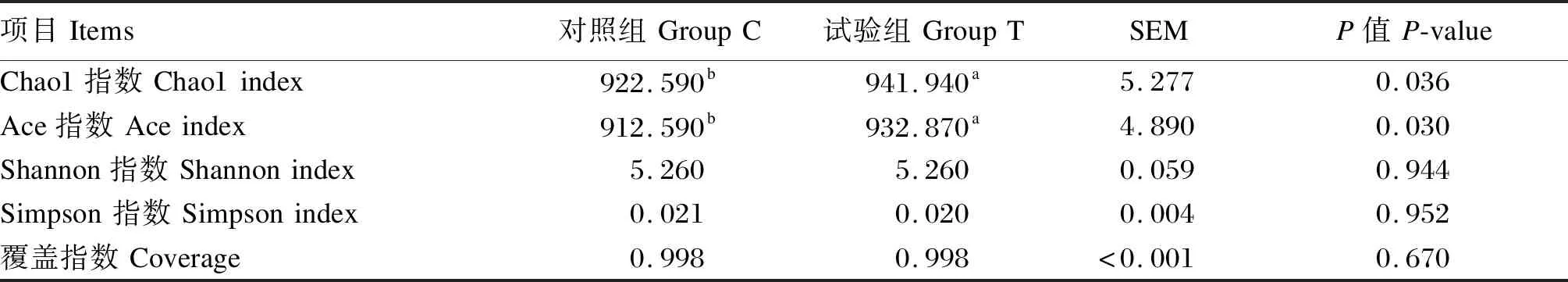
表4 瘤胃液细菌α-多样性指数Table 4 Rumen bacterial alpha-diversity index
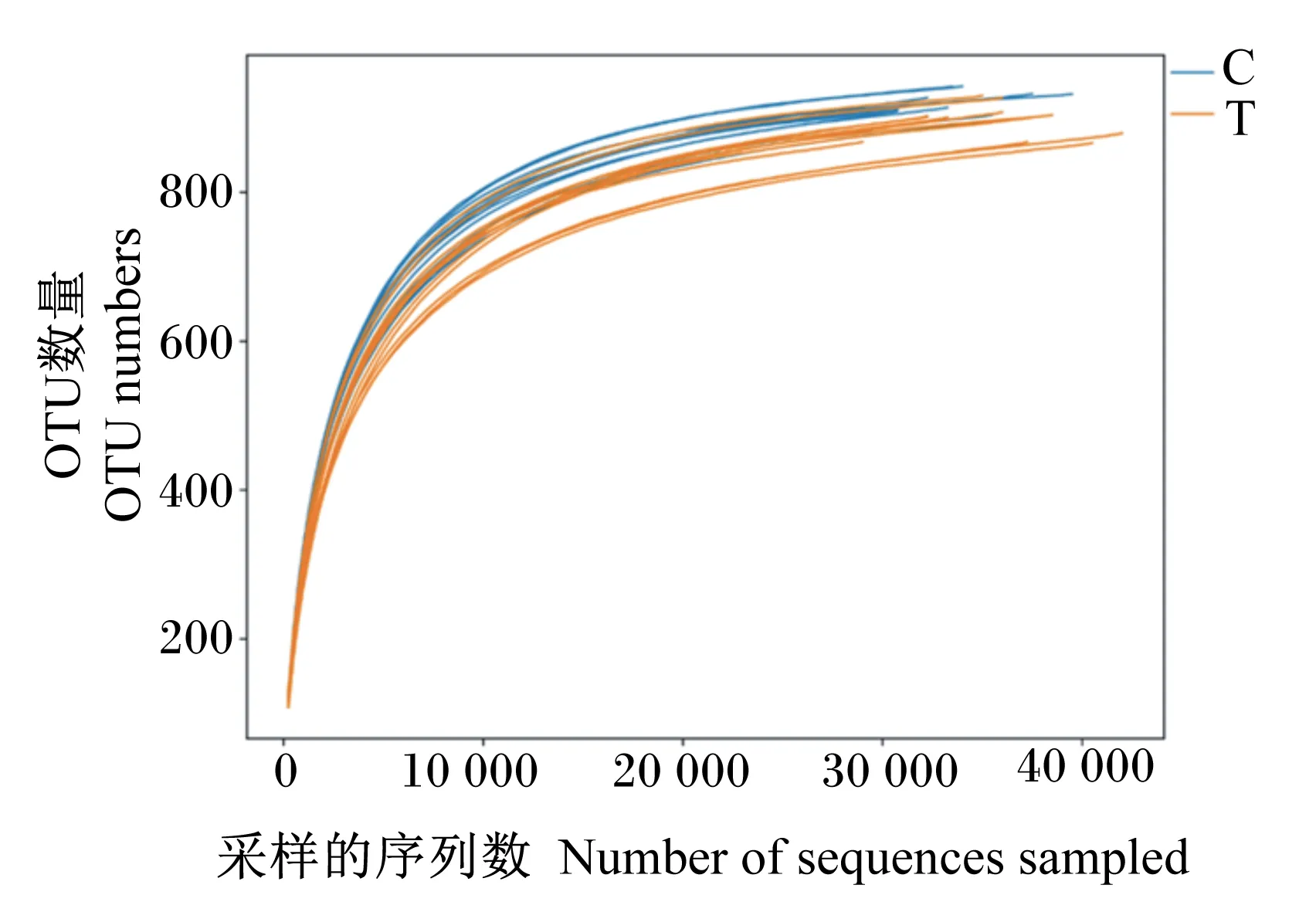
C:对照组;T:试验组(0.75%青蒿提取物组)。下图同。C:control group;T:experimental group (0.75% Artemisia annua L.extract group).The same as below.图2 样品稀释曲线Fig.2 Sample dilution curve
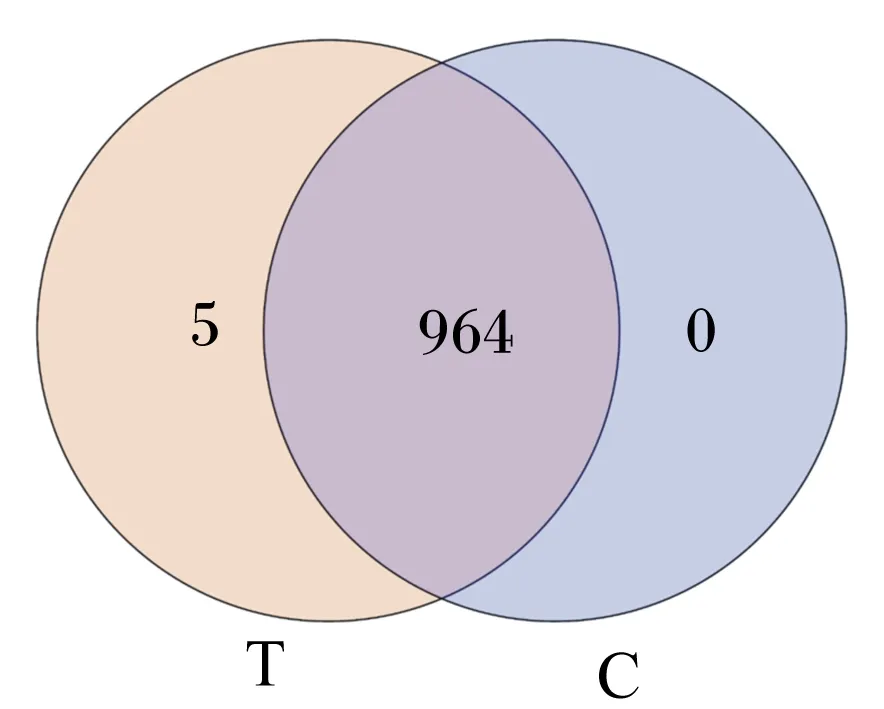
图3 OTU Venn图Fig.3 OTU Venn diagram
2.2.2 青蒿提取物对瘤胃液菌群相对丰度的影响
分析瘤胃液菌群在门水平的组成比例及变化,检测到14个菌门,其中不同组瘤胃液细菌区系中相对丰度在0.01%以上的门均有10个。由表5和图4可知,在门水平上,不同组奶牛瘤胃液细菌区系的优势菌群一致,但在2组间相对丰度不同,相对丰度在1%以上的菌门均有4个,分别为拟杆菌门、厚壁菌门、变形菌门和SR_[Absconditabacteria]。其在试验组中的相对丰度分别为52.37%、32.94%、10.48%、1.38%,在对照组中的相对丰度分别为56.12%、31.22%、6.91%、2.30%。泌乳期荷斯坦奶牛瘤胃液的优势菌门主要有拟杆菌门、厚壁菌门。对照组中拟杆菌门、厚壁菌门的相对丰度分别为56.12%、31.22%,试验组中拟杆菌门、厚壁菌门的相对丰度分别为52.37%、32.94%。与对照组相比,试验组拟杆菌门相对丰度显著下降3.7%(P<0.05),厚壁菌门相对丰度上升1.72%(P>0.05),变形菌门相对丰度显著上升3.57%(P<0.05),SR_[Absconditabacteria]相对丰度显著下降0.92%(P<0.05),疣微菌门相对丰度显著下降0.26%,其他菌门相对丰度无显著变化(P>0.05)。
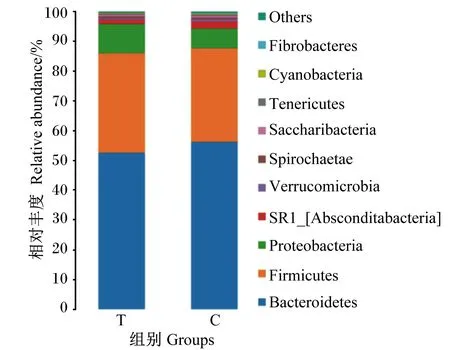
图4 门水平上青蒿提取物对奶牛瘤胃液细菌区系组成的影响Fig.4 Effects of Artemisia annua L.extract on bacterial flora composition in rumen fluid of dairy cows at phylum level
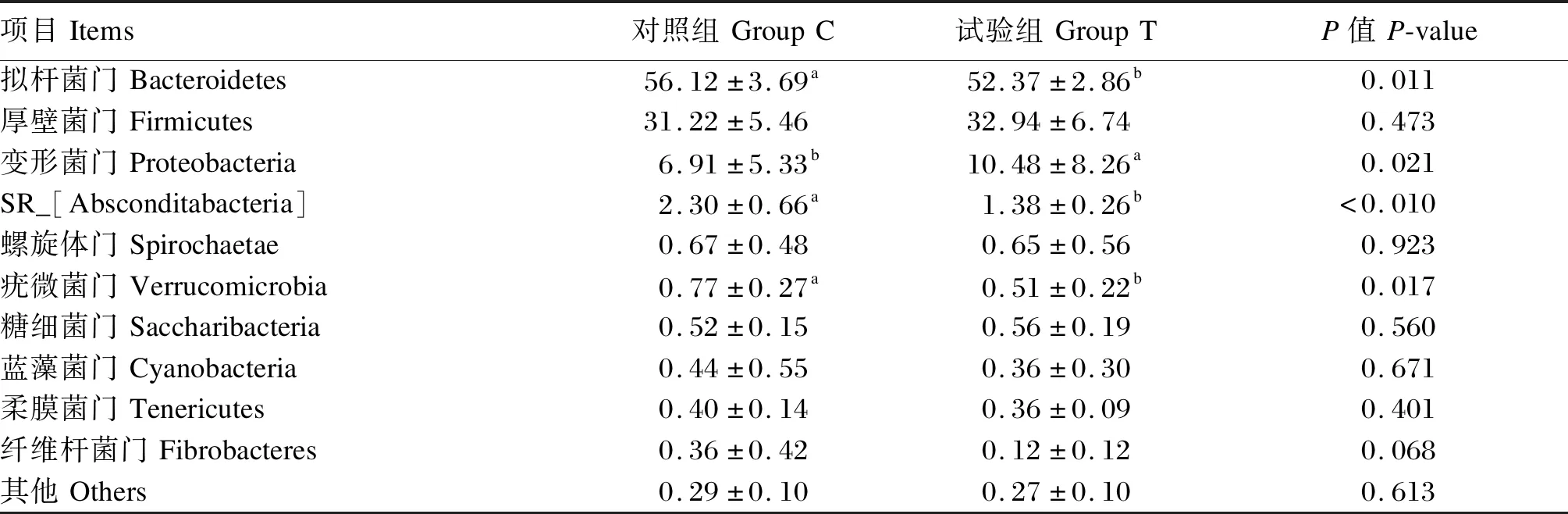
表5 青蒿提取物对瘤胃菌群相对丰度的影响(门水平)Table 5 Effects of Artemisia annua L.extracts on relative abundance of rumen microflora (phylum level) %
分析2组瘤胃液菌群在属水平的组成和变化,共检测到相对丰度大于0.01%的属共有128个。由表6和图5可知,在属水平上,不同组奶牛瘤胃液细菌区系的优势菌群一致,但在2组间相对丰度不同,主要的属有10个(大于1%)分别为普雷沃氏菌属1、uncultured_rumen_bacterium、琥珀酸弧菌科UCG-002、理研菌科RC9群、丁酸弧菌属2、月形单胞菌属1、解琥珀酸菌科、瘤胃球菌科NK4A214群、瘤胃球菌属2、克里斯滕森菌科R-7。与对照组相比,试验组普雷沃氏菌属1、理研菌科RC9群和解琥珀酸菌属相对丰度显著提高(P<0.05),丁酸弧菌属2、瘤胃球菌科NK4A214群和瘤胃球菌属2相对丰度显著下降(P>0.05)。
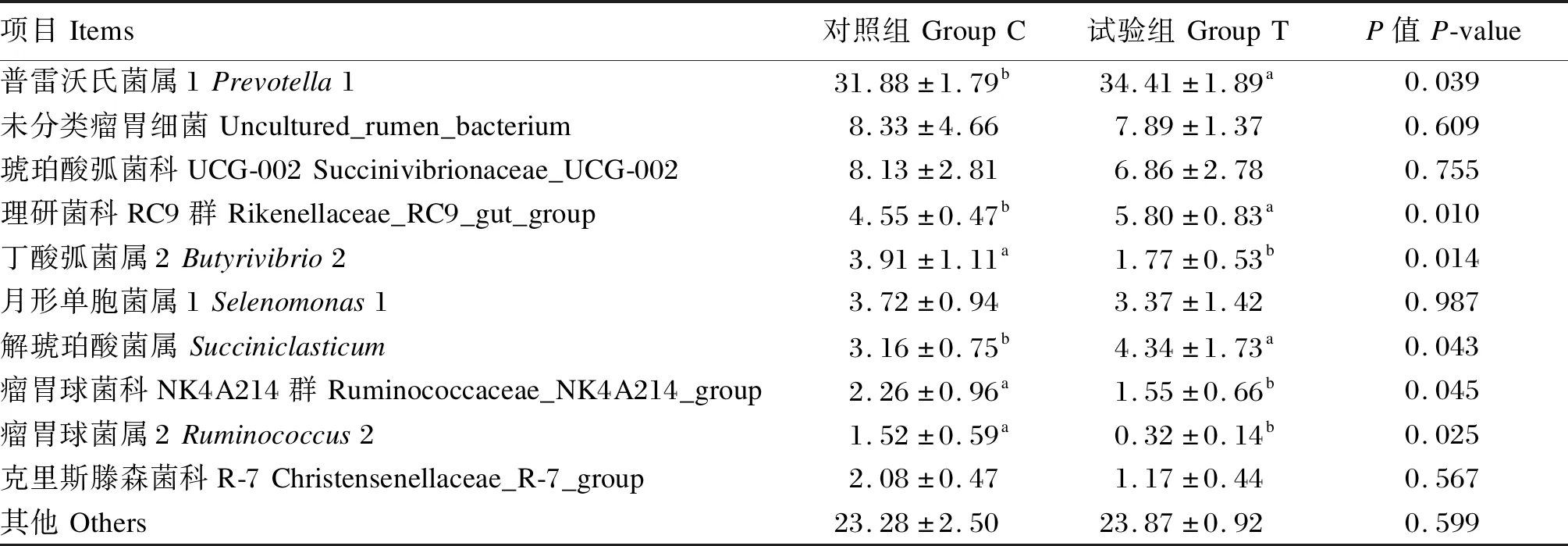
表6 青蒿提取物对瘤胃菌群相对丰度的影响(属水平)Table 6 Effects of Artemisia annua L.extract on relative abundance of rumen microflora (genus level) %
2.2.3 青蒿提取物对奶牛瘤胃液细菌组成影响相似性分析
通过β-多样性分析,评估2组之间菌群结构的差异性。图6为基于非加权距离算法的PCoA,坐标轴1和坐标轴2分别占总变异量的50.07%和14.21%。ANOSIM的R值为0.57,说明对照组与试验组之间的菌群结构存在显著差异(P<0.05)。
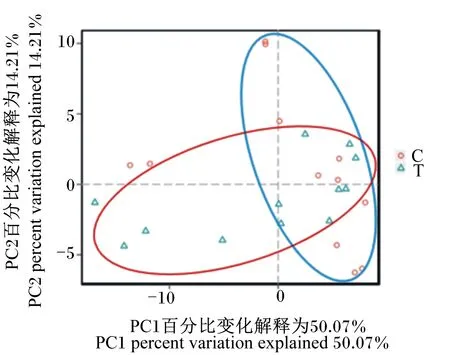
图6 PCoA聚类分析Fig.6 PCoA cluster analysis
2.2.4 青蒿提取物对奶牛瘤胃细菌组成与发酵参数的相关性分析
图7展示了奶牛瘤胃细菌属水平相对丰度(排名前15的菌属)与发酵参数的相关关系。其中琥珀酸弧菌科UCG-002相对丰度与乙酸(R=0.655,P<0.01)、总挥发性脂肪酸(R=0.627,P<0.01)和丙酸(R=0.508,P<0.01)浓度呈极显著正相关;瘤胃球菌科UCG-014相对丰度与总挥发性脂肪酸浓度呈显著负相关(R=-0.345,P<0.05),与丁酸浓度呈极显著负相关(R=-0.415,P<0.01),与产奶量呈显著正相关(R=0.504,P<0.05);瘤胃球菌属1相对丰度与乙酸浓度呈显著负相关(R=-0.433,P<0.05),与总挥发性脂肪酸(R=-0.345,P<0.05)、丙酸(R=-0.120,P<0.05)浓度呈显著负相关,与产奶量呈显著正相关(R=0.504,P<0.05);普雷沃氏菌科1与乙酸(R=-0.896,P<0.01)、总挥发性脂肪酸(R=-0.585,P<0.01)、NH3-N(R=-0.656,P<0.01)和戊酸(R=-0.449,P<0.01)浓度呈极显著负相关,与乙丙比呈显著负相关(R=-0.193,P<0.05);普雷沃氏菌科UCG-001相对丰度与乙酸浓度呈极显著负相关(R=-0.789,P<0.01),与总挥发性脂肪酸(R=0.480,P<0.05)和异戊酸浓度(R=0.338,P<0.05)呈显著负相关;理研菌科RC9群相对丰度与乙酸(R=-0.531,P<0.01)和总挥发性脂肪酸(R=-0.448,P<0.01)浓度呈极显著负相关,与NH3-N(R=-0.372,P<0.05)和丙酸(R=-0.423,P<0.05)浓度呈显著负相关;琥珀酸菌属相对丰度与乙酸浓度呈极显著负相关(R=-0.486,P<0.01);毛螺菌科NK3A20群相对丰度与乙酸浓度呈显著负相关(R=-0.462,P<0.05);瘤胃球菌科NK4A214群相对丰度与丙酸浓度呈显著负相关(R=-0.368,P<0.05)。
3 讨 论
3.1 饲喂青蒿提取物对奶牛瘤胃发酵参数的影响
瘤胃液pH是反映瘤胃健康的直接指标,其与饲粮组成和添加剂类型的关联密切,反映瘤胃内各种有机酸和代谢物产生与吸收的情况[15]。奶牛瘤胃液正常pH在5.5~6.8[16],本试验中各组瘤胃液pH均处于正常生理范围内,这与苏汉书等[12]在奶牛瘤胃体外发酵的研究结果一致。此外,在山羊的基础饲粮中添加青蒿提取物,发现青蒿提取物对山羊瘤胃液pH无显著影响[17],这也印证了奶牛饲粮中添加青蒿提取物不会改变瘤胃内的酸碱平衡。
瘤胃中NH3-N是微生物菌体蛋白(MCP)合成的原料,是反映瘤胃微生物生长情况的指标,NH3-N浓度在10~50 mg/dL最适宜瘤胃微生物生长[18]。本试验中,瘤胃中NH3-N浓度在此范围内,并且在青蒿提取物0.25%和0.50%的添加水平下NH3-N浓度相对于对照组显著提高,而在0.75%的添加水平下无显著变化,说明青蒿提取物在一定程度上可以促进瘤胃NH3-N的合成,这与秦韬等[19]的研究结果一致。瘤胃内NH3-N浓度与MCP的含量密切相关,可以推测青蒿提取物能提高瘤胃微生物的活性,促进蛋白分解菌的生长,进而促进MCP和NH3-N的生成。
瘤胃内碳水化合物发酵后生成VFA,其主要包括丙酸、丁酸、乙酸、异丁酸、戊酸、异戊酸等,均是奶牛主要的能量来源[20],乙酸、丙酸和丁酸约占总挥发性脂肪酸浓度95%以上,乙酸是反刍动物合成脂肪的前体,是动物合成乳脂的主要成分,丁酸也可作为乳腺和脂肪组织合成脂肪酸的原料,丙酸经肝脏糖原异生作用生成葡萄糖为机体供能,丙酸比例越高,其可为机体提供的能量就越高[21]。有研究报道,在反刍动物饲粮中添加青蒿提取物可以提高瘤胃内乙酸、丙酸、丁酸和总挥发性脂肪酸浓度[22],在本试验中,添加0.75%的青蒿提取物显著降低了瘤胃内乙酸浓度和乙丙比,总挥发性脂肪酸、丙酸和丁酸浓度显著增加,这与王小晶等[23]的研究结果一致。这说明在奶牛饲粮中添加青蒿提取物可以促进瘤胃发酵,改变瘤胃内VFA的比例。
3.2 饲喂青蒿提取物对奶牛瘤胃微生物区系的影响
研究表明,当样本覆盖率达到97%以上时,说明测序样本取样充分[24],本试验中样本覆盖率高于99%,证明本次测序结果能够真实地反映奶牛瘤胃微生物种类和结构多样性。报道指出,奶牛瘤胃微生物区系的种类和数量与奶牛种类、饲粮及添加剂种类有关[3]。研究表明,采用ITS高通量测序和16S rRNA高通量测序对瘤胃微生物进行分析能得到612~1 797个OTU[25-26],本试验测得试验奶牛瘤胃微生物区系共969个,处于两者之间,这说明添加青蒿提取物改变了奶牛的瘤胃细菌区系的种类和数量,试验中2组共有964个OTU,青蒿提取物组独有5个OTU。Shannon指数和Simpson指数反映瘤胃微生物区系的多样性,Shannon指数越大或Simpson指数越小时微生物区系越高;Ace指数和Chao1指数反映瘤胃微生物区系的丰富度,Ace指数和Chao1指数越大,微生物区系越丰富[27]。本试验中Shannon指数和Simpson指数无显著变化,Ace指数和Chao1指数显著提高,说明青蒿提取物不影响瘤胃微生物的多样性,但会增加其丰富度。
奶牛瘤胃微生物中优势菌门为拟杆菌门和厚壁菌门[28-29],本试验中奶牛瘤胃优势菌门也为拟杆菌门和厚壁菌门。饲粮中的非纤维性碳水化合物主要依靠拟杆菌门细菌降解[30],而纤维降解主要依靠厚壁菌门细菌[31],如溶纤维丁酸弧菌和解纤维梭菌等。Zened等[32]研究发现,奶牛瘤胃内细菌的优势菌门不会因饲粮改变而改变,始终为拟杆菌门和厚壁菌门。本试验中,添加青蒿提取物后拟杆菌门相对丰度显著下降,厚壁菌门相对丰度无显著变化,说明青蒿提取物抑制了拟杆菌门微生物的生长与增殖。研究表明,变形菌门可降解可溶性碳水化合物[33],本试验添加青蒿提取物后变形菌门相对丰度显著增加,说明青蒿提取物能促进奶牛瘤胃可溶性碳水化合物的降解,这也解释了总挥发性脂肪酸浓度显著升高的原因。SR_[Absconditabacteria]和疣微菌门相对丰度与哺乳动物胃肠道免疫有显著关系[34-35],本试验中SR_[Absconditabacteria]和疣微菌门相对丰度在添加青蒿提取物后显著下降,这表明在饲粮中添加青蒿提取物可能与增强机体免疫力有关,这也印证了前期本试验中青蒿提取物可以提高奶牛免疫能力的试验结果。

每2个变量之间的相关强度用颜色和*表示,红色表示正相关,蓝色表示负相关,*表示0.01 在属水平上,奶牛瘤胃内微生物优势菌属为普雷沃氏菌属、琥珀酸菌属和理研菌属[36-37],这与本研究结果一致,普雷沃氏菌属于拟杆菌门,在瘤胃中分布广泛,数量多,包括半纤维素分解菌和蛋白分解菌,如栖瘤胃普雷沃菌、布氏普雷沃氏菌和短普雷沃氏菌等,其可降解植物性半纤维素、蛋白质、非纤维多糖、参与多种微生物代谢[38],本试验添加青蒿提取物后,奶牛瘤胃液中普雷沃氏菌属相对丰度显著提高,说明添加青蒿提取物在一定程度上促进了奶牛瘤胃内蛋白质的分解利用,影响瘤胃内NH3-N和总挥发性脂肪酸浓度,这与瘤胃发酵常规指标的结果相一致。理研菌科与自身免疫有关[39],本试验中添加青蒿提取物后瘤胃液中理研菌科RC9群相对丰度显著增加,这可能与青蒿提取物改变奶牛免疫性能有关。丁酸弧菌属也是瘤胃中分解利用纤维素的菌属[40],饲喂青蒿提取物后瘤胃液中丁酸弧菌属2相对丰度显著下降可能是由于其他降解纤维素菌的增加,导致丁酸弧菌属2的竞争优势降低,进而比例下降。解琥珀酸菌属可以将瘤胃微生物分解碳水化合物后产生的琥珀酸代谢成丙酸盐,进而生成丙酸[41],添加青蒿提取物后瘤胃液中解琥珀酸菌属相对丰度显著上升,这可能是导致瘤胃液中丙酸浓度显著上升的主要原因。瘤胃球菌属在瘤胃中可以降解粗饲料中的纤维素、半纤维素和木质素,产生大量的纤维素酶和木聚糖酶,通过酶作用生成乙酸[42]。添加青蒿提取物后瘤胃球菌科NK4A214群和瘤胃球菌属2相对丰度显著下降,导致瘤胃液中乙酸浓度下降,这与前人研究结果[27]相同。本试验发现,普雷沃氏菌属1和理研菌科RC9群相对丰度与总挥发性脂肪酸浓度呈极显著负相关,说明这2种菌可能参与总挥发性脂肪酸的代谢,这与程冠文[43]研究结果相一致。同时,瘤胃球菌属1、普雷沃氏菌属1、普雷沃氏菌科UCG-001、理研菌科RC9群和琥珀酸菌属相对丰度与乙酸浓度呈负相关,这些菌属促进了乙酸的代谢,影响了乙丙比,这也揭示了本研究中瘤胃液中乙酸浓度显著降低的原因。瘤胃球菌科UCG-014和瘤胃球菌属1与调节机体免疫有关[44-45],在本试验中2种菌属相对丰度与产奶量呈显著正相关,表明这2种菌属可能通过调节机体免疫力以促进奶牛产奶。综上可知,青蒿提取物可以通过改善瘤胃微生物相对丰度,调节瘤胃发酵,进而提高奶牛机体免疫能力和产奶量。 在奶牛饲粮中添加0.75%青蒿提取物显著提高Ace指数和Chao1指数,使变形菌门、普雷沃氏菌属1、理研菌科RC9群等相对丰度显著提高,拟杆菌门、丁酸弧菌属2等相对丰度显著降低;降低瘤胃中乙酸浓度和乙丙比,提高总挥发性脂肪酸、丙酸、丁酸和戊酸浓度,对瘤胃发酵和微生物结构变化有积极作用。 Prevotella1:普雷沃氏菌属1;Uncultured rumen_bacterium:未分类瘤胃细菌;Succinivibrionaceae_UCG-002:琥珀酸球菌科UCG-002;Rikenellaceae_RC9_gut_group:理研菌科RC9群;Succiniclasticum:解琥珀酸菌属;Selenomonas1:月形单胞菌属1;Butyrivibrio2:丁酸弧菌属2;Ruminococcus2:瘤胃球菌属2;Christensenellaceac_R-7_group:克里斯滕森菌科R-7群;Ruminococcaceae_NK4A214_group:瘤胃球菌科NK4A214群;Others:其他;Unclassified:未分类。 [39] NGUYEN Q D,TSURUTA T,NISHINO N.Examination of milk microbiota,fecal microbiota,and blood metabolites of Jersey cows in cool and hot seasons[J].Animal Science Journal,2020,91(1):e13441. [40] PALEVICH N,KELLY W J,LEAHY S C,et al.Comparative genomics of rumenButyrivibriospp.uncovers a continuum of polysaccharide-degrading capabilities[J].Applied and Environmental Microbiology,2019,86(1):e01919-e01993. [41] VAN GYLSWYK N O.Succiniclasticumruminisgen.nov.,sp.nov.,a ruminal bacterium converting succinate to propionate as the sole energy-yielding mechanism[J].International Journal of Systematic Bacteriology,1995,45(2):297-300. [42] LEE C G,BABA Y,ASANO R,et al.Identification of bacteria involved in the decomposition of lignocellulosic biomass treated with cow rumen fluid by metagenomic analysis[J].Journal of Bioscience and Bioengineering,2020,130(2):137-141. [43] 程冠文.日粮碳水化合物类型调控瘤胃发酵乙/丙比的机制研究[D].硕士学位论文.泰安:山东农业大学,2019. CHENG G W.Study on the mechanism of dietary carbohydrate types Regulating C2/C3 ratio in rumen fermentation[D].Master’s Thesis.Tai’an:Shandong Agricultural University,2019.(in Chinese) [44] SCHIRMER M,GARNER A,VLAMAKIS H,et al.Microbial genes and pathways in inflammatory bowel disease[J].Nature Reviews Microbiology,2019,17(8):497-511. [45] SUN Z G,HU Y H,WANG Y G,et al.BupiHeweidecoction ameliorates 5-fluorouracil-induced intestinal dysbiosis in rats through T helper 17/T regulatory cell signaling pathway[J].Journal of Traditional Chinese Medicine,2020,40(1):38-48.4 结 论
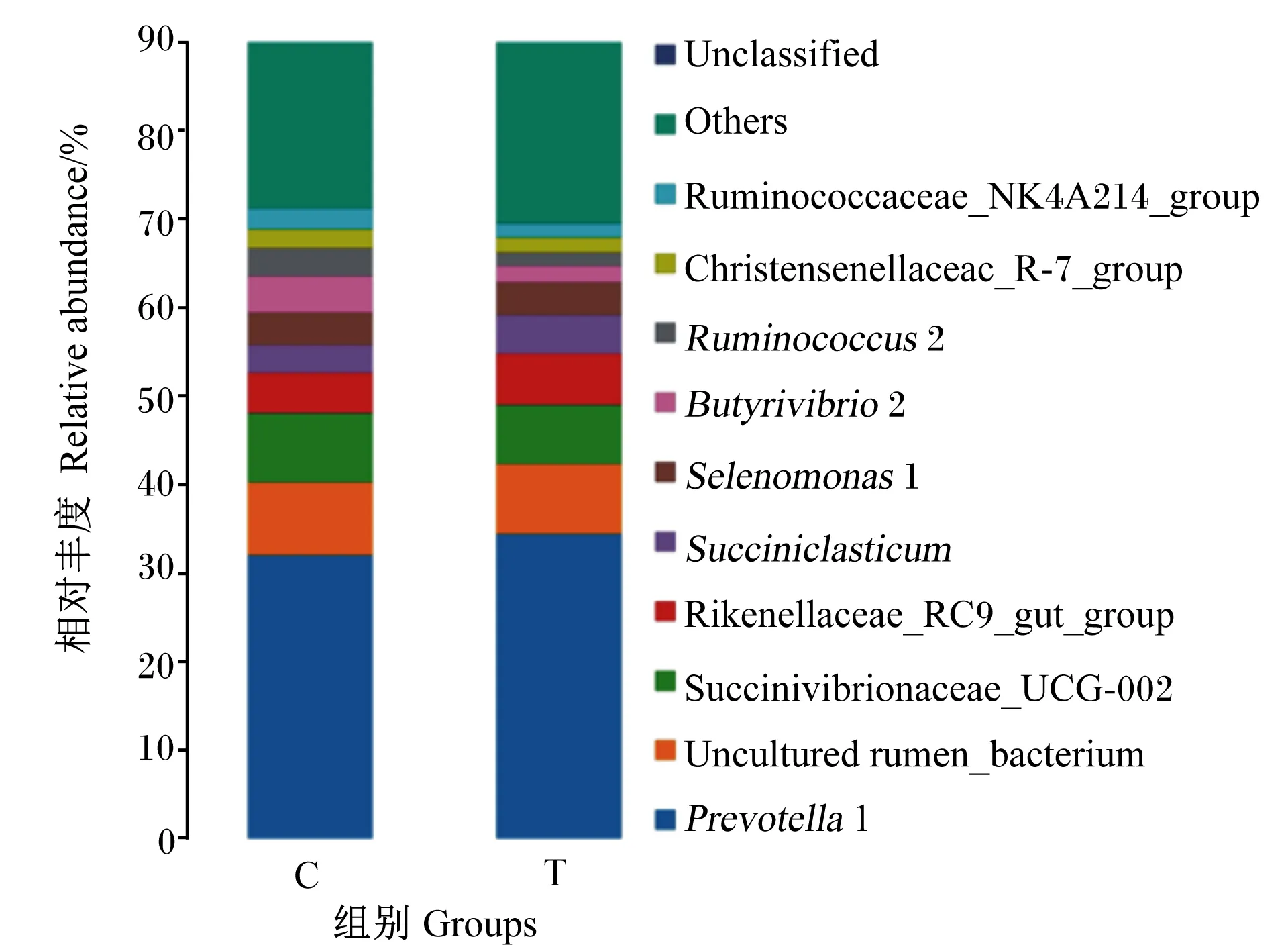
图5 属水平上青蒿提取物对奶牛瘤胃液细菌区系组成的影响
Fig.5 Effects ofArtemisiaannuaL.extract on bacterial flora composition in rumen fluid of dairy cows at genus level

