不同剩余采食量下滩羊能量代谢分析
张 倩 王俊奎 罗 芳 和东迁 陈丽尧 卢童童 吴少飞 张瑞雪 陶金忠
(宁夏大学农学院,银川 750021)
剩余采食量(RFI)是衡量反刍动物饲料转化率的主要指标,是指畜禽实际采食量和预期采食量的差值,可以用来有效评价动物饲料转化率、群体代谢水平以及选育标准[1]。关于RFI的相关研究涉及到诸多方面,如干物质采食量(DMI)、饲料消化率、机体合成与分解代谢、运动量以及体温调节等[2]。Patience[3]发现育成猪的每日干物质采食量中34%的能量用于机体维持需要。从节约饲养成本的角度来看,降低动物的维持需要,能够提高饲料的转化效率。Arthur等[4]和Richardson等[5]用超声波扫描技术测定了安格斯牛皮下脂肪厚度,结果发现低RFI的个体体脂含量更低,体蛋白质含量更髙,且背膘厚度与RFI显著相关。RFI的高低反映了动物的饲料利用率,即RFI越高的个体,其饲料转化效率越低、代谢越快、采食次数越多、活动量越大[6-7]。能量代谢的途径是从葡萄糖开始,由己糖激酶和葡萄糖-6-磷酸酶介导生成葡萄糖-6-磷酸[8],再由磷酸己糖异构酶的催化形成果糖-6-磷酸,之后生成丙酮酸进入三羧酸循环(TCA)供能。饲料转化效率和体内能量代谢是否相关,目前还不清楚。
反刍动物的RFI是根据个体体重和生长[平均日增重(ADG)]的需求估算的。RFI在表型上与体重和ADG无关,但与采食量有关,因此对RFI的表型测定是一项亟待解决的问题,因为它需要测量每个个体2~3个月的采食量,需要投入巨大的时间、金钱、物力和人力,并且受到记录方法和设备仪器等的限制[9]。
代谢组学是一种运用高通量、高灵敏度的现代分析技术[10],是以相对分子质量在1 000以下的小分子代谢物为研究对象,包括内源性和外源性分子,可以反映个体、器官组织及细胞代谢所产生的小分子代谢图谱,能更为直接地反映当前代谢的复杂网络,将代谢途径同生物机制相联系,从而对疾病的诊断、发病机制的研究以及疾病的治疗和预防提供新的技术和手段[11]。代谢组学研究揭示的不仅仅是遗传学或基因组学提供的信息,更揭示了动物遗传学和生理表型之间的关系[12]。Clemmons等[13]研究表明,泛酸盐、谷氨酰胺、肉碱和半胱氨酸等差异代谢物与黑安格斯的营养代谢密切相关,可以以泛酸盐、谷氨酰胺、肉碱和半胱氨酸等差异代谢物作为生物标志物来解释黑安格斯的RFI。运用代谢组学研究反刍动物RFI,不但可以提高反刍动物的饲料转化效率,还可以识别血浆中的潜在生物标志物,但目前在羊上没有看到相关的研究。因此,本试验拟采用液相色谱-串联质谱(LC-MS/MS)技术分析不同RFI下滩羊血浆中能量代谢相关代谢物的变化,筛选出对滩羊RFI有影响作用的差异代谢物,以探究在不同RFI下滩羊能量代谢情况,并为使用差异代谢物作为标志性物质预测RFI提供参考。
1 材料与方法
1.1 试验动物
于宁夏某滩羊保种场选用345只[公羊163只、母羊182只(在饲养过程中会淘汰生病、体重不合格的羊只)]具有详细系谱信息、出生日期相近、生长状况良好、体重[(30±5)kg]相近的6月龄滩羊,统一饲养管理,每天早晚各投喂1次颗粒料,控制采食时间范围,自由饮水。试验分为过渡期15 d,预试期10 d,正试期50 d。准确记录每只羊每天的剩料量,并于正试期第1、10、20、30、40、50天晨饲前空腹称重,定期对圈舍进行清扫消毒。
1.2 试验分组
饲养阶段结束后,利用Koch等[14]提出的预测RFI模型计算个体全期RFI值(第1~50天的RFI),按照群体RFI的平均值(mean)和标准差(SD)将试验羊群分成极低RFI组(RFI

表1 采样滩羊的RFI数据Table 1 RFI data of sampling Tan sheep
1.3 样品采集
饲养试验结束后,对所选的极低和极高RFI滩羊进行颈部采血,将10 mL血液置于抗凝管(含肝素钠)中。对采集后血液样品进行3 000 r/min离心10 min,将上层血浆分装,保存于-80 ℃冰箱。
1.4 仪器与试剂


表2 所需试剂Table 2 Required reagents
1.5 样品预处理
因部分样品发生溶血现象,故共检测到26份血浆样品,其中公羊、母羊各检测13份。将血浆样品从-80 ℃冰箱中取出,在冰上解冻后,涡旋10 s混匀,4 ℃、3 000 r/min离心5 min;取上清液50 μL加入到对应的已编号的离心管中,加入150 μL纯甲醇内标提取液;涡旋5 min后4 ℃、12 000 r/min离心10 min;取140 μL上清液装入对应进样瓶内衬管中,用于LC-MS/MS分析。
1.6 LC-MS/MS分析
电喷雾离子源(electrospray ionization,ESI)温度450 ℃,质谱电压5 500 V(正)、-4 500 V(负),离子源气体Ⅰ(GSⅠ)40 psi,气体Ⅱ(GSⅡ)55 psi,气帘气(curtain gas,CUR)35 psi,碰撞诱导电离(collision-activated dissociation,CAD)参数设置为中。在三重四极杆(QTRAP)中,每个离子对是根据优化的去簇电压(declustering potential,DP)和碰撞能(collision energy,CE)进行扫描检测[15]。
1.7 数据处理与分析
将质谱检测的原始数据在R Studio软件平台,采用XCMS软件对数据进行特征峰提取,峰对齐,保留时间(retention time,RT)校正以及数据过滤,提取峰面积。将经XCMS软件提取的数据进行完整性检查,对组内缺失值进行删除或补充,删除极值及组内缺失值超过50%的代谢物离子峰,数据以内标校正后进行总峰面积归一化处理,以确保各样品间和代谢物之间的可平行比较。对数据进行总峰面积归一化后,使用SIMCA-P 14.1软件中对数据进行pareto-scaling处理后,进行多元统计分析,包括主成分分析(principal component analysis,PCA)和正交偏最小二乘判别分析(orthogonal partial least squares discrimination analysis,OPLS-DA);同时,在建模过程中对模型数据进行置换检验(permutation test)并计算变量投影重要度(variable important for the projection,VIP)。在此基础上对数据进行单变量统计分析,包括Student’st检验和变异倍数(fold change,FC)分析,根据各代谢物P值和FC值筛选差异代谢物。
2 结果与分析
2.1 滩羊血浆样品质控(QC)分析
将QC样品在正、负离子检测模式下的质谱总离子流(TIC)图进行谱图叠加比较(图1),结果表明,代谢物检测总离子流的曲线重叠性高,即保留时间和峰强度均一致,表明质谱对同一样品不同时间检测时,信号稳定性较好。整个试验过程中仪器误差引起的变异较小,数据质量可靠。
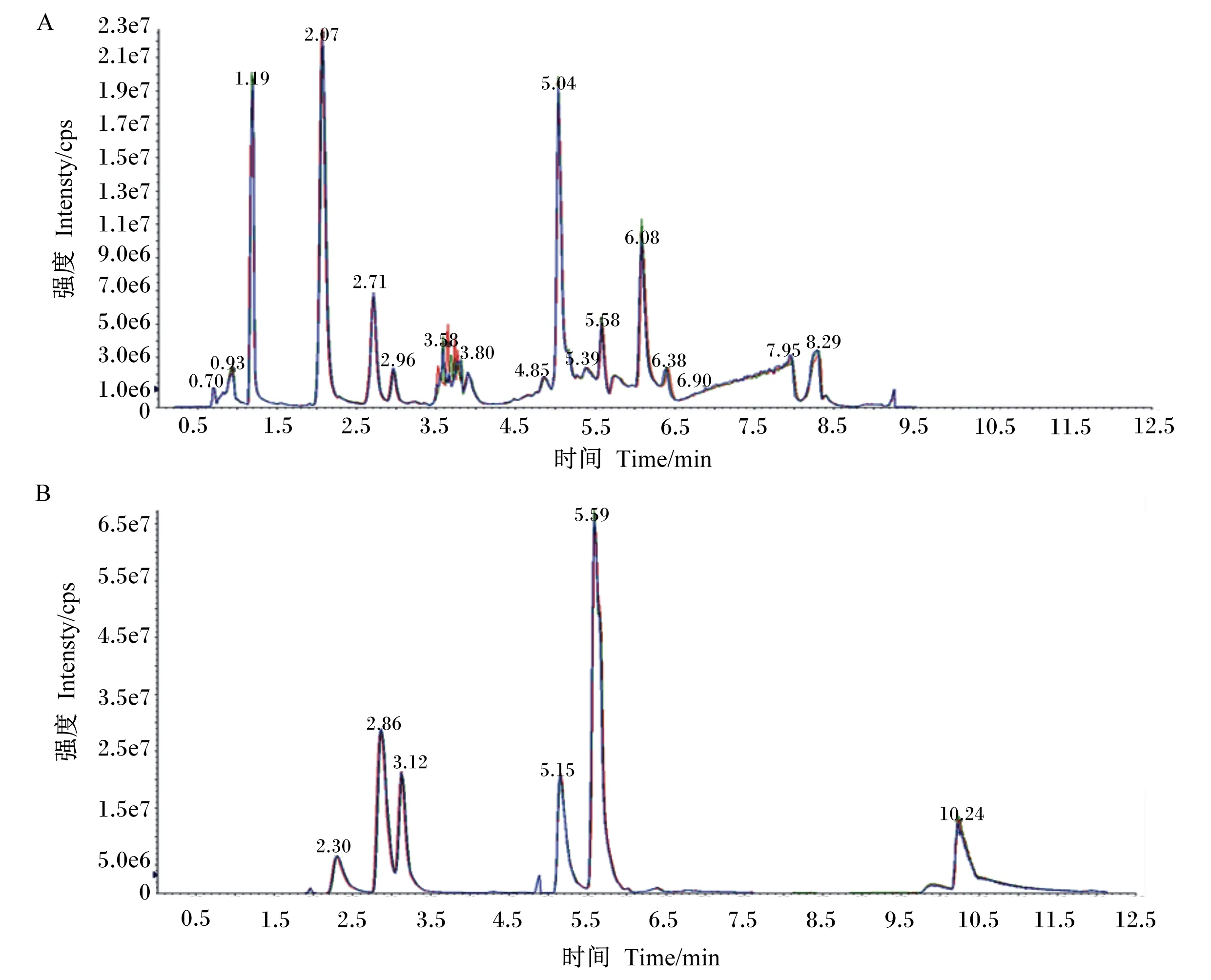
图1 QC样品在正离子(A)和负离子模式(B)下TIC重叠图谱Fig.1 TIC overlapping patterns of QC samples in positive (A)and negative ion modes (B)
2.2 多元统计分析
PCA模型参数R2X、Q2分别表示模型对X变量的解释率和模型预测能力。通过对不同组样品数据进行PCA(图2)可知,极低RFI母羊vs极高RFI母羊组、极低RFI公羊vs极高RFI公羊组、极低RFI羊vs极高RFI羊组的模型解释率(R2X)分别为0.235、0.351、0.145,聚类较好,有一定的分离趋势,说明代谢物检测系统的稳定性较好。
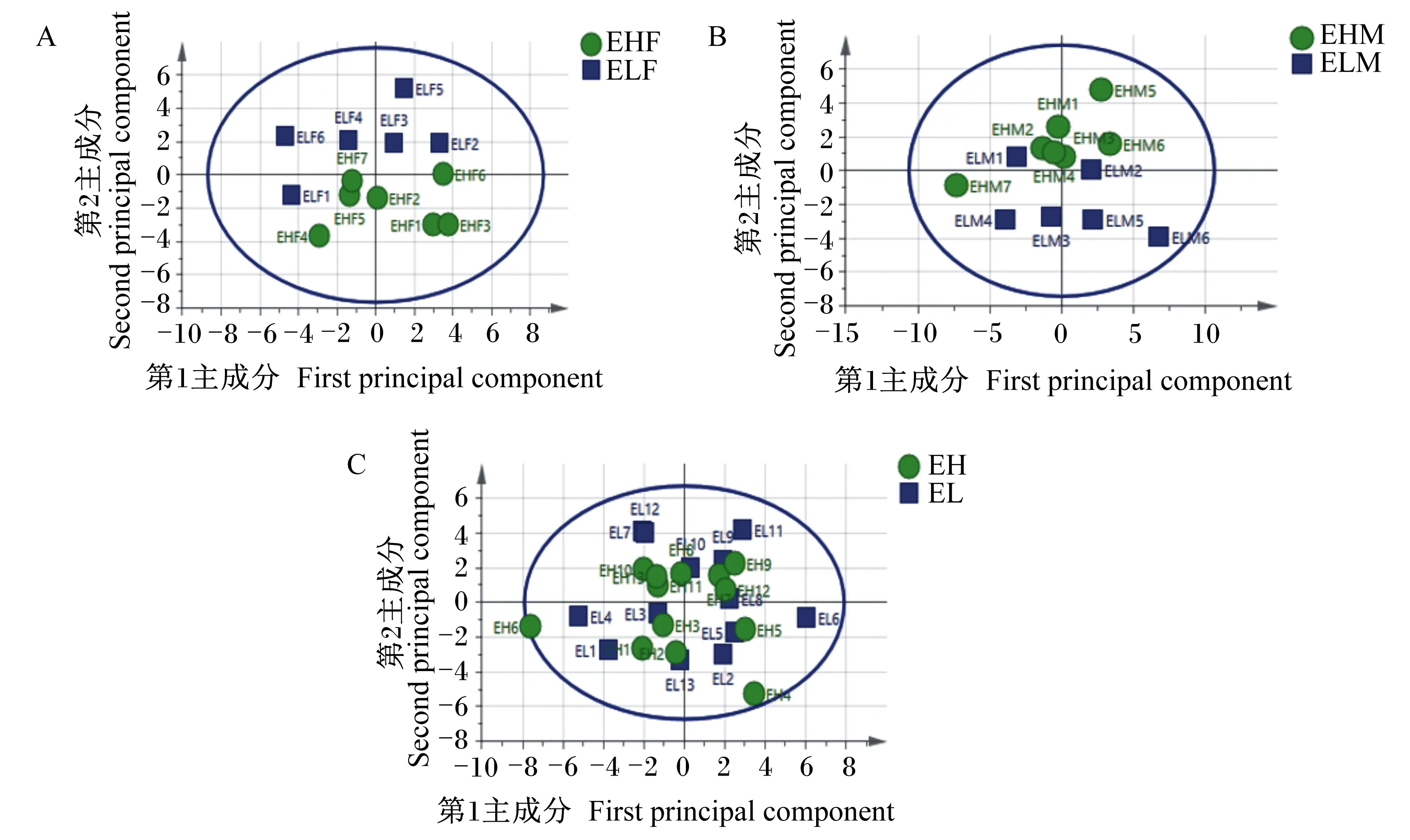
ELF与EHF分别表示极低RFI母羊与极高RFI母羊,ELM与EHM分别表示极低RFI公羊与极高RFI公羊,EL与EH分别表示极低RFI羊与极高RFI羊。下图同。图A、B、C分别为极低RFI母羊vs极高RFI母羊组、极低RFI公羊vs极高RFI公羊组和极低RFI羊vs极高RFI羊组PCA得分图。ELF and EHF denoted very low RFI ewes and very high RFI ewes,respectively;ELM and EHM denoted very low RFI rams and very high RFI rams,respectively;EL and EH denoted very low RFI sheep and very high RFI sheep,respectively.The same as below.Figures A,B and C represented PCA score plots of very low RFI ewes vs very high RFI ewes group,very low RFI rams vs very high RFI rams group and very low RFI sheep vs very high RFI sheep group,respectively.图2 3组滩羊PCA得分图Fig.2 PCA score plots of Tan sheep in three groups
为了提高模型的有效性,直接区分组间变异进行了OPLS-DA,结果见图3。在OPLS-DA得分图下,各组样品区分良好。由置换检验模型(图4)可知,极低RFI母羊vs极高RFI母羊组Q2截距=-0.432(Q2截距<0),极低RFI公羊vs极高RFI公羊组Q2截距=-0.346(Q2截距<0),极低RFI羊vs极高RFI羊组Q2截距=-0.516(Q2截距<0),表明OPLS-DA模型未过度拟合,说明各样品间存在差异。
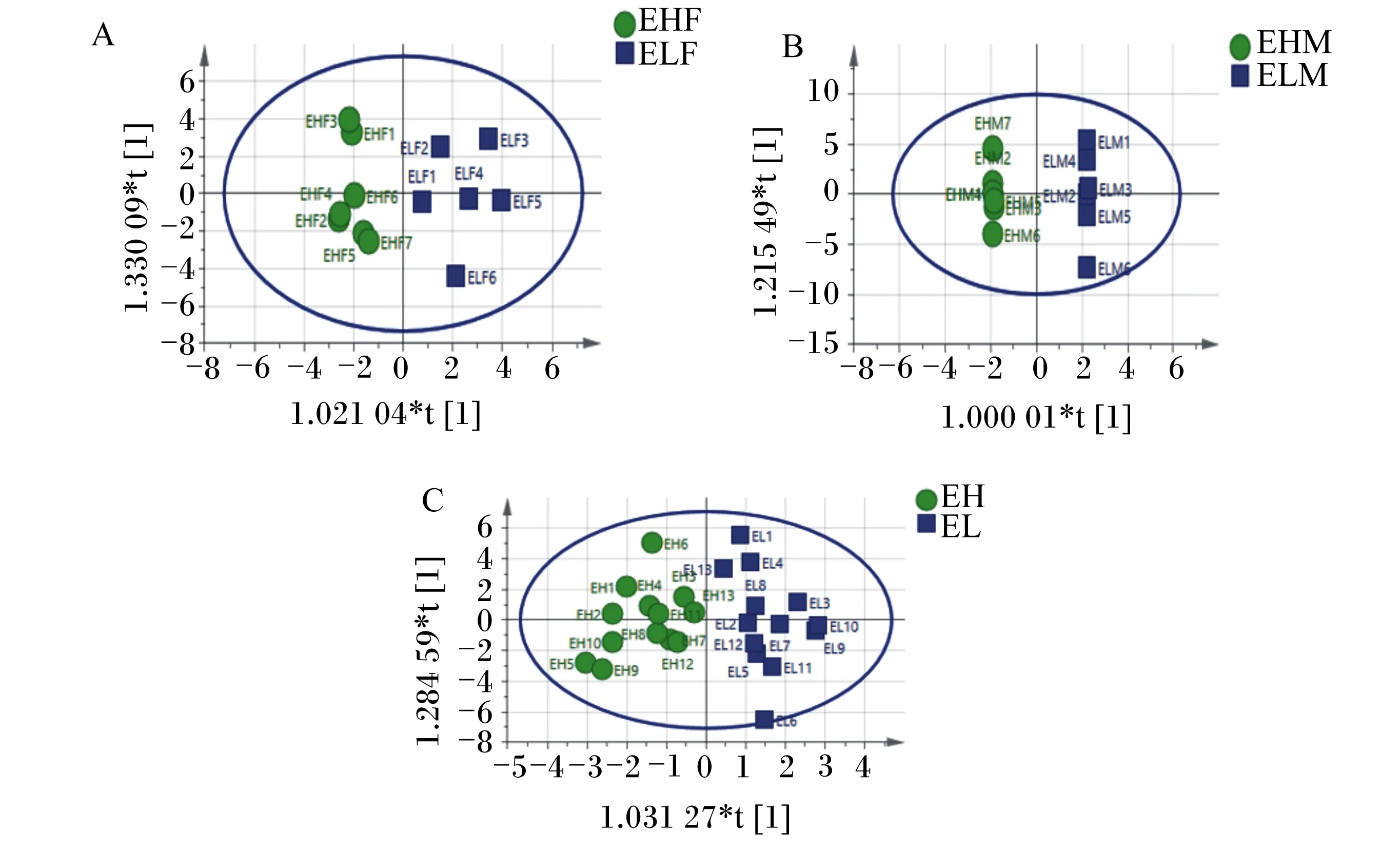
图A、B、C分别为极低RFI母羊vs极高RFI母羊组、极低RFI公羊vs极高RFI公羊组和极低RFI羊vs极高RFI羊组OPLS-DA得分图。Figures A,B and C represented OPLS-DA score plots of very low RFI ewes vs very high RFI ewes group,very low RFI rams vs very high RFI rams group and very low RFI sheep vs very high RFI sheep group,respectively.图3 3组滩羊OPLS-DA得分图Fig.3 OPLS-DA score plots of Tan sheep in three groups
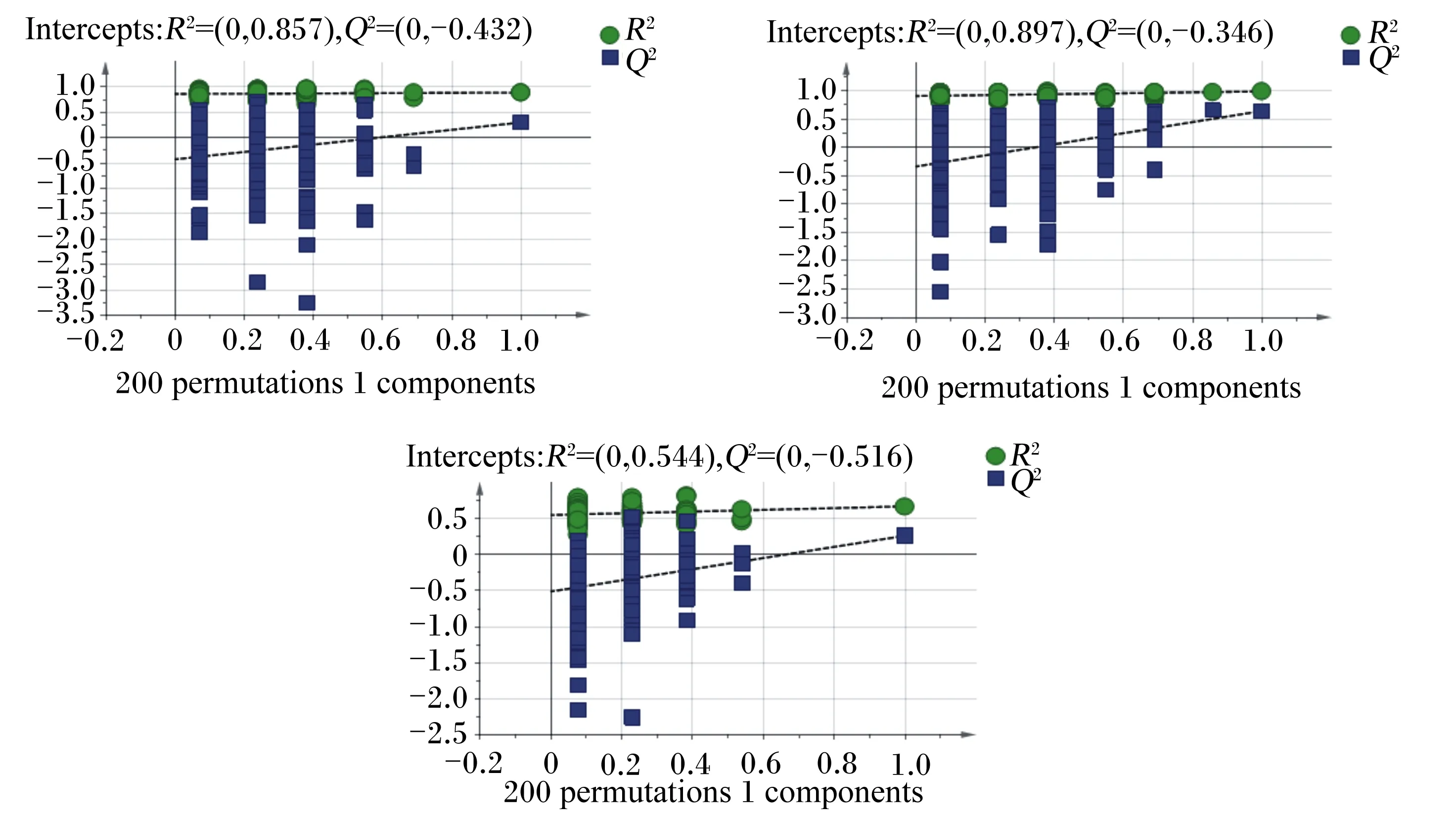
R2 intercept和Q2 intercept表示R2与Q2回归直线与Y轴的截距,Q2 intercept<0表明OPLS-DA模型未过度拟合。横坐标代表随机分组的Y与原始分组的Y的相关性,纵坐标代表R2与Q2得分。图A、B、C分别为极低RFI母羊vs极高RFI母羊组、极低RFI公羊vs极高RFI公羊组和极低RFI羊vs极高RFI羊组置换检验分析图。R2 intercept and Q2 intercept represented the Y-intercept of R2 and Q2 regression lines.Q2 intercept<0 indicated that the OPLS-DA model was not overfitting.The abaxial axis represented the correlation between the random group Y and the original group Y,and the vertical axis represented the scores of R2 and Q2.Figures A,B and C represented replacement test analysis diagrams of very low RFI ewes vs very high RFI ewes group,very low RFI rams vs very high RFI rams group and very low RFI sheep vs very high RFI sheep group,respectively.图4 3组滩羊OPLS-DA置换检验Fig.4 OPLS-DA replacement test of Tan sheep in three groups
2.3 差异代谢物筛选
本试验结合多元统计分析,利用OPLS-DA计算所得VIP,以VIP>1、P<0.05及FC>1.30或<0.77为标准筛选差异代谢物,并对其进行鉴定,结果如表3所示。本试验在极低RFI公羊vs极高RFI公羊组中共筛选鉴定出2种差异代谢物,为D-木酮糖-5-磷酸和L-鸟氨酸盐酸盐,均下调;在极低RFI母羊vs极高RFI母羊组中共筛选鉴定出4种差异代谢物,其中3种上调,上调物质分别为腺嘌呤、柠檬酸、L-天冬氨酸,1种下调,下调物质为L-瓜氨酸;在极低RFI羊vs极高RFI羊组中共筛选鉴定出4种差异代谢物,其中2种上调,上调物质分别为腺嘌呤、柠檬酸,2种下调,下调物质分别为L-苏氨酸、D-木酮糖-5-磷酸。
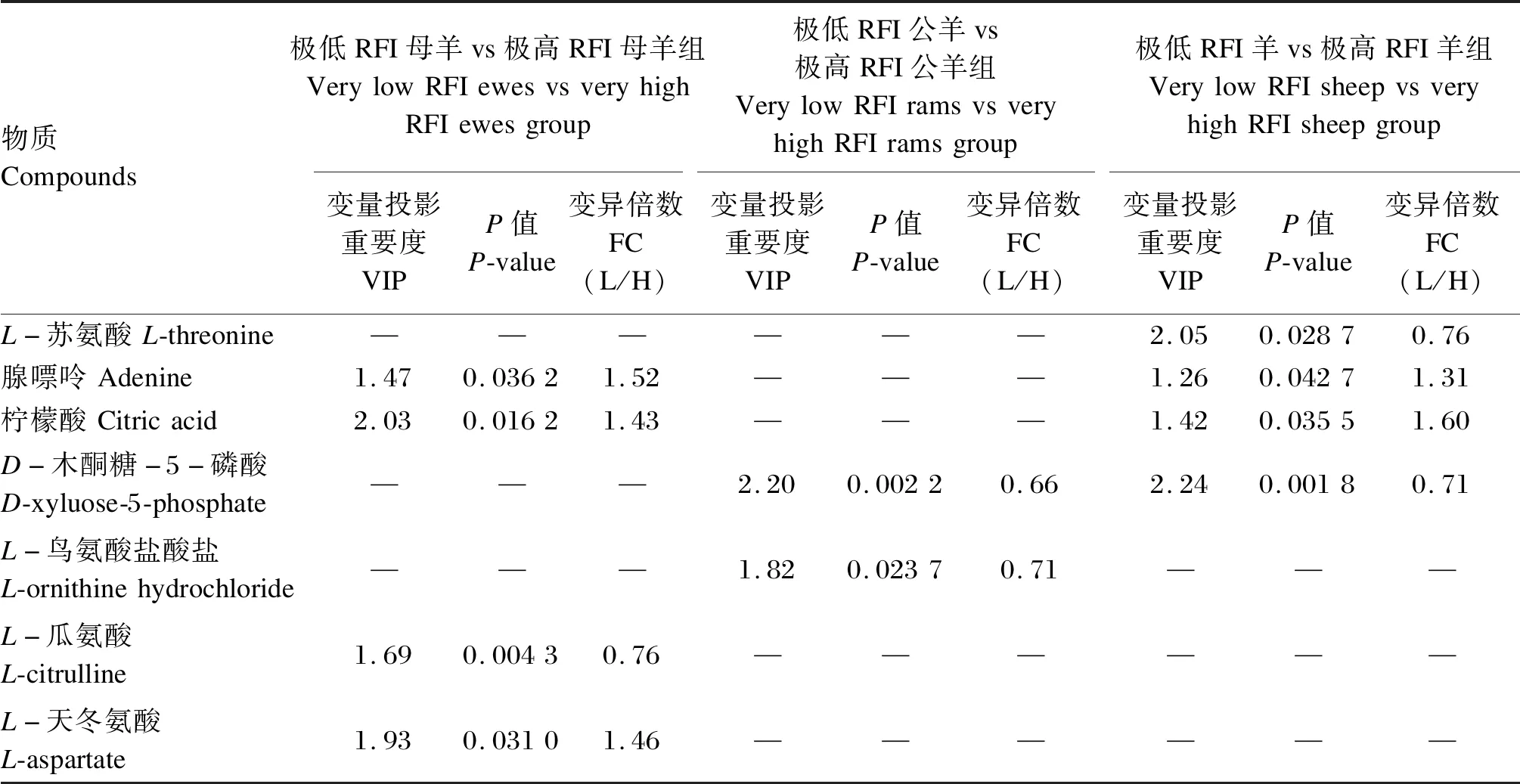
表3 已鉴定差异代谢物Table 3 Identified differential metabolites
2.4 差异代谢物聚类分析
将筛选出的差异代谢物利用Metabo Analyst 5.0在线分析平台进行层次聚类,结果如图5所示。结果表明,多数样品能很好地聚集在一起,但个别样品仍然存在分离情况,表明组内有差异,但具有相似变化的代谢物可以聚集在同一族内。因此,进一步采用受试者工作特征(ROC)曲线对筛选出的差异代谢物进行进一步分析,筛选出ROC曲线下面积(AUC)>0.90的差异代谢物。图6显示,极低RFI母羊vs极高RFI母羊组中柠檬酸AUC达到0.90以上,P<0.05,说明柠檬酸是识别母羊组的主要指标,但不能作为识别滩羊整体的主要指标。利用液相色谱-四级杆-飞行时间质谱(LC-Q/TOF-MS)峰强箱式图对极低RFI母羊vs极高RFI母羊组的柠檬酸含量进行进一步分析,结果如图7所示,柠檬酸能明显分开极高RFI母羊和极低RFI母羊。
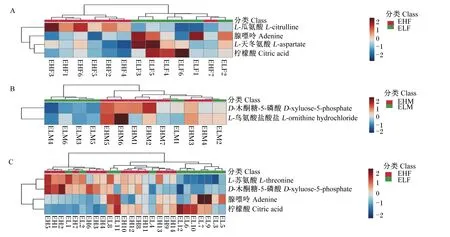
图A、B、C分别为极低RFI母羊vs极高RFI母羊组、极低RFI公羊vs极高RFI公羊组和极低RFI羊vs极高RFI羊组聚类热图。Figures A,B and C represented clustering heat maps of very low RFI ewes vs very high RFI ewes group,very low RFI rams vs very high RFI rams group,and very low RFI sheep vs very high RFI sheep group,respectively.图5 3组滩羊差异代谢物聚类热图Fig.5 Clustering heat maps of differential metabolites of Tan sheep in three groups
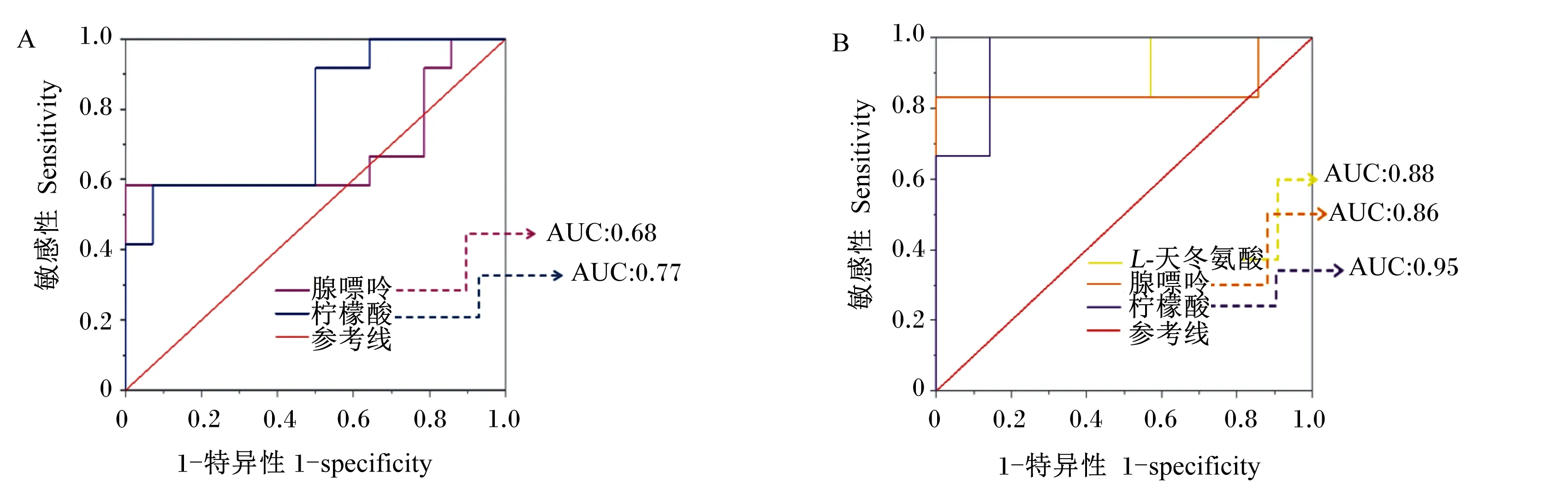
图A、B依次为极低RFI羊vs极高RFI羊组和极低RFI母羊vs极高RFI母羊组ROC曲线。AUC:ROC曲线下面积。The ROC curves of very low RFI sheep vs very high RFI sheep group and very low RFI ewes vs very high RFI ewes group were shown successively in figures A and B.AUC:area under curve.图6 极低RFI羊vs极高RFI羊组和极低RFI母羊vs极高RFI母羊组ROC曲线Fig.6 ROC curves of very low RFI sheep vs very high RFI sheep group and very low RFI ewes vs very high RFI ewes group
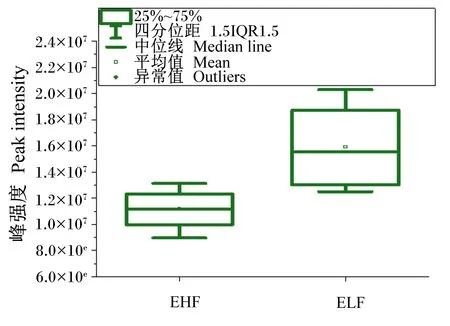
图7 极低RFI母羊vs极高RFI母羊组峰强度箱式图Fig.7 Peak intensity boxplot of very low RFI ewe vs very high RFI ewe group
3 讨 论
Elolimy等[16]研究结果表明性别的差异会影响瘤胃上皮基因溶质载体家族9成员A1(SLC9A1)、缺氧诱导因子1亚单位A(HIF1A)和乌头酸酶2(ACO2)的表达,并且公牛相较于母牛来说mRNA的表达更高,而羟基丁酸脱氢酶1(BDH1)、溶质载体家族9成员A2(SLC9A2)和丙酮酸脱氢酶E1亚单位A1(PDHA1)的表达更低;卢果等[17]通过代谢组学的方法研究36组人尿液样品,研究表明由于性别的不同从而分离出不同的生物标志物,女性尿液中柠檬酸的含量显著高于男性;陈建军[18]研究结果表明抑郁症诊断由于性别差异标志物也有所差异,甘醇酸(glycolate)、次黄嘌呤(hypoxanthine)可作为女性潜在的生物标志物,酪氨酸(tyrosine)、柠檬酸盐(citrate)和琥珀酸盐(succinate)可作为男性潜在的生物标志物,为筛选抑郁症性别差异性诊断标示物提供了进一步研究数据;更有研究表明性别差异会影响药物代谢[19]。本试验利用靶向代谢组学的方法对3组滩羊进行血浆代谢物分析,在极低RFI母羊vs极高RFI母羊组中,共筛选出4种差异代谢物,分别为腺嘌呤、柠檬酸、L-天冬氨酸和L-瓜氨酸;而在极低RFI公羊vs极高RFI公羊组中,共筛选出2种差异代谢物,分别为L-鸟氨酸盐酸盐和D-木酮糖-5-磷酸,结果显示,公、母羊血浆代谢物种类不同是由于性别因素造成的。因此,性别的差异可能会导致血浆代谢物的差异。
在能量代谢过程中柠檬酸是三羧酸循环中的重要物质。Kim等[20]研究发现,柠檬酸可显著降低高脂饮食小鼠肝脏中脂肪的含量。Cheng等[21]研究发现,人类连续7 d服用500 mg/d剂量的柠檬酸,可显著提高骨骼肌中糖原合成率。此外,柠檬酸还可用于脂肪和胆固醇合成,有利于物质消化和营养吸收,维持机体生长发育[22]。本研究发现极低RFI母羊vs极高RFI母羊组和极低RFI羊vs极高RFI羊组筛选的差异代谢物中柠檬酸均上调,即柠檬酸表达量增加,进入能量代谢途径的相关物质含量也相应升高,能量转化的效率也不断增加,释放更多的能量。低RFI滩羊柠檬酸表达量升高,因此低RFI滩羊产生的能量相较于高RFI滩羊更多。这说明低RFI动物在生长潜力方面优于高RFI动物。在本研究中极低RFI母羊vs极高RFI母羊组柠檬酸的AUC大于0.9,说明柠檬酸是识别母羊组的主要指标,有望成为母滩羊RFI的生物标志物。
腺嘌呤核苷酸(三羧酸循环过程中的辅助因子,不在代谢网络图里表现)是机体重要的能量物质[23],L-天冬氨酸是生成草酰乙酸的前体物质。腺嘌呤和L-天冬氨酸在极低RFI母羊vs极高RFI母羊组中均上调。腺嘌呤表达量增加,意味着整个能量代谢的进程加快,释放更多的能量;L-天冬氨酸表达量增加,能够提高整个代谢途径中能量的转化效率,影响着整个能量代谢进程。
瓜氨酸同组氨酸、脯氨酸、鸟氨酸和精氨酸一样都是能量通路中转化为谷氨酸的前体物质,本试验极低RFI母羊vs极高RFI母羊组中L-瓜氨酸下调,虽然对谷氨酸的合成代谢有影响作用,但无法直接影响整个能量代谢过程。因腺嘌呤、L-天冬氨酸和瓜氨酸的AUC均小于柠檬酸,因此不能作为影响母羊组的生物标志物。
D-木酮糖-5-磷酸是磷酸戊糖代谢途径中的代谢物之一,通过磷酸戊糖途径生成葡萄糖进入三羧酸循环。本研究发现在极低RFI公羊vs极高RFI公羊组中D-木酮糖-5-磷酸下调。D-木酮糖-5-磷酸下调是由于核酮糖-5-磷酸在生成D-木酮糖-5-磷酸的同时生成了核糖-5-磷酸(图8),D-木酮糖-5-磷酸进入磷酸戊糖途径的含量减少,但核糖-5-磷酸是用于合成核苷酸的主要前体物,虽然D-木酮糖-5-磷酸表达量的下降并不能直接影响到能量转化效率,但对磷酸戊糖途径有一定的影响。L-鸟氨酸盐酸盐下调,与上述母羊L-瓜氨酸下调表述一致。但由于D-木酮糖-5-磷酸和L-鸟氨酸盐酸的AUC均较低,故不能用作公羊组的生物标志物。
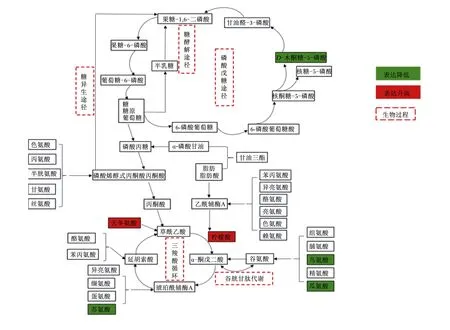
图8 差异代谢物代谢网络图Fig.8 Metabolic network map of differential metabolites
4 结 论
本研究发现不同RFI公与母滩羊的血浆代谢物种类不同,可能是由于性别因素造成的,因此性别也会影响滩羊能量代谢。在极低RFI母羊vs极高RFI母羊组和极低RFI羊vs极高RFI羊组中,极低RFI母羊和极低RFI羊的柠檬酸均上调,而柠檬酸作为三羧酸循环的关键代谢物,可成为影响母滩羊RFI的重要生物标志物。

