3D-CT描述胃周血管腹腔干变异在腹腔镜下胃癌根治术中的作用
厉玲玲,罗建生
(浙江大学医学院附属金华医院影像科,浙江金华 321000)
胃癌是我国最常见的消化道恶性肿瘤之一,以手术治疗为主的综合治疗是胃癌的主要治疗方法。随着微创技术和理念在我国的普及,腹腔镜手术因其创伤小、切口美观、术后恢复快等优点而逐渐推广[1]。然而,临床中尚存在关于腹腔镜胃癌根治术治疗胃癌的一些争议,如:腹腔镜全胃切除术联合D2 淋巴结清扫的手术范围大、是否能满足根治肿瘤的要求、术中淋巴结能否彻底清扫等,这些均与患者的临床疗效和预后密切相关[2]。但无论是腹腔镜手术还是开腹手术,术前明确病变情况、制定合理的手术方案是保证手术成功和取得较好疗效的关键[3]。CT 能够在短时间内获得一定范围的薄层图像,明确病变及周围情况,提高手术的安全性[4]。但胃周围有大量的血管,静脉的变异和走行常伴随于动脉,手术中通常沿着动脉进行淋巴结清扫,动脉的变异对手术影响很大。因常规CT 检查仅能对局部病变及小范围周围组织进行观察,已无法满足腹腔镜胃癌根治术的手术要求,需要寻找敏感性更高的影像学方式开展术前检查[5]。3D-CT 能独立或融合胃周围血管及肝、胰、脾等主要脏器,从多角度、多方向观察血管运动及其与胃周脏器的关系,能直观、准确地显示解剖位置关系,模拟手术前的操作过程,并通过设置另一个监视器实时指导手术,在描述胃外周血管变化方面具有高度的敏感性和准确性[6-7]。因此,本研究分析了3D-CT 描述胃周血管腹腔干变异对腹腔镜下胃癌根治术的作用。现报道如下:
1 资料与方法
1.1 一般资料
回顾性分析2019年1月-2021年1月本院收治的185例胃癌患者的临床资料,均采用3D-CT描述胃周血管腹腔干变异情况,依据腹腔干情况分为观察组(腹腔干常见型,n=159)和对照组(腹腔干罕见型,n=26),两组均采用腹腔镜下胃癌根治术治疗。观察组中,男96 例,女63 例,年龄32~85 岁,平均(64.43±5.88) 岁,体重指数(body mass index,BMI)为(22.93±2.32)kg/m2,肿瘤TNM 分期中Ⅰ期和Ⅱ期77例,Ⅲ期82例。对照组中,男16例,女10 例,年龄35~84 岁,平均(65.06±4.23)岁,BMI为(23.26±2.46)kg/m2,肿瘤TNM 分期中Ⅰ期和Ⅱ期17例,Ⅲ期9例。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。胃癌的诊断标准:依据“胃癌诊断标准”[8],且经胃镜病理确诊。纳入标准:①临床确诊为胃癌;②年龄≥18周岁;③肿瘤为Ⅰ期至Ⅲ期,且无远处转移;④术前未行放化疗或激素治疗;⑤首次腹腔镜手术;⑥临床资料和随访资料均完整。排除标准:①合并重要脏器功能障碍、血液系统或神经系统疾病;②合并感染;③合并恶性肿瘤;④有腹部手术史;⑤腹腔镜胃癌根治术中转开腹手术。
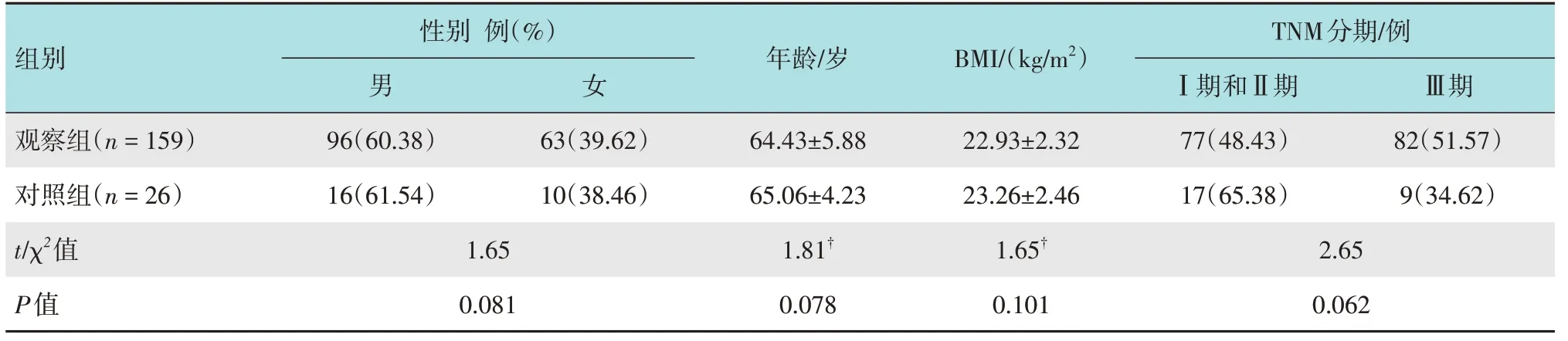
表1 两组患者一般资料比较Tanble 1 Comparison of general data between the two groups
1.2 方法
1.2.1 3D-CT 模拟影像获取方法使用64排增强CT扫描(日本东芝公司),0.5 mm层厚,以4 mL/s的速率静脉注射140 mL 碘海醇后行增强扫描。在注射后30 s的动脉期和注射后70 s的门脉期获取影像。将CT数据输入3D影像重建软件内,对胃周动脉、静脉的3D 影像进行重建和观察。通过360°旋转观察和分析血管走行和分支结构,并存储影像。所有被重建目标均采用动脉期数据将静脉血管情况显示出来,最后融合这些重建目标。见图1和2。

图1 胃周血管腹腔干常见型Fig.1 Common type of perigastric vascular celiac trunk
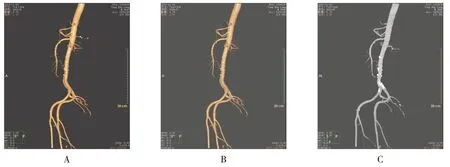
图2 胃周血管腹腔干罕见型Fig.2 Rare type of gastric perivascular celiac trunk
1.2.2 腹腔镜下胃癌根治术术中专设一显示屏动态显示手术区域血管脏器的3D-CT 模拟影像以指导手术。患者取气管插管全身麻醉,于脐孔上缘做一切口,建立CO2气腹,维持13 mmHg。以切口为观察孔,置入腹腔镜,对腹腔情况进行探查。于左侧腋前线肋缘下做一切口,约10 cm,为主操作孔,以脐左5 cm偏上部位做一5 mm切口,为辅助操作孔。于右侧锁骨中线平脐偏上和右侧腋前线肋缘下各做一辅助操作孔。经腹腔镜行胃肠道供血系统结扎术,依次剥离大网膜、肠系膜,清扫淋巴结。在上腹正中5~7 cm部位将胃体切除,提出胃体,完成食管-空肠吻合术,并重建消化道。常规留置引流管,依次缝合切口,术后常规行抗生素治疗5 d,并定期更换切口敷料。
1.3 观察指标
比较两组患者的围术期指标、手术前后炎性反应情况和不良反应。①围术期指标:平均出血量、手术时间、淋巴结清扫数目、首次排气时间、进食时间、住院时间;②炎性反应:血清白细胞介素(interleukin- 6,IL-6)、肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α)、超敏C 反应蛋白(high sensitive C-reactive protein,hs-CRP)、去甲肾上腺素(norepinephrine, NA)、 促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)水平;③不良反应:伤口感染、肺部感染、腹腔感染、肠梗阻、吻合口瘘、肠瘘、吻合口梗阻、尿路感染、胃动力障碍。
1.4 统计学方法
采用SPSS 22.0 软件分析数据,计量资料以均数±标准差(±s)表示,组间比较采用t检验,计数资料用例(%)表示,组件比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者围术期情况比较
观察组平均出血量、手术时间和首次排气时间明显少于对照组,差异均有统计学意义(P<0.05)。见表2。
表2 两组患者围术期情况比较 (±s)Table 2 Comparison of perioperative conditions between the two groups (±s)

表2 两组患者围术期情况比较 (±s)Table 2 Comparison of perioperative conditions between the two groups (±s)
组别观察组(n=159)平均出血量/mL 205.86±26.36手术时间/min 133.96±18.52淋巴结清扫数目/个41.26±3.22首次排气时间/h 28.35±1.74进食时间/h 33.68±2.96住院时间/d 9.43±2.52对照组(n=26)t值P值274.17±34.48 2.50 0.022 163.38±16.78 2.68 0.009 42.30±2.98 1.81 0.078 35.93±2.80 2.56 0.015 34.74±3.05 1.62 0.170 9.58±2.63 1.92 0.067
2.2 两组患者手术前后炎性反应情况比较
手术后两组患者的血清IL-6、TNF-α、hs-CRP、NA、ACTH 水平明显高于术前,但观察组少于对照组,差异均有统计学意义(P<0.05)。见表3。
表3 两组患者手术前后炎性反应情况比较 (±s)Table 3 Comparison of inflammatory reaction before and after operation between the two groups (±s)

表3 两组患者手术前后炎性反应情况比较 (±s)Table 3 Comparison of inflammatory reaction before and after operation between the two groups (±s)
注:†与术前比较,差异有统计学意义(P<0.05)
组别观察组(n=159)IL-6/(ng/L)术前238.17±48.25术后276.24±32.36†TNF-α/(ng/L)术前123.08±24.65术后140.69±30.19†hs-CRP/(mg/L)术前3.71±1.19术后6.15±0.63†对照组(n=26)t值P值237.74±47.91 1.65 0.099 405.75±68.26†2.56 0.014 123.85±24.93 1.83 0.076 168.28±34.75†2.44 0.029 3.74±1.25 1.94 0.059 9.36±3.04†2.56 0.015 NA/(ng/L)ACTH/(ng/L)组别术后23.16±2.71†观察组(n=159)术前226.18±20.54术后298.74±28.13†术前12.14±2.53 45.69±3.35†2.19 0.039对照组(n=26)t值P值225.69±20.35 1.69 0.088 341.47±32.85†2.77 0.008 12.81±2.56 1.95 0.055
2.3 两组患者不良反应情况比较
两组患者围术期不良反应比较,差异无统计学意义(P>0.05)。见表4。

表4 两组患者不良反应情况比较 例(%)Table 4 Comparison of adverse reactions between the two groups n(%)
2.4 典型病例
患者女,58岁,确诊为胃癌,TNM分期为3期,采用64 排增强CT 扫描并对胃周动脉、静脉的3D 影像进行观察,然后行腹腔镜下胃癌根治术。见图3。

图3 胃癌患者腹腔镜手术治疗过程Fig.3 The process of laparoscopic surgery for a patient with gastric cancer
3 讨论
胃癌发病隐匿,早期无典型症状,多数出现症状的患者已处于进展期。因此,准确的术前分期不仅可以避免不必要的手术,还能够避免因临床分期错误而延误手术时机[9]。常规CT检查对早期胃癌的敏感性较低,但增强CT扫描对术前TNM分期、手术切除范围及手术选择均有重要的评价和指导意义[10]。在确定手术切除范围时,增强CT 具有较高的准确性,但仍有局限性,有研究[11]指出,胃癌患者CT 检查前饮酒可能会影响胃壁显影,且印戒细胞癌呈弥漫性分布,CT 难以确定肿瘤边界。而腹腔镜胃癌根治术的难点在于胃外周血管及周围器官较为复杂,胃外周血管的变化也难理清。尤其是第7、8、9组的腹腔干周围淋巴结和第11、10 组的脾动脉周围淋巴结是最难清扫和最易发生意外的部位,若术中才发现这些区域存在变异,会影响手术医师的判断,延长手术时间,增加并发症发生率,手术安全性得不到保障,临床疗效欠佳。因此,术前充分了解胃外周血管的解剖变化非常重要[12]。有研究[13]指出,3D-CT模拟影像能清晰显示肝总动脉和胃左静脉的变化,还可对肝总动脉和胃左静脉的变异类型进行分析,该学者认为术前3D-CT模拟能有效减少术中出血量,改善预后。
3D-CT模拟影像主要显示腹腔干的形态,同时可以对胃周围的器官进行整合,并根据需要对这些融合图像进行分解[14]。通过分析3D-CT模拟影像中动脉的变化,操作者可以在手术前判断手术的重点和难点,并提前制定相应的计划[15]。在手术过程中,通过比较3D-CT模拟影像和实际腹腔镜图像,可以更好地了解血管的实际形态、变化和解剖关系,即使在肥胖和血管暴露的情况下,两幅图像的结合也可以达到预先判断,准确游离解剖,从而避免损伤,保证手术顺利进行,提高手术质量[14,16]。本研究显示,腹腔干常见型患者的术中出血量和手术时间较短,术后排气时间短,且炎性反应较轻,可能与腹腔干常见型患者胃周血管走行清晰、临床医师操作技术娴熟有关。而在实际临床中,腹腔镜下淋巴结清扫的途径主要是沿血管走行,在解剖过程中不仅需要通过精细的解剖来识别血管、防止血管损伤,还需要在陌生的解剖路径中完成淋巴结清扫,这要求手术医师及其手术团队内镜技术要高,也要求手术医师心理状态要好。3D-CT用于胃癌患者腹腔镜手术,可以指导医师手术,提高临床安全性。在本研究中,腹腔干罕见型占14.05%,其比例并不少见,且类型多、变异多。因此,要保证手术质量,就要花费更多的时间来确认胃周血管,可能造成出血量增多[17-18]。
综上所述,胃癌患者腹腔镜手术前经3D-CT 描述胃周血管腹腔干变异情况,能够在一定程度上减少术中出血量,缩短手术时间,促进术后排气,减轻围术期炎性反应,安全性较佳。

