不同配比的荞麦日粮对高胆固醇血症小鼠肠道胆固醇吸收和菌群的影响
田 甜,裴鑫礼,刘海英✉
(江南大学 食品学院,江苏 无锡 214122)
胆固醇是动物组织细胞的重要组成部分,同时也是人体代谢不可或缺的原料。但当其过量时便会导致高胆固醇血症,对机体健康产生负面影响。引起心血管疾病的一个重要原因就是高胆固醇血症。机体可在肝脏中自行合成胆固醇,也可以经过肠道从食物中摄入胆固醇,其中跨膜蛋白质 NPC1L1(Niemalnn-Pick C1-Like 1)在胆固醇的吸收过程中起到关键作用[1]。而机体排出胆固醇主要依靠胆汁酸,受体 liver X receptor α(LXR-α)可以抑制胆汁酸吸收,增加胆固醇的排出[2]。而 ABCG5,ABCG8(ATP-binding cassette subfamily G5,G8)可以促进胆固醇排泄到胆汁中[3]。
肠道菌群是人体生态系统的重要组成部分,与人体是共生关系,对人体代谢、肠道健康都起着重要作用。高脂膳食不但会升高机体的胆固醇水平,还会迅速的改变肠道菌群结构,但是其机制仍然不清楚。Cani等[4]认为高脂膳食导致破坏肠道通透性,最终使有害菌大量进入。Allison等[5]认为高脂膳食后结肠总胆汁酸量上升,产生大量活性氧自由基(ROS),破坏了肠道微环境。由于菌群对胆汁的耐受性存在差异,而最终导致菌群结构的失衡。
荞麦是东亚地区的一种古老农作物,其含有丰富的可溶性膳食纤维和微量元素。中医学认为,荞麦具有一定治疗肠道疾病的功能。现代研究表明,荞麦具有一定降血压和降血脂作用[6]。本研究制备了高胆固醇脂血症小鼠模型,并利用高、低两种剂量的荞麦粉日粮饲喂小鼠,分析不同比例的荞麦日粮对高胆固醇血症小鼠肠道胆固醇吸收和菌群的影响。
1 材料与方法
1.1 试验材料
荞麦,产自甘肃:山东鹤来香食品有限公司;标准饲料(AIN-93M)、高胆固醇脂血症模型饲料及荞麦实验组饲料:南通特洛菲饲料科技有限公司;Trizol裂解液、cDNA合成试剂盒、DEPC:上海生工生物工程有限公司;SYBR Green PCR试剂盒:QIAGEN公司;H&E染色试剂盒:碧云天生物试剂公司;刚果红:上海远航试剂厂;其他试剂:国药集团化学试剂有限公司。
本实验中所有实验动物均为6~8周龄,雄性C57BL/6小鼠(SPF级),体重20~22 g,动物合格证书编号SCXK(SU)2013-0003,伦理审查号JN.No. 20170704-20171015 [88]:苏州格瑞斯威生物科技有限公司。
1.2 仪器及设备
UV-2100紫外分光光度计:日本岛津公司;全自动血液生化分析仪:深圳迈瑞生物医疗电子股份有限公司;F200酶标仪:瑞士恩科生物科技有限公司; 5424R高速台式冷冻离心机:德国艾本德有限公司;组织包埋机、切片机:德国徕卡仪器有限公司;电泳仪:美国伯乐公司;7900HT Fast Real-Time PCR 仪:美国赛默飞世尔科技有限公司;MISEQ 测序仪:美国 Illumina 公司;Agilent 2100 生物分析仪:美国安捷伦科技公司。
1.3 试验方法
1.3.1 动物饲养及分组
在 AIN-93M 标准饲料的基础上,参考 De Sousa[7]饲料配方修改,用荞麦分别代替模型饲料中一半和全部的碳水化合物供能原料(玉米淀粉和麦芽糊精),形成对应的荞麦低、高剂量饲料。使用维持性饲料适应性饲喂一周后,将雄性C57BL/6小鼠随机分配到各组,分别为空白对照组(N)、高胆固醇模型组(H)、模型+荞麦低剂量组(F)和模型+荞麦高剂量组(G)组,每组10只。小鼠同室分笼饲养于江南大学实验动物中心,饲养温度控制在22~26 ℃,相对湿度控制在50%~70%,12 h光明12 h黑暗交替照明,自由采食,分别饲喂12周。小鼠饲料配方见表1。

表1 小鼠饲料配方Table 1 Ingredient composition of the diets fed to mice
1.3.2 动物检测样品的采集
实验小鼠在12周的实验结束后禁食不禁水,用乙醚麻醉,摘眼球取血。血浆静置30 min,经离心(4 ℃,3 000 r/min,10 min)后,取上清,-80 ℃保存,用于血清生化指标检测。
取小鼠完整小肠,取出小肠中所有内容物,移至冻存管中,立即转至-80 ℃环境保存,用于小鼠肠道内容物多样性分析实验。取近盲段的小段小肠放置于福尔马林溶液固定,H&E染色观察;取小段小肠放置于1 mL Trizol试剂中,用于小肠胆固醇代谢基因的表达水平测定。
1.3.3 小鼠小肠组织 DNA 提取及实时荧光定量PCR实验
提取肠道组织RNA,参照试剂盒操作说明书进行。使用NanoDrop®ND-1000检测260/280吸光度值(1.8~2.0之间)及其浓度,使用变性琼脂糖电泳进行总RNA质量鉴定。采用实时荧光定量PCR(Quantitative Real-time PCR,RT-qPCR)检测小肠中的胆固醇代谢相关基因。将SYBR Green Supermix染料、目的基因的特异性引物及模板DNA 置于 Bio-Rad CFX Connect实时体系中,反应体系为 20 μL,包括 SYBR Green Supermix 染料10 μL,上、下游引物各 1 μL,稀释至适宜浓度的模板DNA 8 μL。进行 qPCR反应,将 cDNA所有样品分别配至相关反应体系,加样后将载有样品的PCR板置于PCR仪上进行反应。以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参,用 2-ΔΔCt方法对基因表达进行相对量化。具体引物序列如表2所示。引物合成由苏州金唯智生物科技有限公司完成。

表2 实时定量PCR使用引物列表Table 2 Real-time quantitative PCR using primer lists
1.3.4 高通量测序分析肠道内容物菌群多样性
小鼠肠道菌群组成分析采用 Illumina-MiSeq高通量测序技术进行。取出保存好的肠道内容物,按1.3.3中的方式提取其中细菌的DNA,通过PCR引物扩增细菌16S rDNA的V3、V4区,用切胶回收试剂盒回收V3、V4区的PCR产物,采用Pico Green荧光染料法定量胶回收产物,样品经检测合格后构建文库,随后进行cluster的制备和测序,获得下机数据后进行生物信息学分析。文库构建和生物信息学分析由苏州金唯智生物科技有限公司完成。
1.4 数据分析
实验数据使用 IBM SPSS 20和 GraphPad prism 6统计学软件处理,结果以平均值±标准差的方式表示。多组数据间的统计分析采用one-way ANOVA方差分析(*P<0.05,**P<0.01)。
2 结果与分析
2.1 荞麦对实验小鼠血清脂代谢指标的影响
血清胆固醇水平是预测冠心病、动脉粥样硬化等相关疾病的主要指标[8]。当血液中胆固醇水平出现异常,能够较为直接反应机体对于胆固醇代谢调节能力的变化。
荞麦对小鼠血清脂代谢指标的影响见图1。由图1(a)可知,经过12周的高胆固醇日粮饲喂后,相较于空白组,高胆固醇模型组小鼠的血清总胆固醇(TC)含量极显著性升高(P<0.01)。与高胆固醇模型组相比,模型+荞麦两剂量组小鼠血清TC含量极显著性降低(P<0.01)。由图1(b)可知,与空白组相比,高胆固醇模型组的小鼠血清甘油三酯(TG)含量无显著性差异。而与高胆固醇模型组相比,模型+荞麦两剂量组血清TG显著降低(P<0.01)。由图1(c)可知,相较于空白组,高胆固醇模型组的小鼠血清高密度脂蛋白胆固醇(HDL-C)含量极显著性降低(P<0.01)。与高胆固醇模型组相比,模型+荞麦高剂量组可有效升高小鼠血清HDL-C含量(P<0.01),但是剂量荞麦组的HDL-C含量升高不显著。由图1(d)可知,与空白组相比,高胆固醇模型组小鼠血清低密度脂蛋白胆固醇(LDL-C)含量极显著性升高(P<0.01)。与高胆固醇模型组相比,模型+荞麦两剂量组小鼠血清 LDL-C含量极显著降低(P<0.01)。
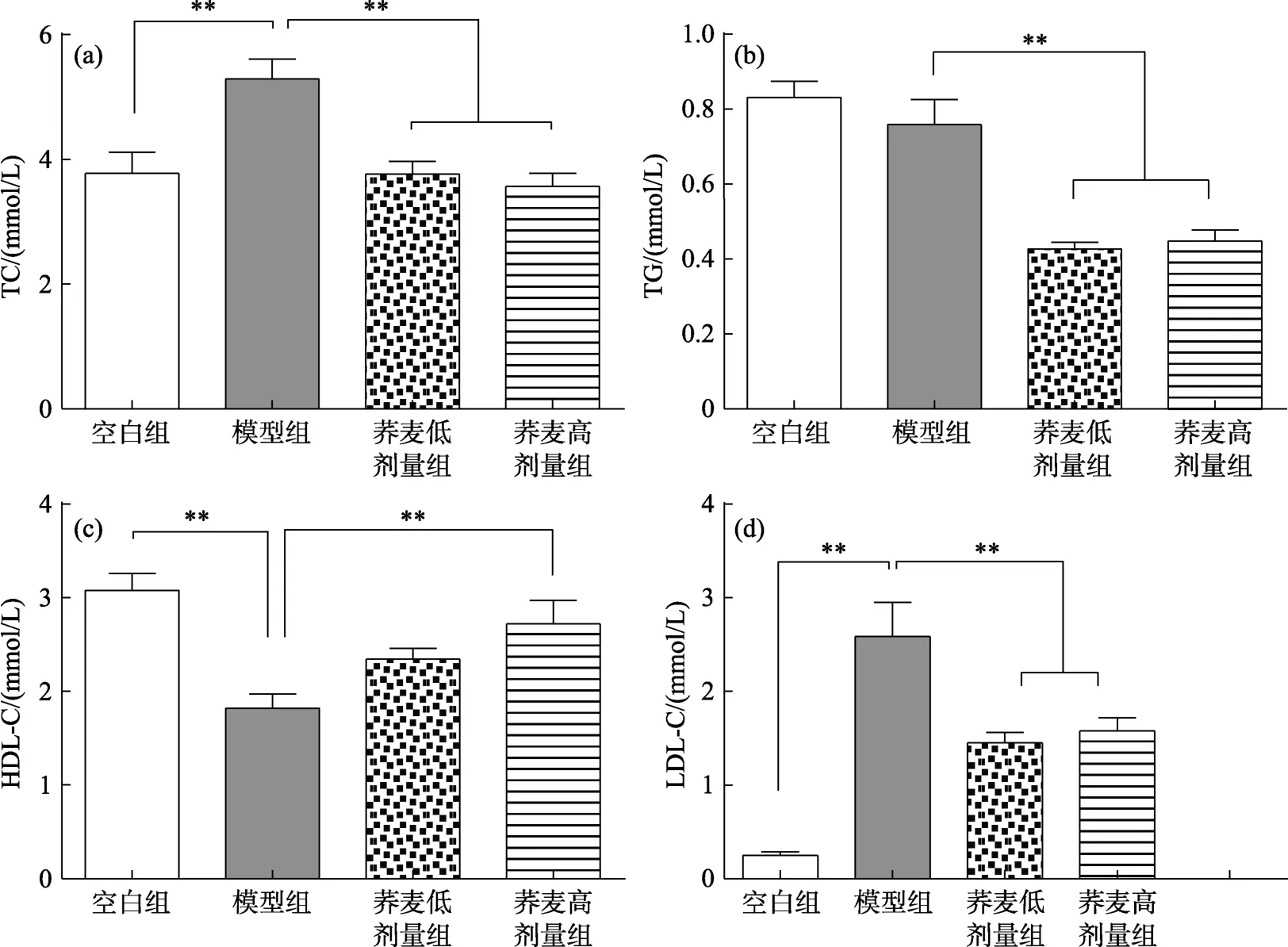
图1 荞麦对小鼠血清脂代谢指标的影响Fig.1 Effects of buckwheat on serum lipid metabolism of mice
研究表明,机体内TC含量与心脑血管疾病的发病率紧密相关[9]。因此,严格控制胆固醇含量至关重要。上述结果表明,经过12周的高胆固醇日粮饲喂后,模型饲料会诱导模型组小鼠血清TC、HDL-C和LDL-C含量极显著发生变化,表明实验造模成功。荞麦日粮可有效的降低小鼠血清 TC、LDL-C含量,升高HDL-C含量,表明使用荞麦日粮对小鼠血清胆固含量有非常有益的调节作用。
2.2 荞麦对高胆固醇脂血症小鼠肠绒毛结构的影响
肠道是机体最大的消化和免疫器官,小肠绒毛粘膜是吸收胆固醇的主要部位。小肠绒毛损伤会导致胆固醇吸收量增加,加大肠道消化吸收胆固醇的运转负荷[10]。由图2可知,空白组的小鼠小肠绒毛细长,排列有序且结构完整。高胆固醇模型组肠壁变厚,小鼠肠黏膜绒毛的完整性被破坏,表现为小肠绒毛短粗,绒毛顶端上皮下间隙增大,上皮层与固有层分离。部分绒毛顶端上皮层破损明显,缩短变粗,结构完整性较差,上皮部分脱落现象。荞麦两剂量组小鼠的小肠绒毛排列恢复比较整齐,肿胀程度较轻,绒毛长度和粗细较模型组显著变长变细。以上结果说明,低比例和高比例荞麦日粮均能对由高胆固醇日粮所引起的小鼠小肠结构损伤起到恢复作用。
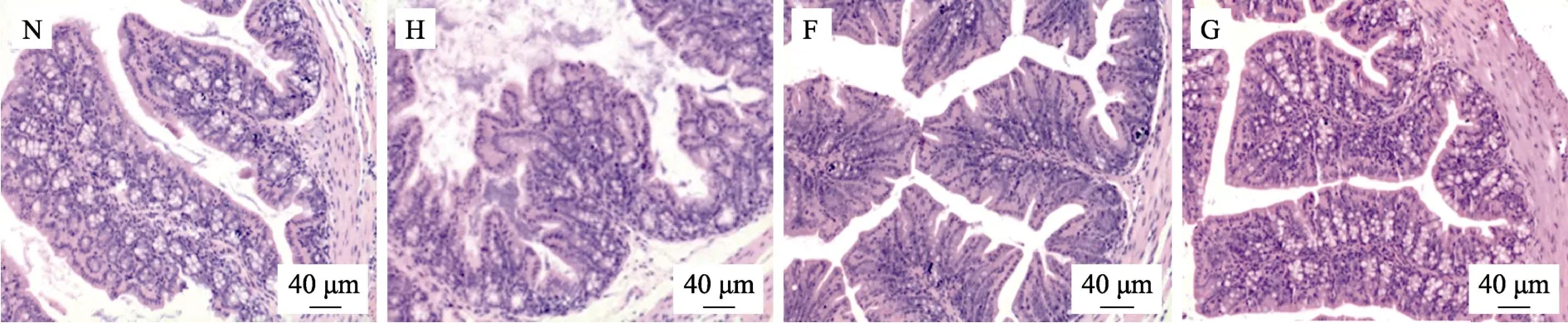
图2 荞麦对小鼠肠道组织形态学观察的影响Fig.2 Effects of buckwheat on intestinal tissue morphology of mice
2.3 荞麦对高胆固醇脂血症小鼠肠道吸收胆固醇功能的影响
小肠上皮细胞中三磷酸腺苷结合盒转运体ABCG5/8作为跨膜转运蛋白,主要参与胆固醇的逆向转运,负责使胆固醇在小肠的吸收减少,控制血浆中胆固醇水平。表达于小肠上皮细胞刷状缘的ABCG5/ABCG8蛋白,二者同时表达,结合成二聚体时才能起作用,它们可以将小肠吸收的游离胆固醇逆转运至肠腔随粪便排出。有研究表明小鼠ABCG5和ABCG8 mRNA过表达则会降低胆固醇的吸收[11]。荞麦对小鼠肠道 NPC1L1、ABCG5、ABCG8的mRNA相对表达量的影响见图3。

图3 荞麦对小鼠肠道NPC1L1、ABCG5、ABCG8的mRNA相对表达量的影响Fig.3 Effects of buckwheat on mRNA relative expression of NPC1L1,ABCG5 and ABCG8 in intestinal tract of mice
相对于对照组,模型组小鼠肠道的 ABCG8 mRNA表达极显著下降。相对于模型组,荞麦组ABCG8的mRNA表达量无明显变化。相对于对照组,模型组的ABCG5 mRNA表达极显著下降。相对于模型组,荞麦组小鼠肠道中ABCG5 mRNA的表达量都极显著上升。实验结果表明,荞麦日粮提高了小肠的 ABCG5/ABCG8蛋白表mRNA达量,进而可以减少小肠对胆固醇的吸收。
相对于对照组,模型组肠道的 NPC1L1的mRNA表达极显著上升。相对于模型组,荞麦的低剂量和高剂量组的 NPC1L1 的 mRNA表达极显著下降。NPC1L1蛋白主要在小肠上皮细胞刷状缘高度表达,是参与小肠胆固醇吸收的重要蛋白,主要介导小肠从饮食和胆汁中吸收游离的胆固醇进入肠粘膜[12]。而胆固醇在体内的主要吸收部位是靠近空肠的小肠部分,不仅吸收膳食中的胆固醇,也吸收胆汁胆固醇。NPC1L1的 mRNA表达量降低,则从肠道中吸收的胆固醇会减少。实验结果表明,相对于模型组,不同比例的荞麦日粮会降低减少NPC1L1的mRNA表达量,进而减少肠道对胆固醇的吸收。
高密度脂蛋白(HDL)通过多种机制发挥其抗动脉粥样硬化作用,其中最重要的是参与胆固醇的逆向转运(Reverse cholesterol transport,CT),防止胆固醇在动脉壁沉积,并将胆固醇从血管壁运送至肝脏被清除。细胞游离胆固醇的单向转运无脂或贫脂载脂蛋白与 ATP结合盒转运子 A1(ABCA1)[13],形成新的HDL。ABCA1是HDL形成的关键蛋白。清道夫受体B类I型(SR-B I)是一种多配体膜受体蛋白质,也是目前唯一公认的HDL受体,在胆固醇RCT的最后一步与HDL发生反应[14]。此外,血浆中的胆固醇也会由 SR-B I介导,转运到肝脏,用于胆汁酸的生产。荞麦对小鼠肠道SR-B I、ABCA1的mRNA相对表达量的影响见图4,由图4结果可知,空白组小鼠肠道ABCA1和SR-B I的基因表达均极显著高于模型组(P<0.01);荞麦低、高剂量组小鼠肠ABCA1、SR-B I基因均与模型组有极显著性差异(P<0.01)。这表明相对于模型组,荞麦低、高剂量组的RCT作用有极显著提升。上述结果表明,荞麦日粮使高胆固醇脂血症小鼠肠道对胆固醇的吸收作用极显著降低,而胆固醇的逆向转运作用显著提升。

图4 荞麦对小鼠肠道SR-B I、ABCA1的mRNA相对表达量的影响Fig.4 Effects of buckwheat on mRNA relative expression of SR-B I and ABCA1in intestinal tract of mice
2.4 荞麦对高胆固醇脂血症小鼠肠道内容物菌群多样性影响
单一样品的复杂程度一般采用 Alpha多样性来分析。常见的 Alpha多样性参数是指 ACE、Chao1、Shannon和Simpson。ACE和Chao1指数是根据所测得的 OTU值来预测样本中微生物的丰度,数值越大,物种越丰富。Shannon和Simpson指数反映肠道菌群中所有物种数及每个物种数占总体的比例,Shannon越大,Simpson越小,物种越丰富。Coverage是指覆盖程度,数值越大,表明准确性越高。荞麦饲喂的实验小鼠肠道细菌菌群多样性指数分析见表3。

表3 荞麦饲喂的实验小鼠肠道细菌菌群多样性指数分析Fig.3 Analysis on the diversity index of intestinal microflora of buckwheat of coarse cereals
由表3可知,ACE和Chao1参数数据相近,Shannon参数的趋势与 ACE和 Chao1两参数一致。模型组ACE和Chao1、Shannon指数显著性低于空白组,表明高脂日粮会减少小鼠肠道微生物的丰度。荞麦低剂量组的小鼠肠道菌群丰度降低,与其他组显示出显著差异,表明低剂量荞麦的食用可能对肠道菌群的稳定产生负面影响。但是荞麦高剂量组对丰度的提升有明显的促进效果,显示大量食用荞麦有益于肠道菌群的稳定和丰富。
经过注释,共有拟杆菌门(Bacteroidetes)、厚壁菌门(firmicutes)、变形菌门(proteobacteria)、疣微菌门(Verrucomicrobia)、Epsilonbacteraeota、Actinobacteria、Cyanobacteria、Patescibacteria、Deferribacteres等12个门被鉴定。如图5结果显示,各实验组小鼠肠道菌群的优势菌群均以拟杆菌门、疣微菌门、厚壁菌门和变形菌门4个菌门为主,所占比例均在95%以上。空白组中拟杆菌门相对丰度最高,达到50%。与空白组相比,高胆固醇组的小鼠肠道菌群中拟杆菌门仍为优势菌群,但相对丰度显著性降低(P<0.05),约为25%。厚壁菌门比重增加,这与Jorge[15]等的研究结果相似。荞麦低剂量组的小鼠拟杆菌门含量极低,优势菌群为厚壁菌门,所占比重较高,达到70%。但是,荞麦高剂量组的小鼠拟杆菌门比重较高,达到30%。
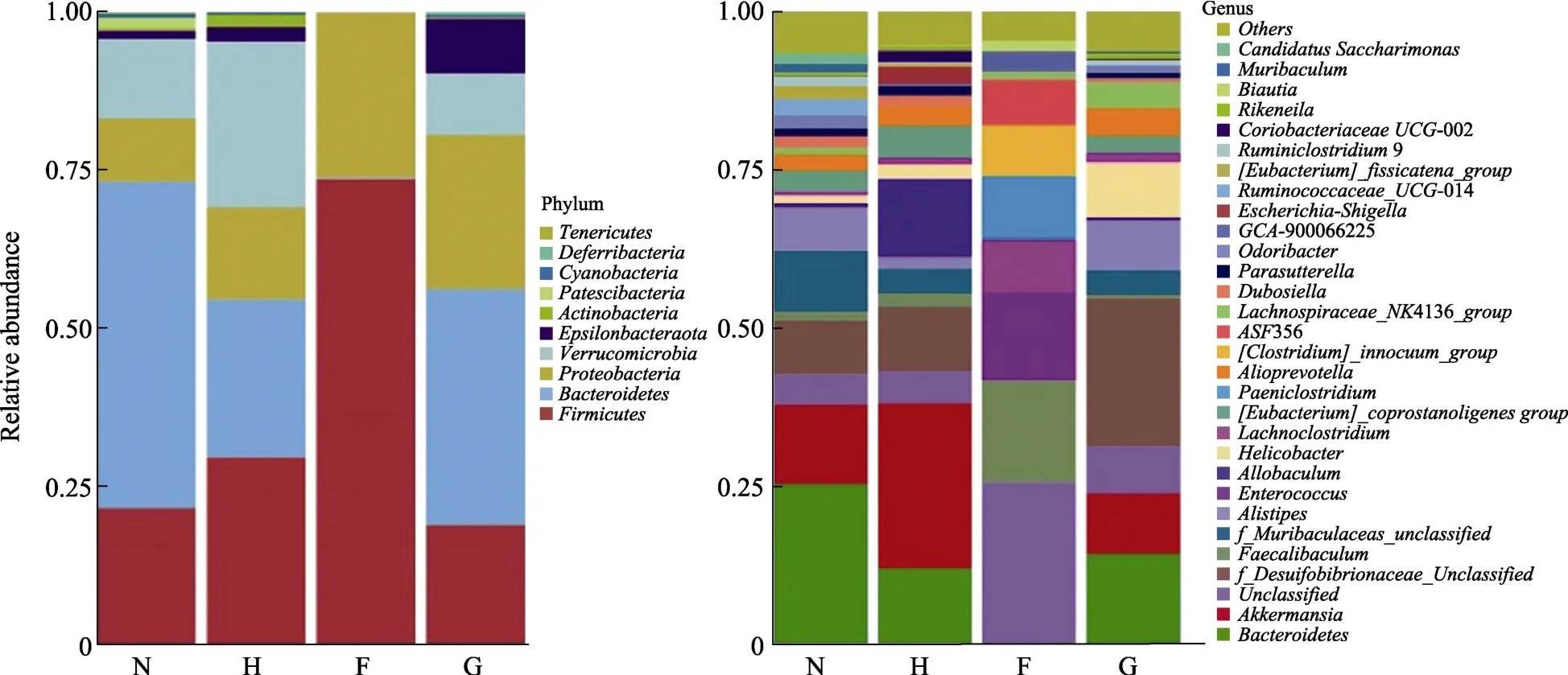
图5 门和种属水平上小鼠肠道菌群相对分布Fig.5 The relative abundance of intestinal microbes distributed on phylum and species level
经过物种注释,脱硫弧菌属(Desulfovibrionaceae、Bacteroides、阿克曼菌属(Akkermansia)、另枝菌属(Alistipes)、Muribaculaceae、Unclassified、Helicobacter、Alloprevotella、Coprostanoligenes等72个属被注释。
空白组中Desulfovibrionaceae,Bacteroides,Akkermansia和Alistipes为主要优势菌群,相对丰富为 53.4%。在高胆固醇诱导干预后,模型组小鼠肠道菌群的脱硫弧菌属无明显变化,拟杆菌属显著降低,阿克曼菌属丰度升高,另枝菌属丰度显著降低。与高胆固醇模型组相比,模型+荞麦低剂量组优势菌为粪杆菌属(Faecalibaculum)和毛螺旋菌科(Lachnospiraceae)属。荞麦高剂量组的优势菌群主要为脱硫弧菌、拟杆菌属和另枝菌属。荞麦低剂量组小鼠肠道菌群中拟杆菌属相
对丰度极低(< 0.1%),其主要优势菌群中Faecalibaculum相对丰度较模型组显著升高(0.2% vs 16.1%,P<0.01),与空白组差异不大;较模型组降低(9.1% vs 1.2%,P<0.01),模型组与空白组小鼠肠道菌群的Lachnospiraceae相对丰度无显著差异。荞麦高剂量组的拟杆菌属与模型组相比略有升高(11.9% vs 18.9%);脱硫弧菌属较模型组有显著升高(8.2% vs 23.2%,P<0.01),另枝菌属较模型组有显著升高(1.8% vs 8.6%,P<0.01)。
3 结论
本文研究了不同比例的荞麦日粮对胆固醇脂血症小鼠的肠道胆固醇吸收、排出功能和肠道菌群的影响。结果显示,无论是低比例还是高比例的荞麦摄入都可降低胆固醇的肠道吸收,提高胆固醇的肠道排出。但是,低比例的荞麦摄入对肠道菌群的丰度不利,而高比例的荞麦摄入可以显著改善肠道菌群的稳定性和丰度。本研究可以为小宗谷物的应用提供一些理论依据。
备注:本文的彩色图表可从本刊官网(http:// lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。

