贵州花红离体再生体系的建立与优化
邹思艳, 田 田, 吴敏芳, 文晓鹏
1. 贵州大学 生命科学学院/农业生物工程研究院,山地植物资源保护与种质创新教育部重点实验室,贵阳 550025;2. 贵州大学 林学院,贵阳 550025
花红(Malusasiatica)属蔷薇科(Rosaceae)苹果属(Malus)落叶小乔木,既可以作为果实开发,也可以作为苹果的良好砧木,同时也是贵州省重要的苹果种质资源[1],但其繁殖效率较低.高效的离体再生体系对于苗木快繁具有重要意义[2],也是开展遗传转化研究的前提[3].外植体的选择对于植物离体再生体系的建立至关重要,叶片是苹果属植物离体再生常用的外植体,此外,子叶、茎尖和下胚轴等均可通过组织培养诱导出完整植株[4].花红的离体再生研究较早,蒋启林等[5]利用花红幼胚成功诱导成苗并建立快繁体系,万莹[6]和陈鑫[7]以来安花红茎段为外植体建立了快繁体系,但易受胚发育程度和数量的限制,也会受茎段木质化程度所影响,致其繁殖系数相对较低.由于叶片和子叶不受材料发育阶段及数量的限制,本研究以花红叶片和子叶为外植体诱导再生,探究不同因子对其直接再生不定芽频率的影响,以期建立高效的花红离体再生体系,为花红转基因工作奠定理论基础,也为花红新品种培育和砧木遗传改良提供新途径.
1 材料与方法
1.1 试验材料
以贵州省黔西县本地品种花红的幼胚、子叶(成熟胚)及组培苗叶片为材料.
1.2 研究方法
1.2.1 外植体的获得
幼胚:取花后40 d的花红幼果,自来水冲洗1 h,于超净工作台上用75%的酒精灭菌30 s,无菌水洗2~3次,再用0.1%的升汞溶液加2滴吐温20灭菌10 min,无菌水清洗3~4次,吸水纸吸干水分,切除果肉,取出幼胚备用.
子叶:选取成熟饱满、颗粒均一的花红种子,用无菌水浸泡10 min后,于超净工作台上用75%的酒精消毒30 s,无菌水洗2~3次,再用10%的次氯酸钠溶液处理10 min,无菌水洗3~4次,吸水纸吸干水分后,剥除种皮,取出两片子叶,顶端胚芽切除,另一端切去1/3备用.
叶片:取本实验室继代保存的花红组培苗上部幼嫩的叶片,将叶片边缘和叶柄切除,用手术刀垂直主叶脉将背面(远轴面)划伤备用.
1.2.2 外植体类型对不定芽再生的影响试验
取上述幼胚和成熟胚的子叶为外植体,正面朝上分别接种于以MS为基础培养基、添加2.0 mg/L TDZ和0.1 mg/L NAA的不定芽诱导培养基中;叶片外植体背面朝上接种到叶片不定芽诱导培养基中(MS+3.0 mg/L TDZ+0.20 mg/L NAA+0.5 mg/L IBA).暗培养7 d后转光下培养,光照时间为12 h/d,培养温度(25±1) ℃,光照强度 2 000~2 500 lx.每个处理接种20个,重复3次.
1.2.3 暗培养时间及子叶部位对不定芽再生的影响试验
将上述成熟胚的子叶斜切近胚芽端,正切另一端,接种于再生培养基(MS+1.0 mg/L TDZ+0.05 mg/L NAA)上,分别进行不同时间(0 d,7 d,14 d)的暗培养处理.每个处理接种20个,重复3次.
1.2.4 生长调节物质对不定芽再生的影响试验
为筛选诱导不定芽分化的最佳组合生长调节物质(Plant Growth Regulator,PGR),将上述成熟胚的子叶分别接种于16个含有不同浓度的TDZ(1.0,2.0,3.0,4.0 mg/L),NAA(0.05,0.10,0.20,0.40 mg/L),IBA(0,0.05,0.10,0.20 mg/L)不定芽再生培养基中,暗培养7 d后转光下培养50 d.每个处理接种20个子叶,重复3次.光下培养50 d后统计各处理下不定芽的诱导率.
1.2.5 不定芽增殖培养
待子叶诱导出丛芽之后(50 d),切除多余子叶,将丛芽分别转入到含有0.05 mg/L 6-BA培养基中,培养2周后,切取长势一致的单株芽分别接种于9个不同浓度6-BA(1.0,2.0,4.0 mg/L)和NAA(0.1,0.2,0.3 mg/L)的增殖培养基中,每瓶接种4株,重复5次.光下培养40 d后,观察记录不定芽的生长情况,并统计其增殖系数.
1.2.6 生根培养
待不定芽生长至1.5~2.5 cm时,用解剖刀切取单株的苗接种于含有不同激素浓度的生根培养基中,生根培养基采用 1/2 MS+ 20 mg/L蔗糖+6 mg/L琼脂作为基础培养基,添加不同浓度的IBA(0.5,1.0,2.0 mg/L)和NAA(0,0.1,0.2 mg/L).每个处理接种4株增殖苗,重复5次,培养40 d后统计各处理的生根情况.
1.3 数据统计分析
所有统计数据均采用Excel软件进行处理,采用SPSS 21.0 软件进行Duncan检验及差异显著性分析.
2 结果与分析
2.1 外植体类型对不定芽再生的影响
不同外植体对花红离体再生有很大的影响.结果表明,花红子叶与幼胚和叶片在再生培养基上的再生率有差异,幼胚和叶片均无不定芽形成,成熟胚的子叶培养于MS+2.0 mg/L TDZ+0.1 mg/L NAA培养基中,不定芽再生率为11.67%.
2.2 暗培养时间及子叶部位对不定芽再生的影响
前期暗培养对植物再生不定芽有一定的促进作用,暗培养7 d能够显著促进子叶再生不定芽.结果表明,子叶暗培养后变黄,且体积膨大至原来的2倍时,未经暗培养的子叶无明显变化(表1).暗培养7 d后转入光下培养13 d,子叶开始产生不定芽(图1a);暗培养0 d和暗培养14 d的子叶均无不定芽产生.
暗培养7 d后的子叶转光下培养,子叶迅速转绿,近轴面近胚芽端切口处出现疑似不定芽雏形,接种20 d后开始出现不定芽,并陆续发育成小植株.50 d时不定芽再生率达到最高(图1b),子叶再生的不定芽大部分发生于近轴面近胚端切口处,再生率达36.7%,相较远胚端增高约11倍(表1),表现出明显的极性效应.

表1 培养时间及子叶部位对诱导再生不定芽的影响
2.3 PGR浓度对子叶再生不定芽的影响
植物生长调节剂对花红子叶再生不定芽有很大影响.结果表明,在添加了1.0 mg/L TDZ和0.05 mg/L NAA的MS培养基上,子叶诱导不定芽的再生率最高达38.9%,再生芽数最多,平均11.7个(表2).
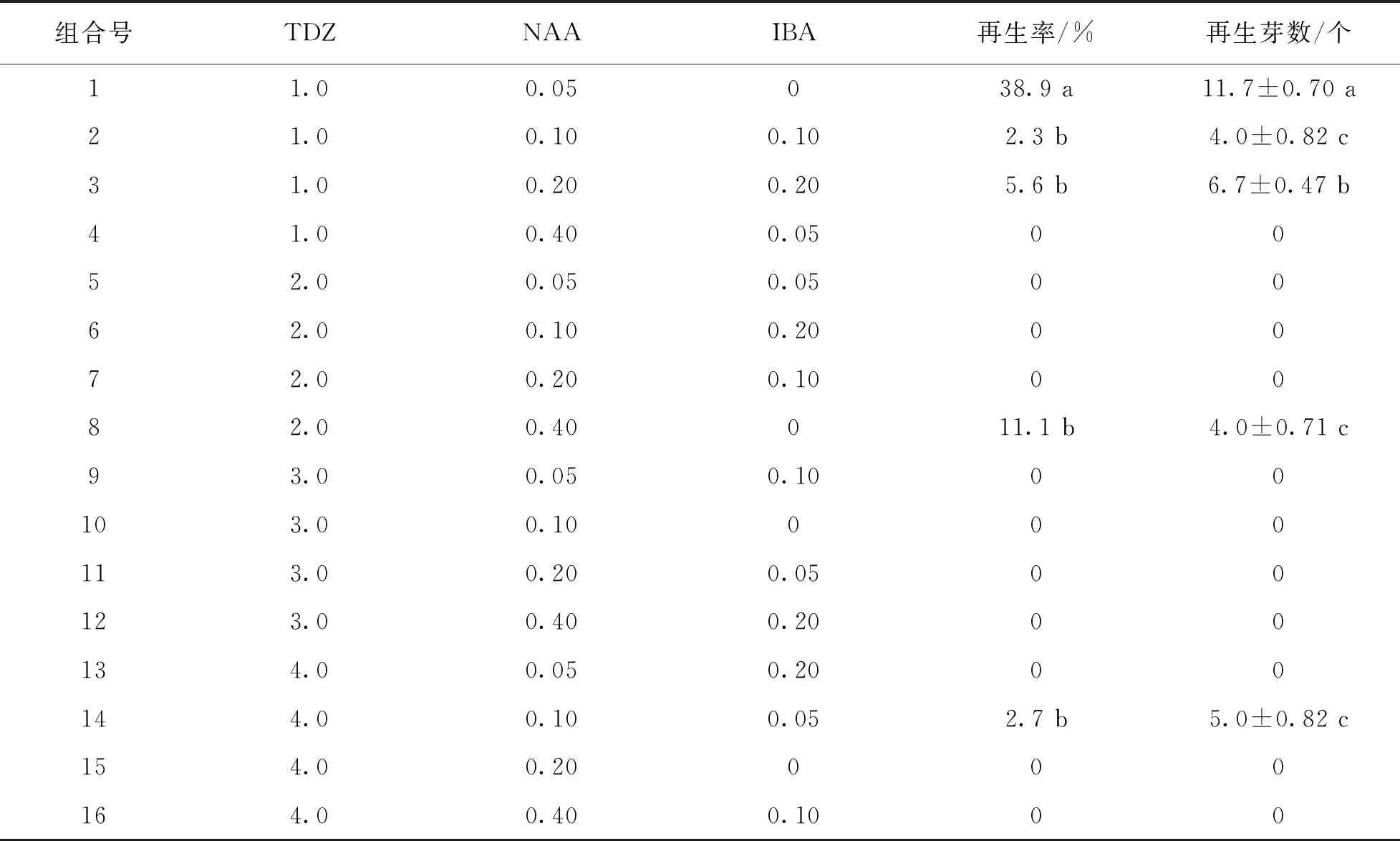
表2 PGR浓度对花红子叶再生不定芽的影响
2.4 6-BA和NAA浓度对花红不定芽增殖的影响
不同6-BA和NAA浓度配比对花红不定芽的增殖系数及增殖效果影响较大(表3),培养基MS+4.0 mg/L 6-BA+0.2 mg/L NAA的不定芽增殖系数最高,为7.73,但芽细弱,长势差,呈玻璃化状.从芽的长势及健康程度来看,培养基MS+1.0 mg/L 6-BA+0.3 mg/L NAA中不定芽生长状态最好,伸长明显(图1c),增殖系数较高,为最佳增殖培养基.
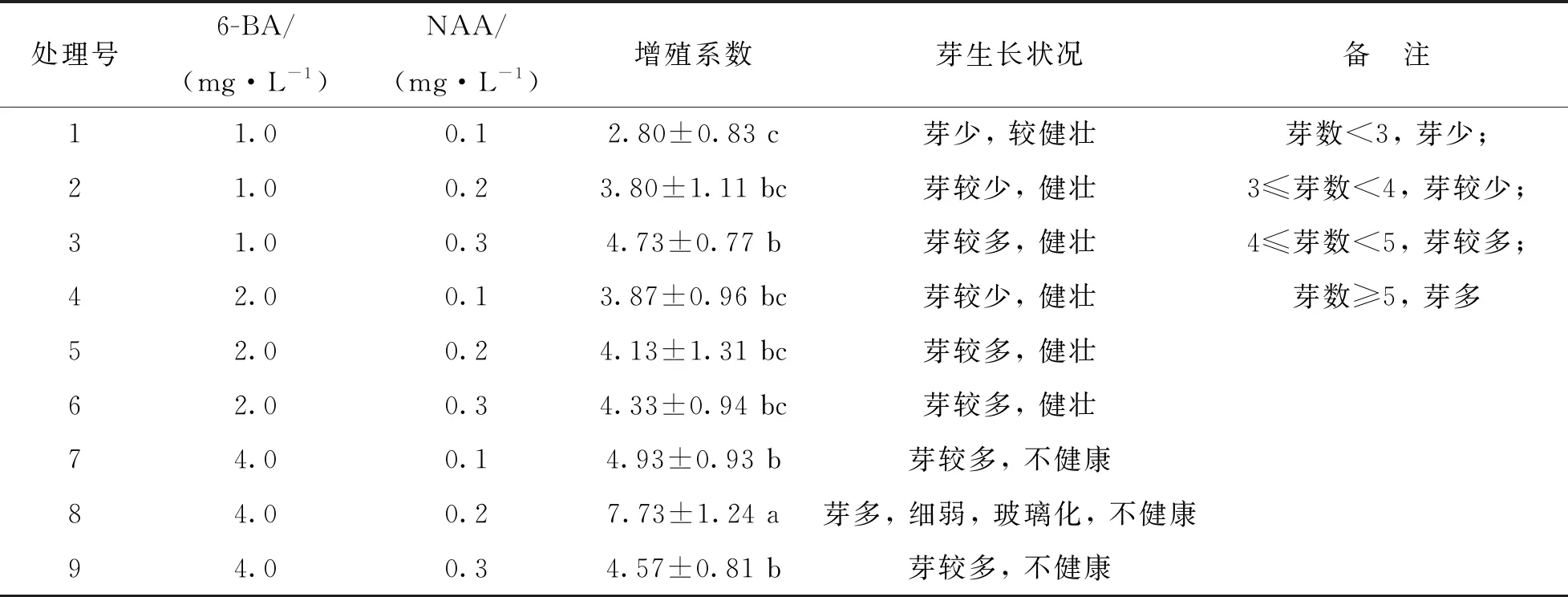
表3 6-BA和NAA浓度对不定芽增殖的影响
2.5 生根培养
增殖后的花红不定芽在含有不同浓度IBA(0.5,1.0,2.0 mg/L)和不同浓度NAA(0,0.1,0.2 mg/L)的1/2MS生根培养基中进行生根培养,一段时间后不同浓度组合的生根率有明显差异.结果表明,1/2 MS+1.0 mg/L IBA+0.2 mg/L NAA生根培养基,暗培养7 d后转入光照培养生根率(60%)最高,且根系粗壮,须根多(图1f).
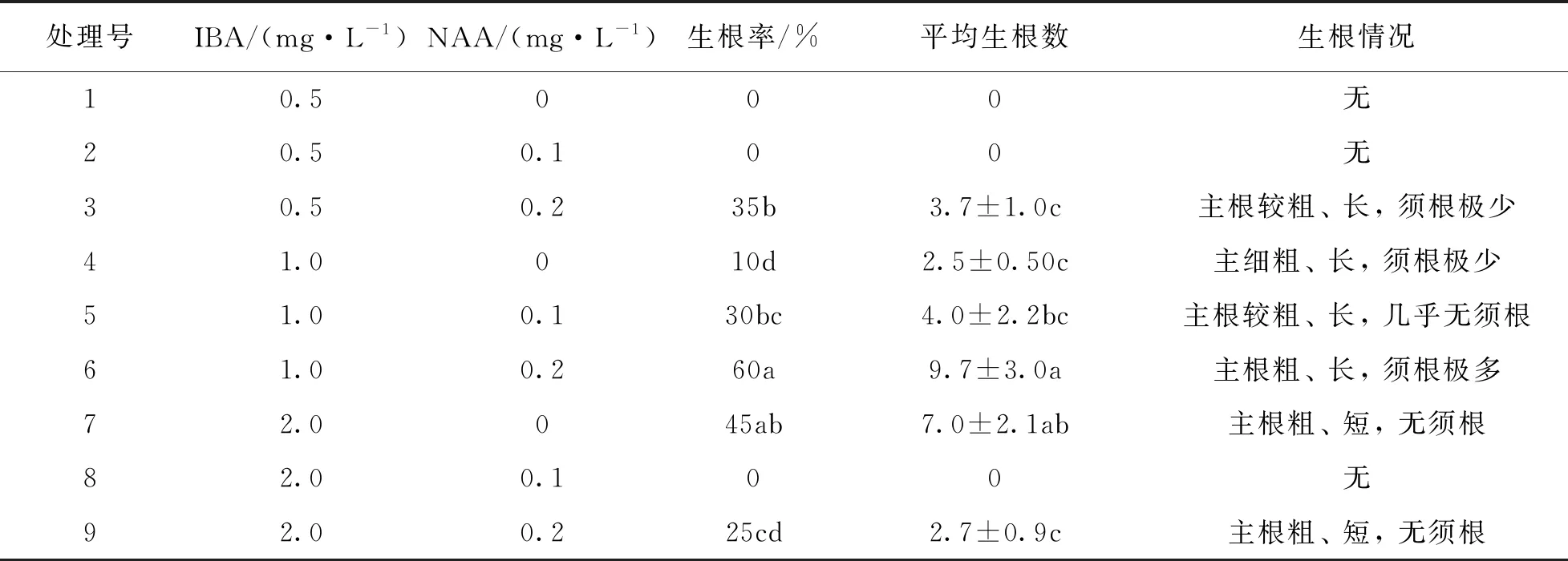
表4 IBA和NAA浓度对花红不定芽生根的影响

图1 花红子叶诱导不定芽再生过程
3 讨 论
以往对花红组织培养的研究中,多以幼胚和带芽茎段为外植体建立快繁体系,但是繁殖系数受胚发育程度和茎段木质化影响较大[5-7].二球悬铃木再生研究表明,子叶再生体系较叶片再生体系受基因型影响较小、组织肥厚不易褐化、再生效率更加稳定[8],并且子叶具有丰富的营养物质,作为外植体被广泛应用于不定芽再生体系中[9-10].幼胚发育至接近子叶期才有不定芽发生的能力[11],且成熟胚子叶作为外植体再生不定芽诱导率较高,再生能力较强[12].本试验研究了花红的幼胚、成熟胚的子叶和叶片离体再生不定芽的能力,结果仅有花红成熟胚的子叶作为外植体,成功建立了花红的离体再生体系.杨海峰[13]认为全光照是获得高效再生的关键技术之一,但也有研究指出,前期暗培养有利于不定芽的再生[14-16].本研究的结果表明,暗培养7 d比直接光照培养更有利于花红子叶再生不定芽,且近胚端再生率显著高于远胚端,导致该结果的主要因素可能是与子叶近胚端到远胚端IAA(吲哚乙酸)信号逐渐减弱、生长素差异分布有关[17].
生长调节物质的种类和含量对植物离体再生植株的影响极大[18],其对植物器官直接发生途径的影响首先表现在对不定芽的诱导上[19].前人的研究结果[20-21]表明,TDZ较6-BA更有利于离体不定芽的再生,TDZ能显著促进较难诱导分化的植物的离体培养,能有效改善其诱导率[22-23].有研究证实,适宜浓度的TDZ是诱导西瓜外植体分化的关键,低浓度NAA也有利于西瓜外植体的分化[24].TDZ与NAA的适宜浓度比能促进花红不定芽的分化,但高浓度TDZ会明显抑制不定芽的再生,且诱导出的不定芽失绿,生长缓慢,后期褐化死亡.
当NAA浓度高于1.0 mg/L时会加重组培苗玻璃化效应,而低浓度的6-BA能有效降低玻璃化效应[25].在花红增殖培养过程中,高浓度6-BA和NAA的组合使得组培苗出现玻璃化现象,叶片变脆,丛芽难以分离成单株等问题.宋常美等[26]的研究表明,壮苗培养可适当加入赤霉素(GA),GA不仅能促进增殖,还能促进生根,缩短了壮苗的时间.万莹[6]的研究由于激素用量、基本培养基不适及品种性能等原因,导致在来安花红离体快繁的研究中未获得生根试管苗.本试验综合“锡金海棠”和“青砧一号”的生根培养基[27],通过IBA和NAA适宜的浓度配比成功获得了花红生根苗.
综上所述,本研究以花红成熟子叶作为外植体,接种于含有1.0 mg/L TDZ和0.05 mg/L NAA的MS培养基中,可高效诱导出花红不定芽.经生根培养后可获得完整再生植株,实现花红再生体系的优化.再生体系的建立为进一步开展花红的细胞工程及基因工程遗传育种奠定了技术基础.

