血清Runx2 mRNA表达与尿毒症患者动脉血管钙化的关系研究
胡春燕,刘兰,张东雪,张园,朱荣芳
目前,慢性肾脏病的发病率与病死率呈逐年上升趋势[1],而尿毒症是终末期慢性肾脏病。血管钙化是尿毒症患者常见的并发症,是心血管疾病发病率和死亡率增高的独立危险因素[[2-3]。因此,寻找尿毒症患者动脉血管钙化的危险因素及评估预测方法十分必要。血管钙化类似于骨的形成,是由于外源性刺激使血管平滑肌细胞发生了表型转化[4]。Runt相关转录因子2(runt-related transcription factor 2,Runx2)是转录因子Runt家族成员之一。越来越多的研究显示Runx2与血管钙化的发生发展密切相关,在血管钙化过程中发挥着重要的促进作用[5-6]。但是,目前尚不确定血清Runx2基因表达水平是否对尿毒症患者动脉血管钙化有诊断预测价值,因此本研究尝试探讨血清Runx2基因表达在评估尿毒症患者血管钙化中的作用,旨在为血管钙化相关疾病的诊断及预测提供新思路。
1 对象与方法
1.1 研究对象 选取2020年1月—2021年2月于河北医科大学第四医院行自体动静脉内瘘成形术及自体动静脉内瘘切除重造术的尿毒症患者78例为研究对象,其中男47例,女31例,平均年龄(55.13±12.08)岁。纳入标准:(1)年龄>18岁。(2)透析时间≥8 h∕周且透析龄≥3个月。排除标准:(1)患有心脏病、脑卒中、多结节性动脉炎、巨细胞动脉炎、系统性红斑狼疮者。(2)合并急性感染、严重营养不良、恶性肿瘤、血液系统疾病者。(3)合并严重肝功能不全、消化及呼吸功能不全者。(4)应用免疫抑制剂、糖皮质激素以及抗癫痫药物者。(5)临床资料不全者。根据硝酸银染色结果进行钙化评分,并将患者分为钙化组(n=23)和未钙化组(n=55)。本研究已通过医院伦理委员会审核,患者均已签署知情同意书。
1.2 主要试剂与仪器 PCR引物(中实同创有限公司,中国)、实时荧光定量PCR试剂盒(广州易锦生物技术有限公司,中国)、Runx2抗体(Abcam公司,英国)、二抗(罗氏,瑞士)。全自动免疫组化仪、化学发光仪(罗氏,瑞士),高速冷冻离心机和实时荧光定量PCR仪(Thermo,美国),分光光度计(EMCLAB公司,德国),全自动血细胞分析仪、全自动生化分析仪(贝克曼库尔特,美国)。
1.3 研究方法
1.3.1 资料收集 收集患者的一般资料:性别、年龄、透析龄、血压、心率、原发病。患者行动静脉内瘘手术前1 d,抽取清晨空腹8 h的肘正中静脉血2~4 mL,送本院检验中心检测,包括:血红蛋白(Hb,库尔特原理)、透析前血肌酐(Scr,酶法)、葡萄糖(己糖激酶法)、血钙(偶氮胂Ⅲ法)、血磷(磷钼酸紫外终点法)、血钠(电极法)、全段甲状旁腺素(iPTH,电化学发光法)、白蛋白(溴甲酚绿法)、三酰甘油(酶法)、总胆固醇(酶法)。
在行自体动静脉内瘘成形术及自体动静脉内瘘切除重造术时收集患者动脉血管,要求在保证患者手术成功的前提下,取动脉血管切口部位全层动脉血管,尽快放入10%福尔马林固定24 h,之后进行脱水、浸蜡等处理,最终包埋成蜡块,可长久保存,需要时进行切片处理。组织玻片进行脱蜡处理后进行后续实验。
1.3.2 血管硝酸银染色 将5%硝酸银滴加到玻片上,紫外光照射1 h,于碱性品红溶液中复染,显微镜下观察,钙盐沉积呈黑色。0分,无钙盐沉积;1分,点状钙盐沉积;2分,单个片状钙盐沉积;3分,多个片状钙盐沉积;4分,弥漫性围绕管腔的钙盐沉积[7]。0分为未钙化组,评分≥1分为钙化组。
1.3.3 免疫组化测定血管Runx2表达 使用全自动免疫组化染色仪进行染色、修复,呈棕黄色为Runx2阳性。随机读取5个高倍视野,依照细胞阳性染色程度评分。1分,弱阳性;2分,中等强度;3分,强阳性。依照阳性细胞数评分为:≤25%为0分,26%~50%为1分,51%~74%为2分,≥75%为3分。阳性细胞和染色强度积分相加为0~6分[8]。
1.3.4 实时荧光定量PCR(qPCR)测定Runx2 mRNA表达水平 提取各组患者血清中的总RNA。利用反转录试剂对总RNA进行反转录,得到cDNA。引物序列Runx2:上游引物5'-CCCAGTATGAGAGTAGGTGTCC-3',下游引物5'-GGGTAAGACTGGTCATAGGACC-3',产物大小149 bp;GAPDH:上游引物5'-GTCTCCTCTGACTTCAACAGCG-3',下游引物5'-ACCACCCTGTTGCTGTAGCCAA-3',产 物 大 小131 bp,GAPDH为内参。反应体系20μL,即qPCR Mix 10μL、cDNA 2μL、上游引物2μL、下游引物2μL、补水至20μL,反应条件:95℃变性10 s、60℃退火20 s、72℃延伸10 s,40个循环,采用2-ΔΔCt法计算Runx2 mRNA表达水平。
1.4 统计学方法 采用SPSS 22.0软件进行数据分析,符合正态分布的计量资料以±s表示,组间比较采用t检验;不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-WhitneyU检验。计数资料以例表示,组间比较采用卡方检验。相关性分析采用Spearman法。影响因素采用多元线性回归分析。受试者工作特征(ROC)曲线用于评价Runx2对血管钙化的诊断预测效能,P<0.05为差异有统计学意义。
2 结果
2.1 血管组织钙化及Runx2表达情况 硝酸银染色结果显示,钙化组黑色沉积较未钙化组显著增多;免疫组化染色显示,与未钙化组相比,钙化组Runx2棕黄色沉积显著增多,见图1。钙化组钙化评分为3.0(2.0,4.0)。未钙化组和钙化组Runx2评分分别为1.00(0.00,1.00)和3.00(2.00,4.00),钙化组Runx2评分显著升高(Z=6.239,P<0.01)。

Fig.1 Human vascular tissue calcification and Runx2 expression图1 人血管组织钙化及Runx2表达情况
2.2 2组患者的临床指标分析 钙化组年龄、透析龄、血清Runx2 mRNA水平、血磷、iPTH显著高于未钙化组,而血白蛋白和血钙水平显著低于未钙化组(P<0.05),见表1。
2.3 各临床指标与患者血管钙化评分的相关性分析 相关分析结果显示,血清Runx2 mRNA水平、年龄、透析龄、血磷、iPTH、Runx2评分均与钙化评分呈正相关(rs分别为0.624、0.310、0.640、0.280、0.400和0.685,均P<0.05);血白蛋白和血钙与钙化评分呈负相关(rs分别为-0.260和-0.542,均P<0.01)。
2.4 血管钙化的多元线性回归分析 以钙化评分为因变量,血清Runx2 mRNA水平、年龄、透析龄、血钙、血磷、白蛋白、iPTH为自变量进行多元线性回归分析,结果显示血清Runx2 mRNA表达水平升高、高透析龄和低血钙是血管钙化的影响因素(P<0.05),见表2。
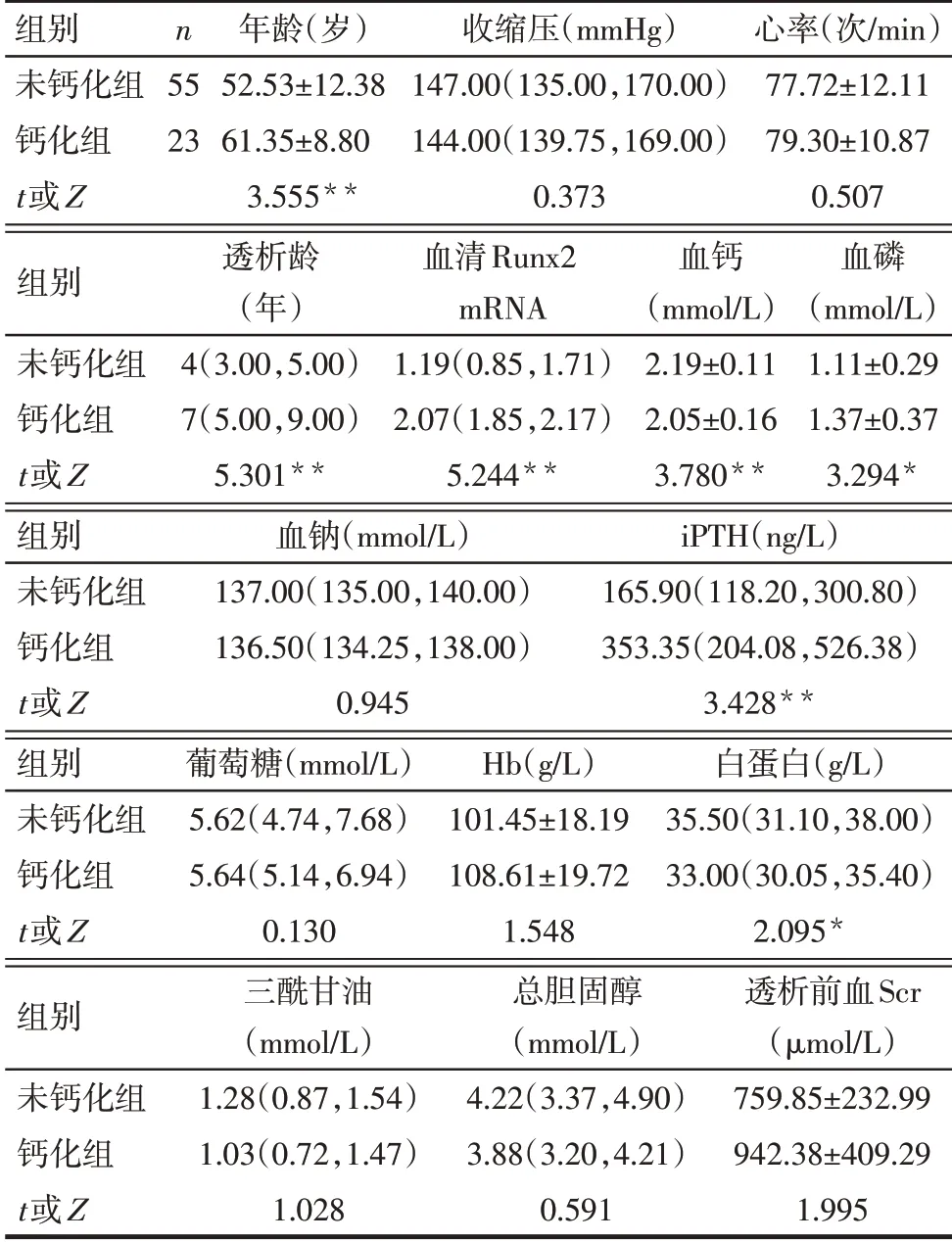
Tab.1 Analysis of clinical indicators of the two groups of patients表1 2组患者的临床各指标情况分析

Tab.2 Multiple linear regression analysis of vascular calcification表2 血管钙化的多元线性回归分析
2.5 血清Runx2 mRNA、透析龄和血钙对血管钙化的诊断价值 ROC曲线显示,血清Runx2 mRNA、透析龄和血钙三者联合诊断时的曲线下面积(AUC)为0.934,敏感度为95.65%,特异度为76.36%,见表3、图2。

Tab.3 Predictive efficacy of serum Runx2 mRNA,serum calcium and dialysis age in the diagnosis of vascular calcification表3 血清Runx2 mRNA、血钙和透析龄对血管钙化诊断的预测效能

Fig.2 The ROC curve of serum Runx2 mRNA,blood calcium and dialysis age alone and in combination with the detection of vascular calcification图2 血清Runx2 mRNA、血钙和透析龄单独及联合预测血管钙化的ROC曲线图
3 讨论
尿毒症患者动脉钙化程度与病死率呈正相关[3]。早发现、早干预,防止血管钙化的发生发展对于提高尿毒症患者的生活及生存质量至关重要。尿毒症患者动脉血管钙化主要表现为血管中膜钙化,即动脉中膜的内弹力层出现羟磷灰石晶体钙的线性沉积,类似于骨的形成[4,9]。尿毒症患者血管钙化并非钙磷被动沉积于血管壁,而是由血管平滑肌细胞介导的可调过程,是由多种调节因素参与调控的类似骨形成的复杂病理过程,主要表现为血管中膜的血管平滑肌细胞由正常的收缩表型向成骨样表型转化[10-11],促进成骨分化相关转录因子Runx2等表达增加,进而促进下游一系列骨相关蛋白表达[12],最终导致钙磷等矿物质异常沉积于血管壁。
本研究中2组患者的动脉Runx2免疫组化染色显示,钙化组血管Runx2表达升高,表明发生钙化的血管成骨分化相关转录因子Runx2表达增加。钙化组血清Runx2 mRNA水平高于未钙化组,血清中Runx2表达增加可能诱导动脉中膜层的血管平滑肌细胞钙化。Patidar等[13]在体外实验研究中表明,尿毒症患者血清能够通过诱导Runx2的表达,进而促进血管平滑肌细胞钙化,与本研究结果一致。有研究证实,敲低Runx2表达可以抑制血管平滑肌细胞发生表型变化,抑制钙化的发生,而过表达Runx2会促进血管平滑肌细胞发生表型变化,促进钙化的发生[14-15]。本研究中血清Runx2 mRNA水平升高是血管钙化的影响因素,且与钙化评分呈正相关,提示血清Runx2 mRNA水平升高促进了血管钙化的发生。ROC曲线结果显示,血钙的AUC最小,即血钙对模型的影响最小。血清Runx2 mRNA、透析龄和血钙三者联合时AUC最大,因此血清Runx2 mRNA、透析龄和血钙水平联合对血管钙化具有较高的诊断预测价值。
本研究钙化组的年龄、透析龄、血磷、iPTH显著高于未钙化组,与钙化评分呈正相关;而血白蛋白和血钙水平显著低于未钙化组,与钙化评分呈负相关。回归分析显示,高透析龄与低血钙是血管钙化的影响因素,与Cozzolino等[16]研究结果一致。高iPTH、高磷血症、低钙血症是尿毒症患者常见的并发症,其中高磷血症是血管钙化发生的始动因素和中心环节,而随着年龄增加和透析时间延长,高磷血症的发生率也增高,可能会诱发血管平滑肌细胞发生表型转化,增加尿毒症患者血管钙化发生的风险[17-19]。所以,纠正高血磷和低血钙、降低iPTH是临床预防血管钙化的主要措施。也有研究证实,高磷可通过钠依赖性磷酸盐共转运蛋白促使血管平滑肌细胞发生表型转化,进而导致钙化[20]。有研究表明尿毒症患者低血白蛋白与高炎症状态密切相关,而高炎症状态可增加血管钙化的风险[21]。López-Mejías等[22]研究表明炎性因子白细胞介素-6可诱导血管平滑肌细胞发生表型转化,进而导致血管钙化。
本研究为单中心的横断面研究,样本量小,不能排除其他混杂性因素的影响,且研究为RNA水平,故具有一定的局限性。今后需扩大样本量并增加对Runx2蛋白水平的研究,对本研究的结论进行验证。
综上所述,血清Runx2 mRNA水平显著升高是尿毒症患者发生血管钙化的影响因素,其与透析龄、血钙联合用于评估时的诊断预测效能更高。血清Runx2 mRNA可能成为诊断预测尿毒症患者血管钙化的生物学标志物,为血管钙化相关疾病的诊断及预测提供新思路。

