冲服水温对三七粉散瘀止血作用的影响
孙学勤,梁 笑,桂双英*
冲服水温对三七粉散瘀止血作用的影响
孙学勤1,梁 笑2,桂双英2*
(1. 安徽中医药大学第一附属医院,合肥 230031;2. 安徽中医药大学,合肥 230012)
三七粉(powder,PNP)“散瘀止血”功效明确,临床上多以水冲服。为探究冲服水温对三七粉散瘀止血作用的影响,为患者服用三七粉提供一定参考,分别采用细菌内毒素(LPS)与角叉菜胶(Ca)制备血瘀证模型,机械损伤建立大鼠外伤出血模型,测定全血黏度、血浆黏度、红细胞聚集指数和凝血4项(PT、APTT、Fib和TT)等血流变和凝血指标;测定TNF-α、IL-1β和IL-6等炎症因子水平;测定出血时间(BT)和凝血时间(CT)等止血指标,来评价不同温度(30、40、50和100 ℃)水冲服对三七粉散瘀、止血作用的影响。结果显示,三七粉可改变SD大鼠血液流变学行为,降低血液黏度,抑制血栓形成。水浴温度对三七粉的散瘀作用具有显著影响,在一定温度范围(30 ~ 40 ℃)内可显著降低血瘀证大鼠全血黏度和正常大鼠血浆黏度,改善血液流变特性。
三七;冲服水温;散瘀;止血
三七为五加科植物三七(Burk.) F. H. Chen 的干燥根和根茎,是我国名贵药材,具有散瘀止血,消肿定痛之功效,主治咯血、吐血、衄血、便血、崩漏、外伤出血、胸腹刺痛和跌扑肿痛[1]。临床多以研末处理,三七粉为2020版《中国药典》(一部)三七项下唯一饮片形式,内用或外用皆可。《本草纲目》记载:赤痢血痢,三七三钱研末,米泔水调服即愈。大肠下血,三七研末,同淡白酒调一二钱,服三服可愈[2]。三七除药用外,还被广泛用于养生保健。原国家卫生部于2002年将三七列入“可用于保健食品的物品名单”(卫法监发[2002] 51号),1994年美国“膳食补充健康和教育法”,将三七和含三七类产品归类为膳食补充剂[3]。据调查,目前有很多人日常自行服用三七粉养生保健,我国三七需求量逐年递增。伴随三七粉的热销,随之而来的问题是如何服用三七粉更合适。
三七中含有大量淀粉粒。研究发现一些含较多淀粉粒的中药(如贝母),冲服水温对其活性成分溶出行为有较大的影响,随着水温升高、淀粉粒发生糊化形成致密层,使得水分子难以进入药材内部,有效成分难以溶出[4-5]。课题组前期研究发现不同温度(30、40、50和100 ℃)水冲悬后的三七粉有效成分溶出速率不同[6],在此基础上,本研究分别采用细菌内毒素(lipopolysaccharide,LPS)与角叉菜胶(carrageenan,Ca)联合造模[7]的大鼠血瘀证模型及机械损伤的大鼠外伤出血模型,考察不同冲服水温对三七粉散瘀止血作用的影响,以期为三七粉合理使用提供依据。
1 材料与方法
1.1 材料
1.1.1 试验动物 SD大鼠,雄性,SPF级,体质量(200 ± 20)g,由安徽医科大学实验动物中心提供,许可证号SCXK(皖)2017-001,动物合格证号:1107261911002543。常规饲养1周,以适应环境。饲养环境:温度20 ~ 25 ℃,湿度40% ~ 60%。
1.1.2 药物与试剂 三七,120头,批号:1701166,购自安徽亳药千草国药股份有限公司,经安徽中医药大学彭华胜教授鉴定为五加科植物三七(Burk.) F. H. Chen 的干燥根;三七粉(自制,最细粉,过150目筛);细菌内毒素(LPS,批号:320V035),购自Solarbio公司;角叉菜胶(Ca,批号:ZT18139K),购自合肥博美生物科技有限责任公司;阿司匹林泡腾片(批号:1806211),购自AstraZeneca公司;云南白药(批号:ZLA1732),购自云南白药集团股份有限公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),白介素1β(interleukin-1β,IL-1β),白介素6(interleukin-6,IL-6)ELISA试剂盒(批号:201905),均购自酶免;凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activeated partial thromboplasting time,APTT)、纤维蛋白原(fibrinogen,Fib)和凝血酶时间(thrombin time,TT)测定试剂盒(批号:562889、556932A、547583和48723),均购于SIEMENS公司。
1.1.3 仪器 SA-9000全自动血流变仪(北京赛科希德科技发展有限公司);CS-5100全自动凝血分析仪(日本SYSMEX株式会社);5430R高速冷冻离心机(德国Eppendorf公司)。
1.2 方法
1.2.1 散瘀作用研究 (1)溶剂配制。LPS用生理盐水配制成1 g·L-1储备液,用0.22 μm滤膜除菌后,4 ℃冰箱保存备用,临用前稀释至50 mg·L-1。Ca用生理盐水配成10 g·L-1,沸水浴1 h使之完全溶解后,冷却备用。
(2)造模与分组。雄性SD大鼠70只,随机分为7组,正常组,模型组,阳性对照组(阿司匹林,3.6 mg·kg-1)和不同水浴温度(30、40、50和100 ℃)处理的三七粉给药组(PNP组,810 mg·kg-1),每组10只,正常组和模型组灌胃纯水,给药持续14 d。模型组及各给药组大鼠于给药第12 天腹腔注射Ca 25 mg·kg-1,16 h后再静脉注射LPS 50 μg·kg-1;正常组则在模型组给予Ca和LPS时分别腹腔注射和静脉注射给予相同体积的生理盐水。给药第14 天,各组大鼠处死前禁食12 h,自由饮水,10%水合氯醛麻醉大鼠,腹主动脉取血,分别置于肝素钠和枸橼酸钠抗凝的血液生化管存放。
(3)组织病理学检查。于给药第14 天处死,从距尾尖部约2 cm处横切鼠尾,10%福尔马林固定。石蜡切片,HE染色,病理学检查,观察血管内的血栓形成情况。
(4)血液流变学和凝血指标测定。取肝素钠抗凝血2 mL,1 mL检测全血黏度,剩余抗凝血离心(3 000 r·min-1,10 min),取血浆,测定血浆黏度。取枸橼酸钠抗凝血2 mL,离心(3 000 r·min-1,10 min),取血浆,测定凝血4项指标(PT、APTT、Fib和TT)。
(5)生化指标测定。造模2 h后,大鼠眼眦取血,至非抗凝离心管中,37 ℃水浴,至血块凝结,离心(3 000 r·min-1,10 min),取血清,ELISA法测定TNF-α、IL-1β和IL-6。
1.2.2 止血作用研究 (1)分组及给药。雄性SD大鼠60只,随机分为6组,正常组,阳性对照组(云南白药,YNBY,135 mg·kg-1),不同水浴温度(30、40、50和100 ℃)处理的三七粉给药组(810 mg·kg-1),每组10只,正常组灌胃纯水,连续给药14 d。给药第14 天,各组大鼠处死前禁食12 h,自由饮水,10%水合氯醛麻醉大鼠,腹主动脉取血,分别置于肝素钠和枸橼酸钠抗凝的血液生化管存放。
(2)出血时间(bleeding time, BT)测定。于末次给药后30 min,以利剪将大鼠尾尖0.5 cm处横断,待血液自然流出后计时,每隔30 s用滤纸吸去血滴1次,直至血液自然停止(滤纸吸时无血斑),秒表记录并计算出血时间[8-9]。
(3)凝血时间(coagulation time, CT)测定。于末次给药后1 h,用长10 cm、内径1 mm的毛细玻璃管由大鼠眼睑插入眦球后静脉丛,深约4 ~ 5 mm采血,血液注满后取出毛细管平放于桌上,立即用秒表计时,每隔15 s折断两端毛细玻璃管约1.5 cm,并缓慢向左右拉开,直至血凝丝出现为止,所用时间即为凝血时间[10-11]。
(4)血液流变学和凝血指标测定。同“1.2.1(4)”项方法。
2 结果与分析
2.1 散瘀作用
HE染色结果表明(图1),与正常组相比,模型组的血栓数量明显增加。血液流变学结果(表1)显示,与正常组比较,模型组大鼠全血黏度在不同切变率下均具极显著性差异(< 0.01),黏度明显升高,红细胞聚集指数显著升高(< 0.05),说明造模后大鼠血液呈“黏、聚”状态;凝血指标结果(表2)显示模型组APTT和TT指标均极显著性延长 (< 0.01),呈现低凝状态,与文献[12-15]报道的一致,表明模型建立时消耗了大量凝血因子和血小板;FIB含量极显著性增加(< 0.01),表明大鼠血瘀症模型造模成功。
各给药组病理切片结果相似,均有抗血栓形成效果。与模型组相比,40 ℃处理的三七粉组抑制血栓形成效果显著。各给药组不同切变率下的全血黏度、血浆黏度和红细胞聚集指数均呈下降趋势,其中各给药组的血浆黏度与模型组相比均具显著性差异(< 0.05);不同温度水冲服后的三七粉组与模型组相比,30、40和50 ℃处理组全血黏度均显著降低(< 0.05);40 ℃处理组红细胞聚集指数显著降低(< 0.05)。各给药组凝血4项指标与模型组相比,APTT和TT值均显著下降(< 0.01),表明三七粉可有效缓解模型大鼠的低凝状态;三七粉给药组均可显著降低升高的FIB值(< 0.05),表明三七粉具有抗血栓形成的作用。
由图2可知,模型组大鼠血清中的TNF-α、IL-1β和IL-6水平较正常组升高,各给药组的炎症因子水平均呈下降趋势,但均无显著性差异。
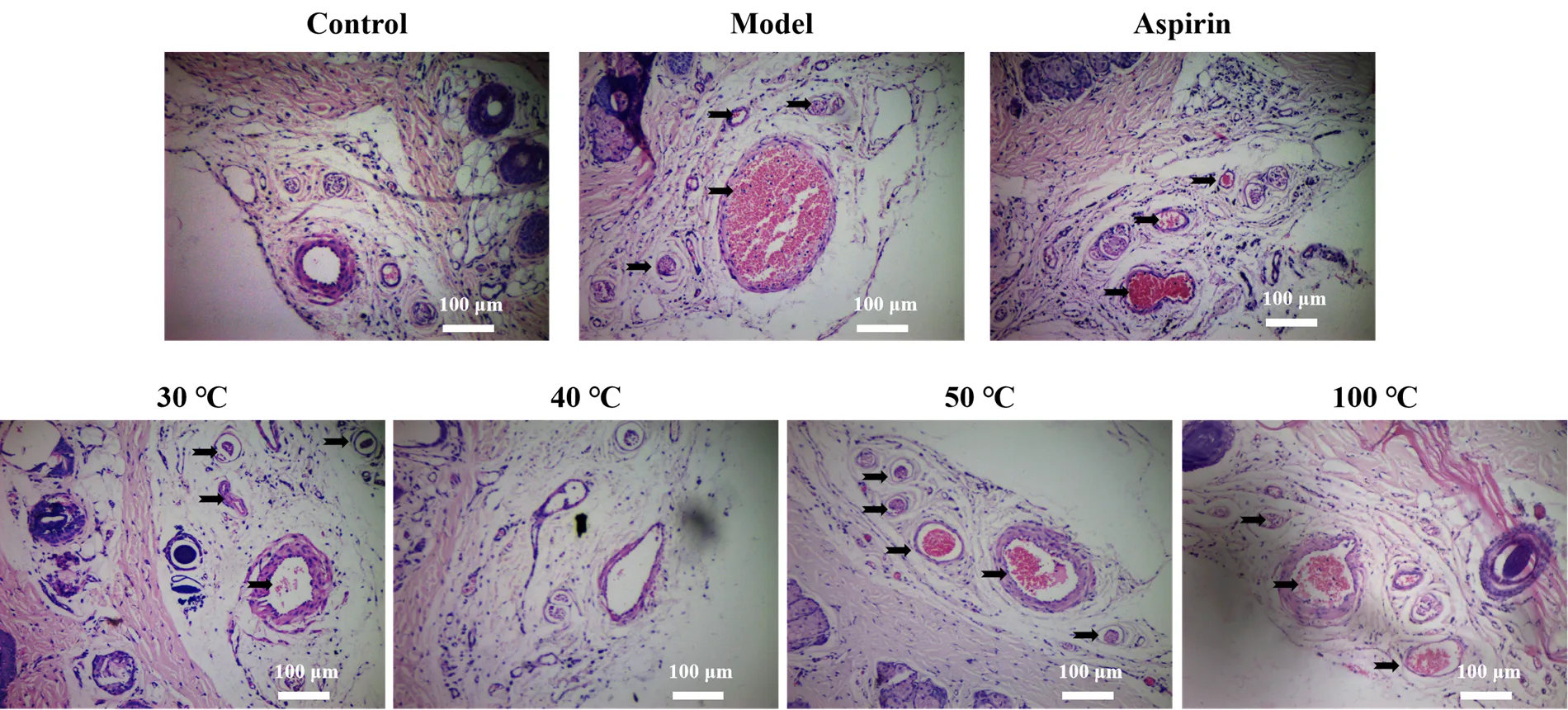
箭头指示血栓,基准尺比例,100 μm。
Figure 1 Effects of PNP on thrombosis
2.2 止血作用
三七粉对大鼠出血时间(BT)和凝血时间(CT)结果(表3)表明,与正常组相比,各三七粉给药组BT均显著延长,各组凝血时间均无显著性差异。血液流变学结果(表4)显示,给药组与正常组相比,全血黏度和红细胞聚集指数均无显著性差异,30和40 ℃处理的三七粉组血浆黏度显著降低(< 0.05);凝血4项指标(表5)中,各给药组PT、APTT和Fib均存在下降趋势,其中40和50 ℃处理组中APTT值显著降低。结果提示三七粉内服对外伤出血无止血效果。
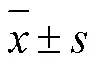
表1 三七粉对血瘀证大鼠血液流变学指标和红细胞类指标的影响(, n = 10)
注:PNP为三七粉给药组,< 0.05,< 0.01,均与正常组比较。< 0.05,< 0.01,均与模型组比较。下同。

表 2 三七粉对血瘀证大鼠凝血指标的影响(, n = 10)

#P < 0.05,与模型组比较。(a) TNF-α; (b) IL-1β; (c) IL-6.
Figure 2 Effects ofpowder on the levels of TNF-α,IL-1β and IL-6 in rats with blood stasis(mean ± SD,= 10)

表3 三七粉对大鼠出血时间和凝血时间的影响(, n = 10)
注:< 0.05,< 0.01,均与正常组比较。下同。

表4 三七粉对大鼠血液流变学指标和红细胞类指标的影响(, n = 10)
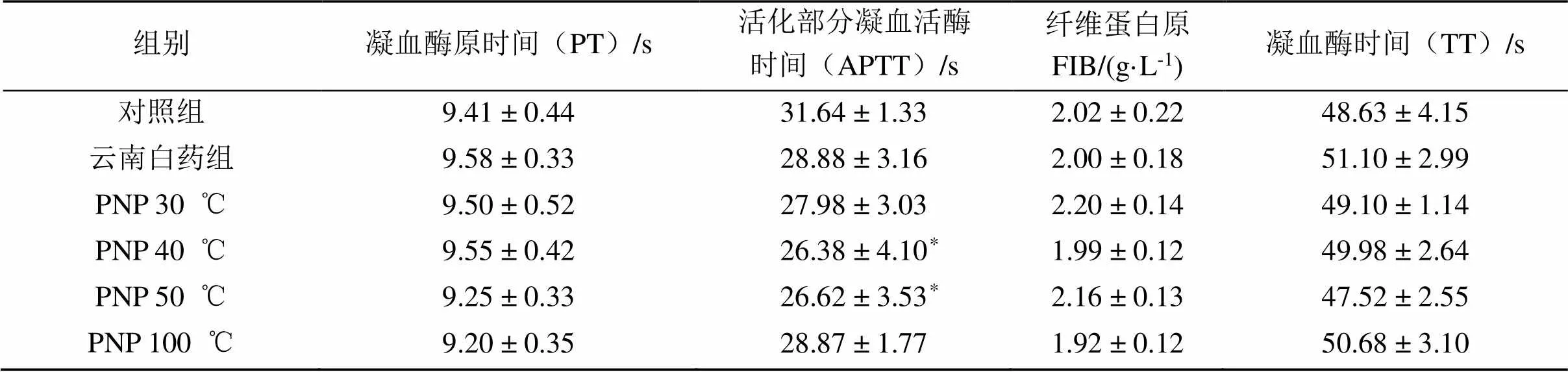
表5 三七粉对大鼠凝血指标的影响
3 讨论与结论
我国关于血瘀证较为系统的认识最早出自《内经》,其中关于血瘀的证和因阐述如下:1)损伤瘀血,《素问·刺腰痛篇》:“得之,重伤腰,……恶血归之”;2)寒凝瘀血,《素问·八正神明论》:“天寒日阴,则人血凝泣”;3)大怒瘀血,《素问·生气通天论》:“大怒则形气绝,而血菀於上,使人薄厥”;4)病久入深瘀血,《素问·痹论》:“病久入深,营卫之行涩,经络时疏、故不通”;5)瘀血五脏卒痛,《素问·举痛论》:“寒气客于肠胃之间,膜原之下,血不得散、小络急引,故痛”。从中医角度来看,血瘀证的形成跟神经精神、环境、体质和外伤等因素有着密切关系。目前血瘀证动物模型的建立可通过物理刺激如电针刺激、定量化重力击伤器等,也可采用化学物质刺激如腹腔注射高分子右旋糖酐、腹腔注射肾上腺素等,此外还有研究者采用化学刺激与物理刺激结合的方法如注射肾上腺素的同时加以冰水浸泡来建立血瘀证模型[16-20]。
通过文献调研及预试验,发现通过物理刺激或注射肾上腺素建立的血瘀模型存在重复性差、形成的血瘀持续时间短等缺陷,故本研究最终采用以细菌内毒素(LPS)与角叉菜胶(Ca)两种因素联合造模。LPS可诱导单核巨噬细胞、淋巴细胞和内皮细胞分泌大量炎性因子(TNF-α、IL-6和IL-1等),出现炎症反应[12]。Ca可致大鼠炎症模型,诱使大鼠全身发热以及体内IL-1β水平显著升高[21-23]。LPS与Ca联用可诱导单核巨噬细胞、淋巴细胞和内皮细胞分泌大量炎性因子,激活外源性凝血系统,形成血栓[24-29]。文献报道LPS与Ca联合造模后产生的TNF-α和IL-6在血液中持续时间较短,造模8 h即恢复正常,2 h为TNF-α和IL-6产生的高峰时间,故将取样时间定为造模后2 h[7]。
散瘀试验结果表明:30、40和50 ℃处理的三七粉可显著降低血瘀证大鼠血液的“黏”态,40 ℃处理组对血液“聚”态的影响最为显著;且三七粉各组均能有效缓解血瘀大鼠的低凝状态对抗血栓的形成。表明三七粉内服散瘀作用显著,其中以40 ℃水冲服处理最佳。此外三七对于炎性因子的影响目前已有相关报道[30-31],但本试验结果显示无论是模型组还是给药组炎症因子水平均无显著性差异,这一差异可能是由于造模方法不同所引起,但整体趋势与文献报道基本一致。止血作用研究结果显示,各给药组与对照组相比凝血时间无显著性差异,出血时间显著延长,血浆黏度降低,出现抑制凝血功能的趋势。该结果表明三七粉内服对大鼠外伤基本无止血作用,提示三七粉治疗外伤出血不宜内服。
综上,三七粉可改变SD大鼠血液流变学行为,抑制血栓形成。冲服水温差异对三七粉的散瘀作用有显著影响,40 ℃温水冲服效果最佳。
[1] 国家药典委员会. 中华人民共和国药典一部 (2020年版)[M]. 北京: 中国医药科技出版社, 2020.
[2] YOUNG A L, BASS I S. The dietary supplement health and education act[J]. Food Drug Law J, 1995, 50(2): 285-292.
[3] 覃军, 陈艳红, 罗明超, 等. 浙贝母超微粉、粗粉和饮片中3种生物碱体外溶出度的比较[J]. 中成药, 2017, 39(6): 1232-1235.
[4] CHEN L, TIAN Y Q, MCCLEMENTS D J, et al. A simple and green method for preparation of non-crystalline granular starch through controlled gelatinization[J]. Food Chem, 2019, 274: 268-273.
[5] LIANG X, XU G, LI Z, et al. Effect of micronization on: in vitro dissolution and in vivo bioavailability evaluations[J]. Evid Based Complement Alternat Med, 2021, 2021: 8831583.
[6] 梁爱华, 丁晓霜, 李文, 等. 血瘀证与血栓形成病证结合动物模型的研究[J]. 中国中药杂志, 2005, 30(20): 1613-1616.
[7] 黄潇, 刘婧, 付小梅, 等. 基于CRITIC法计算权重系数的Box-Behnken响应面法优化栀子炭微波炮制工艺研究[J]. 中草药, 2017, 48(6): 1133-1138.
[8] 赵雍, 郭静, 刘婷, 等. 槐花制炭后新止血成分的药理研究[J]. 中国中药杂志, 2010, 35(17): 2346-2349.
[9] 李娴, 卫向龙, 李凯, 等. 生地黄炭及熟地黄炭对小鼠出、凝血时间的影响[J]. 中华中医药杂志, 2013, 28(4): 927-929.
[10] 苏文龙, 曹文正, 李函阳, 等. 响应面法优选黄芩炭炮制工艺研究[J]. 中华中医药学刊, 2020, 38(11): 214-217, 293.
[11] 梁爱华, 刘婷, 李春英, 等. 一种热毒诱导的血栓形成动物模型的建立[J]. 中国中药杂志, 2008, 33(18): 2124-2128.
[12] 梁爱华, 黄璐琦, 于长安, 等. LPS/Ca诱导血栓形成与血瘀证病证结合模型的炎症机制[J]. 中国中药杂志, 2007, 32(1): 45-48.
[13] 梁爱华, 于长安, 李春英, 等. 内毒素与角叉菜胶联合诱导的血栓形成模型的动物差异性比较[J]. 中国中药杂志, 2006, 31(1): 57-61.
[14] 梁爱华, 丁晓霜, 李文, 等. 血瘀证与血栓形成病证结合动物模型的研究[J]. 中国中药杂志, 2005, 30(20): 1613-1616.
[15] 任建勋, 林成仁, 王敏, 等. 多因素整合建立气滞血瘀证动物模型研究[J]. 中药药理与临床, 2007, 23(5): 210-211.
[16] 王凤杰, 杨玉华, 王婷, 等. 不同来源天南星外用对大鼠外伤性血瘀模型的影响[J]. 中医学报, 2017, 32(12): 2408-2414.
[17] 杨涛, 胡昌江, 李文兵, 等. 生、熟大黄对高分子右旋糖酐所致血瘀大鼠血液流变性的比较[J]. 中国实验方剂学杂志, 2012, 18(21): 248-250.
[18] 莫恭晓, 黄晓军, 韦邱梦, 等. 大黄和虎杖对血瘀症模型大鼠血流动力学和血脂的影响[J]. 中国临床药理学杂志, 2018, 34(1): 38-40.
[19] 李伟霞, 黄美艳, 唐于平, 等. 大鼠急性血瘀模型造模方法的研究与评价[J]. 中国药理学通报, 2011, 27(12): 1761-1765.
[20] 于宜平, 张艳, 李红, 等. 黄芩苷对角叉菜胶致热大鼠解热作用的PK-PD模型研究[J]. 中草药, 2014, 45(4): 527-531.
[21] 刘彦霞, 赵肖萌, 温宗妍, 等. 角叉菜胶两种给药方式制备小鼠尾部血栓模型比较[J]. 中西医结合心脑血管病杂志, 2013, 11(7): 849-850.
[22] 魏陵博, 戎冬梅, 吉中强, 等. 角叉菜胶致大鼠尾部血栓形成的机制[J]. 中西医结合心脑血管病杂志, 2008, 6(5): 542-543.
[23] GLYNN R J, RIDKER P M. Inflammation, venous thromboembolism, and what we can do about it[J]. Eur Heart J, 2018, 39(39): 3615-3617.
[24] WANG L M, DUAN Q L, YANG F, et al. Activation of circulated immune cells and inflammatory immune adherence are involved in the whole process of acute venous thrombosis[J]. Int J Clin Exp Med, 2014, 7(3): 566-572.
[25] SAGHAZADEH A, REZAEI N. Inflammation as a cause of venous thromboembolism[J]. Crit Rev Oncol Hematol, 2016, 99: 272-285.
[26] ENGELMANN B, MASSBERG S. Thrombosis as an intravascular effector of innate immunity[J]. Nat Rev Immunol, 2013, 13(1): 34-45.
[27] SCHULZ C, ENGELMANN B, MASSBERG S. Crossroads of coagulation and innate immunity: the case of deep vein thrombosis[J]. J Thromb Haemost, 2013, 11(Suppl 1): 233-241.
[28] YAO X L, CHEN W P, LIU J, et al. Deep vein thrombosis is modulated by inflammation regulated via sirtuin 1/NF-κB signalling pathway in a rat model[J]. Thromb Haemost, 2019, 119(3): 421-430.
[29] 朱婷, 冯玉, 肖静, 等. 三七皂苷R1不同给药方式对皮肤创伤愈合作用的影响[J]. 中国药理学通报, 2018, 34(3): 325-330.
[30] 李易, 叶曦. 三七多糖对糖尿病肾病大鼠炎症反应及脂质代谢调节作用的实验研究[J]. 中国中医药科技, 2018, 25(1): 43-47.
[31] 王改凤, 张社峰, 王伟民. 三七治疗局灶性缺血性脑梗死模型小鼠的疗效及机制[J]. 中国老年学杂志, 2017, 37(20): 4997-4999.
Effects of temperature on blood stasis and hemostasis of
SUN Xueqin1, LIANG Xiao2, GUI Shuangying2
(1. The First Affiliated Hospital of Anhui University of Chinese Medicine, Hefei 230031;2. Anhui University of Chinese Medicine, Hefei 230012)
powder (PNP) has a clear effect of arresting bleeding by resolving blood stasis, which is often taken by water suspension in clinic. To study the influence of water suspension temperature on PNP effect of arresting bleeding by resolving blood stasis, so as to provide some references for patients taking PNP, lipopolysaccharide (LPS) and carrageenan (Ca) were used to set up blood stasis model, and mechanical damage was used to establish a trauma-hemorrhage model. The effects of water suspension treatment at different temperatures (30, 40, 50 and 100 ℃) on dissipate stasis and stanch bleeding of PNP were evaluated using the whole blood/plasma viscosity, erythrocyte aggregation indexes, four indicators of blood coagulation (PT, APTT, Fib and TT), levels of TNF-α, IL-1β and IL-6, hemostatic properties such as bleeding time (BT) and coagulation time (CT). The results showed that PNP can change hemorheological behavior, reduce blood viscosity and inhibit thrombosis in SD rats. The water bath temperature has a significant influence on the dissolving stasis of PNP, and at a range of temperatures (30 - 40 ℃), it can significantly reduce the whole blood viscosity of rats with blood stasis syndrome and the plasma viscosity of normal rats, and improve the rheological properties of blood.
;hydrothermal temperature; disperse blood stasis; haemostasis
R285; S865.12
A
1672-352X (2021)05-0790-06
10.13610/j.cnki.1672-352x.20211025.001
2021-10-26 8:51:28
[URL] https://kns.cnki.net/kcms/detail/34.1162.S.20211025.1324.002.html
2021-04-01
安徽省重大专项(18030801128)资助。
孙学勤,硕士研究生。E-mail:Sunxmxq0615@163.com
通信作者:桂双英,教授,博士生导师。E-mail:guishy0520@126.com

