高效液相色谱法测定伊格列净片剂的含量
黄佳雯,梁佳威,颜亮,郑枫
(1.中国药科大学,江苏南京 211198;2,南京卡文迪许生物工程技术有限公司,江苏南京 210033)
伊格列净(Ipraliflozin)是C-芳基葡糖苷类结构的高选择性人体钠-葡萄糖协同转运蛋白2(SGLT2)口服活性抑制剂,通过选择性的抑制肾脏近曲小管上皮细胞膜管腔侧的钠-葡萄糖协同转运蛋白2(SGLT2),减少葡萄糖重吸收并促进尿糖排泄,进而降低血糖,同时可减重和降压[1]。该药已于2019 年在美国上市,但未在国内上市,目前未见各国药典对本品的收载及进口注册标准[2]。本研究旨在为仿制药伊格列净的含量测定提供科学性的方法依据及分析技术,保障药品的安全性。
1 实验部分
1.1 仪器和试剂
高效液相色谱仪:Agilent 1200,Agilent 色谱工作站。
伊格列净L-脯氨酸(自制对照品,99.7%)、杂质IMP01(自制对照品,99.5%)、杂质IMP02(自制对照品,99.9%)、杂质IMP03(自制对照品,99.0%)、杂质IMP04(自制对照品,99.5%)、杂质IMP05(自制对照品,99.5%)、杂质IMP06(自制对照品,99.9%)、杂质IMP07(自制对照品,99.7%)、杂质IMP08(自制对照品,99.8%)、磷酸(分析纯,上海阿拉丁生化科技股份有限公司)、甲醇(色谱纯,默克)。
2 方法与结果
2.1 色谱条件
仪器:高效液相色谱仪;色谱柱:Waters Symmetry Shield RP18(3.5μm,3.0×50mm);流动相:0.05%磷酸-甲醇(65:35);检测波长:230nm;流速:1.2mL/min;进样体积:20μL。
系统适用性:取伊格列净适量,用流动相溶解并定量稀释制成每1mL 中约含伊格列净(C21H21FO5S)50μg 的溶液,在拟定色谱条件下,精密量取20μL 注入液相色谱仪,记录色谱图色谱柱的理论塔板数大于2000,拖尾因子小于2.0。
具体试验操作:取伊格列净20 片,精密称定,研细,精密称取适量(约相当于伊格列净25mg),置50mL 量瓶中,加流动相适量,超声10min 使伊格列净L-脯氨酸溶解,放冷,用流动相稀释至刻度,摇匀,离心,取上清液滤过,精密量取续滤液5mL,置50mL 量瓶中,用流动相稀释至刻度,摇匀,作为供试溶液,精密量取20μL注入液相色谱仪,记录色谱图;另取伊格列净L-脯氨酸对照品,精密称定,加流动相溶解并释制成每1mL 中约含伊格列净(C21H21FO5S)50μg的溶液,同法测定。按外标法以峰面积计算,并将结果乘以0.7784,即得。
试验结果判定:含伊格列净(C21H21FO5S)应为标示量的90.0%~110.0%。
2.2 辅料干扰试验
考察在此色谱条件下空白辅料对检测的影响。按处方量分别称取空白辅料及伊格列净L-脯氨酸适量,用流动相制成空白辅料溶液、原料溶液及原辅料混合溶液,精密量取20μL,注入液相色谱仪,记录色谱图。测定结果见表1。结果表明,空白辅料不干扰检测。
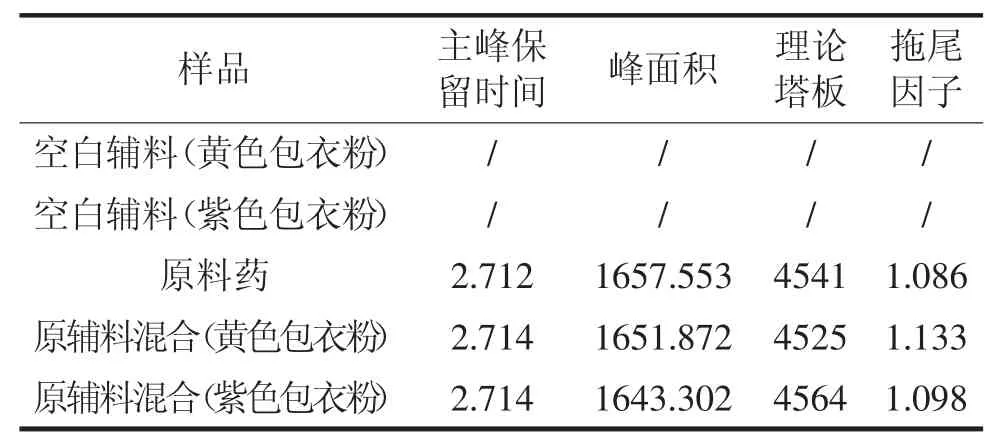
表1 辅料干扰试验结果
2.3 专属性试验
取伊格列净L-脯氨酸样品及伊格列净中可能存在的杂质IMP01、IMP02、IMP03、IMP04、IMP05、IMP06、IMP07、IMP08 适量,用甲醇溶解并用流动相定量稀释制成每1mL 中约50μg 的溶液分别量取20μL,注入色谱仪,记录色谱图;并将伊格列净L-脯氨酸溶液与各杂质溶液混合进样,记录色谱图。结果见表2 和图1。
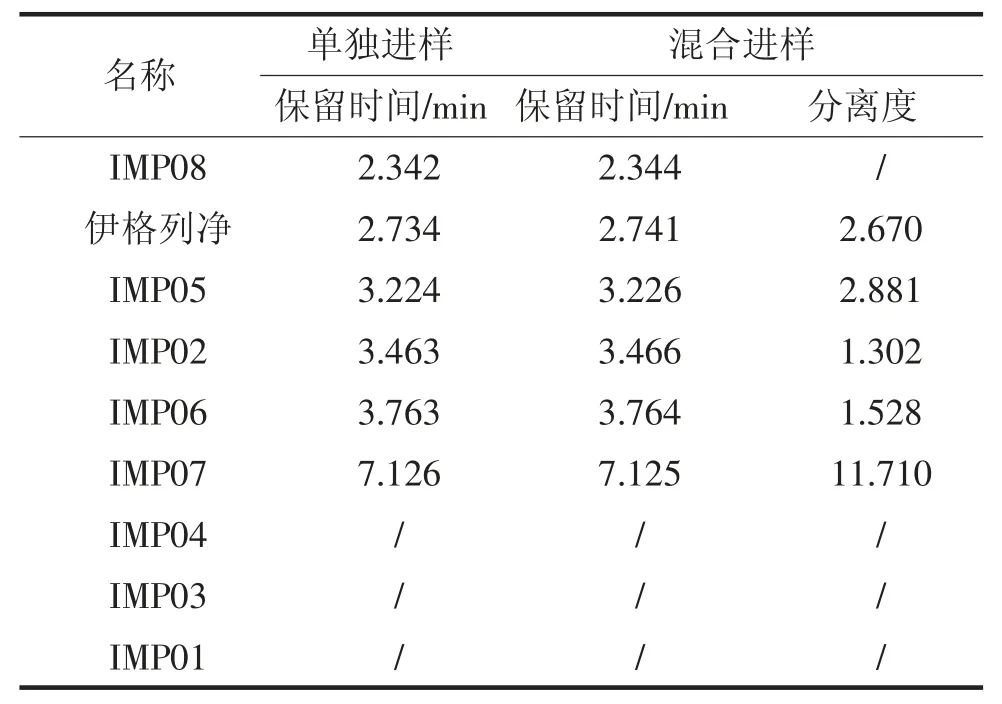
表2 专属性试验结果
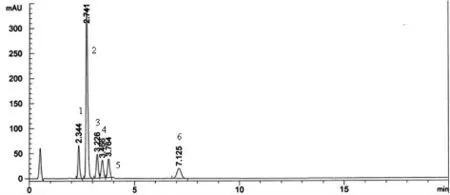
图1 伊格列净L-脯氨酸专属性结果
结果表明:在拟定色谱条件下,伊格列净L-脯氨酸主峰与杂质分离良好。杂质IMP01、IMP03、IMP04 极性与伊格列净L-脯氨酸差异较大,在该条件不能洗脱出来,并不干扰伊格列净L-脯氨酸测定。
2.4 进样精密度试验
取伊格列净L-脯氨酸对照品溶液,按照拟定色谱条件,连续进样6 次,记录色谱图。计算结果得到连续6 次进样伊格列净L-脯氨酸峰面积的RSD 为0.2%,表明进样精密度良好。
2.5 溶液稳定性试验
取伊格列净L-脯氨酸对照品溶液,按照拟定色谱条件,在0h、1h、2h、4h、6h、8h、12h、24h进样,记录色谱图。计算结果得到0~24h 内伊格列净L-脯氨酸峰面积的RSD 为0.1%,表明伊格列净L-脯氨酸对照品溶液在24h 内稳定性良好。
取伊格列净L-脯氨酸片剂样品适量,用流动相溶解并定量稀释制成每1mL 约含伊格列净 (C21H21FO5S)50μg 的溶液。按照拟定色谱条件,在0h、1h、2h、4h、6h、8h、12h、24h 进样。计算结果得到0~24h 内伊格列净L-脯氨酸峰面积的RSD 为0.2%,表明伊格列净L-脯氨酸片剂样品溶液在24h 内稳定性良好。
2.6 线性试验
取伊格列净L-脯氨酸对照品适量,用流动相溶解并定量稀释制成每1mL 约含伊格列净(C21H21FO5S)10~100μg 的系列标准溶液。按照色谱条件,分别精密量取20μL,注入液相色谱仪,记录色谱图,以浓度C(μg/mL)为横坐标,峰面积A 为纵坐标,进行线性回归,并计算回归方程和相关系数。结果见表3 和图2。结果表明伊格列净在10.06~100.56μg/mL 范围峰面积与浓度呈良好的线性关系。
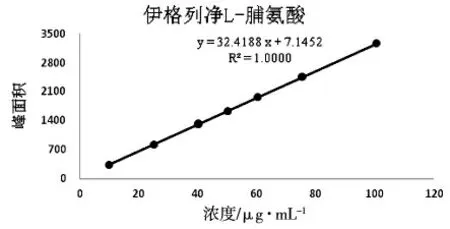
图2 伊格列净L-脯氨酸标准曲线
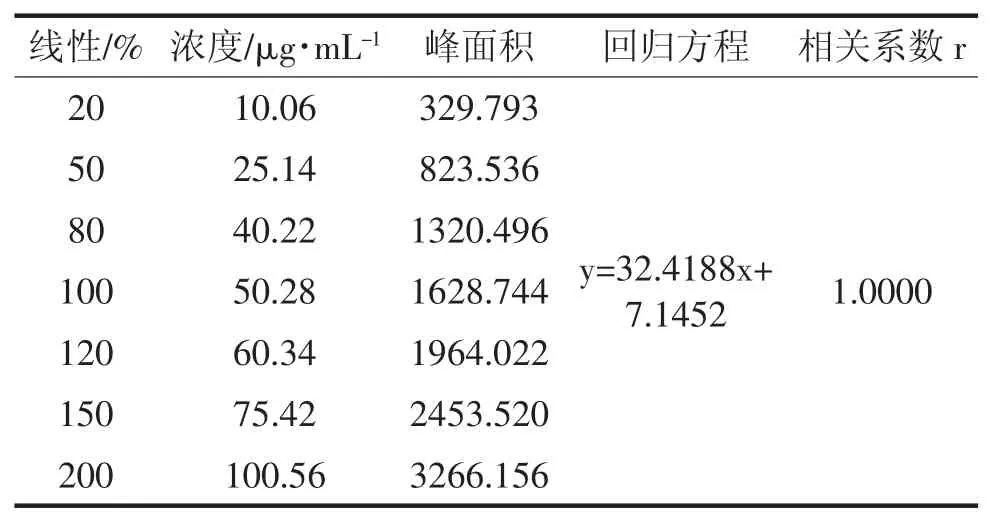
表3 线性试验结果
2.7 准确度试验
精密称取伊格列净L-脯氨酸对照品适量,约含伊格列净(C21H21FO5S) 分别为40mg,50mg,60mg 置100mL 量瓶中,再分别加入空白辅料307mg,加流动相适量,超声10 min 使伊格列净溶解并稀释至刻度,摇匀,滤过,精密移取续滤液5mL 置50mL 容量瓶中,用流动相稀释至刻度,摇匀,作为供试溶液(每个质量分数配置3 份样品)。另取伊格列净L-脯氨酸对照品适量,定量制成每1mL 中约含伊格列净 (C21H21FO5S)50μg的溶液作为对照溶液。照含量测定项下的方法操作,记录色谱图,计算测得量,根据测得量和加入量计算回收率。结果表明伊格列净L-脯氨酸的总平均回收率为99.9%,RSD 为0.3%。数据见表4。
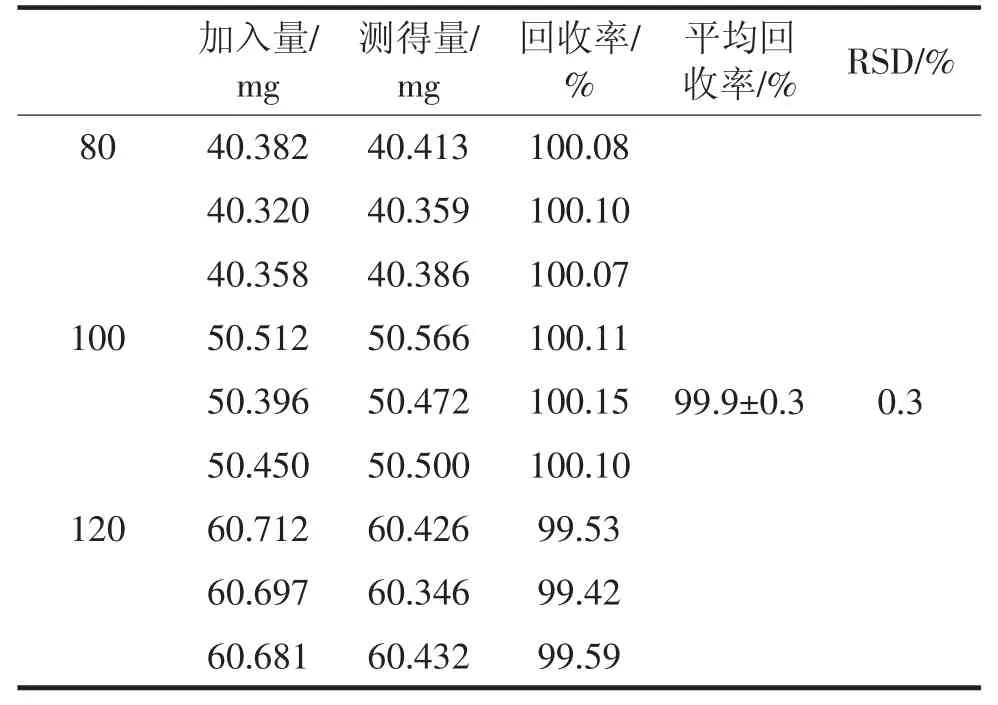
表4 准确度试验结果(n=9)
2.8 耐用性试验
取伊格列净L-脯氨酸工作对照品适量,用流动相溶解并定量稀释制成每1mL 约含伊格列净 (C21H21FO5S)50μg 的溶液,作为对照品溶液;另取伊格列净L-脯氨酸样品适量,用流动相溶解并定量稀释制成每1mL 约含伊格列净(C21H21FO5S)50μg 的溶液,作为供试品溶液。在拟定色谱条件基础上,分别考察柱温±5°C,流动相比例±5%,流速±0.2mL/min,选用不同色谱柱对检测的影响。结果表明,各条件下伊格列净的精密度均符合要求,RSD ≤5%。
2.9 样品测定
取三批伊格列净片,按照“2.1”项下配制供试品溶液,按照拟定色谱条件进样分析,记录色谱图,测定伊格列净量。结果表明:三批供试品伊格列净含量均为标示量的90.0%~110.0%。
3 讨论
3.1 色谱柱的选择
根据伊格列净L-脯氨酸的理化性质,经优化后筛选出专属性佳,精密度及准确度均符合规定且简便快捷的等度条件,作为含量检测方法。
有机相的比例对分离度影响较大,为了保证检测条件的适用性,且为了保证药品的质量及使用安全,最终采用流动相为0.05%磷酸-甲醇(65∶35) 方法本品进行含量的检查。对比了Waters Symmetry Shield RP18 柱与Waters Symmetry C18 柱两根50mm 短柱,两种色谱柱均适合,主峰拖尾因子都在1.2 左右,就理论板数比较,Waters Symmetry Shield RP18 柱略优。选择以十八烷基硅烷键合硅胶为填充剂的色谱柱,以0.05%磷酸-甲醇(65∶35)为流动相,能有效的检测本品含量。
3.2 超声时间的选择
取伊格列净片,精密称定,研细,精密称取适量(约相当于伊格列净25mg),置50mL 量瓶中,加流动相适量,分别超声1min、2min、5min、10min、15min 后,放冷,用流动相稀释至刻度,摇匀,离心,取上清液滤过,精密量取续滤液5mL置50mL 量瓶中,用流动相稀释至刻度,摇匀,作为供试溶液。精密量取20μL 注入液相色谱仪,记录色谱图;另取伊格列净L-脯氨酸对照品,精密称定,用流动相溶解并定量稀释制成每1mL 中约含伊格列净(C21H21FO5S)50μg 的溶液,同法测定。按外标法以峰面积计算,即得。结果见表5。

表5 超声时间对含量测定的影响
结论:超声2~5min 样品即可提取完全。为了确保每次提取完全,因此,我们选择超声10min 做为溶剂提取时间。
3.3 滤膜的选择
样品溶液:取伊格列净片,精密称定,研细,精密称取适量(约相当于伊格列净25mg),置50mL 量瓶中,加流动相适量,超声10min 后,冷却至室温,用流动相定容至刻度摇匀。
离心:取上述样品溶液离心后取上层溶液。
取上述样品溶液分别用美国PALL 的有机滤膜过滤,弃去初滤液1mL、3mL、5mL,取续滤液,作为样品PALL-弃1mL、PALL-弃3mL、PALL-弃5mL。
取上述样品溶液分别用江苏酷拓的有机滤膜过滤,弃去初滤液1mL、3mL、5mL,取续滤液,作为样品酷拓-弃1mL、酷拓-弃3mL、酷拓-弃5mL。
取上述样品溶液分别用TITAN 的有机滤膜过滤,弃去初滤液1mL、3mL、5mL,取续滤液,作为样品TITAN-弃1mL、TITAN-弃3mL、TITAN-弃5mL。
精密量取空白溶液、系统适用性溶液、离心样品溶液及各个过滤样品溶液各20 μL,分别注入液相色谱仪,记录色谱图;考察滤膜对伊格列净的吸附情况。结果见表6。

表6 滤膜吸附试验结果
结论:由表6 可知美国PALL 有机滤膜、江苏酷拓有机滤膜、TITAN 有机滤膜对伊格列净的吸附量均在2%以内,因此认定以上三种滤膜对伊格列净无吸附。

