睾丸平滑肌瘤一例
汪 剑 阳青松 景国东
临床资料
1.一般资料
患者男性,35岁,已婚,于1年前无意中发现右侧睾丸结节,无疼痛、坠胀等不适,近来自觉结节增大。体格检查:右侧睾丸下极可触及一2.5 cm×1.5 cm结节,质地较硬,表面光滑,无压痛,透光试验阴性。实验室检查:血清甲胎蛋白(AFP)<2.8 ng/ml,β‑绒毛膜促性腺激素(β‑HCG)0.1 IU/L,均在正常范围内。
2.影像检查方法
采用3.0 T磁共振设备(Discovery MR750,GE,USA),32通道体表线圈,常规扫描定位像后,行横断位四相位T1WI[三维梯度回波LAVA‑Flex序列,重复时间(TR)3.9 ms,正/反/脂/抑脂相回波时间(TE)分别为2.2 ms/1.1 ms/1.7 ms/1.7 ms,层厚4 mm,矩阵256×224]、横断位脂肪抑制T2WI(二维fs‑PROPELLER序列,TR 8 762.1 ms,TE 93.6 ms,层厚5 mm,矩阵352×352)、横断位DWI(SE‑EPI序列,b=0、1 000 s/mm2,TR 3 053 ms,TE 81.3 ms,层厚5 mm,矩阵128×128)、冠状位脂肪抑制T2WI(二维fs‑PROPELLER序列,TR 5 632.8 ms,TE 93.7 ms,层厚5 mm,矩阵328×328)扫描。随后以高压注射器经肘部静脉注射钆喷酸葡胺(0.5 mmol/mL,北陆药业股份有限公司,北京)15 mL并以生理盐水20 mL冲洗注射器导管,流率均为2 mL/s。注射完成后1 min,行横断位(脂肪抑制T1WI,三维梯度回波LAVA‑Flex序列,TR 3.9 ms,TE 1.7 ms,层厚4 mm,矩阵256×224)和冠状位(脂肪抑制T1WI,三维梯度回波LAVA‑Flex序列,TR 3.9 ms,TE 1.7 ms,层厚4 mm,矩阵320×224)增强扫描。
3.磁共振影像表现(图1~4)
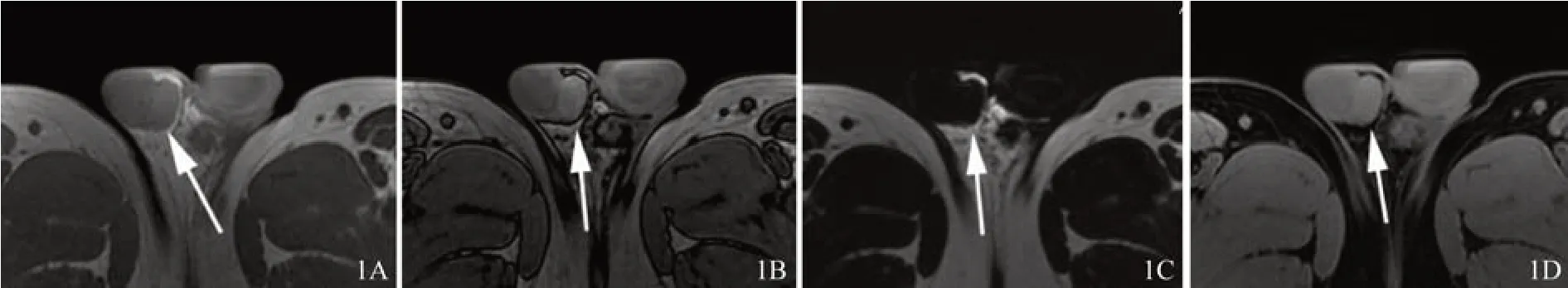
图1 四相位T1WI
病灶位于右侧睾丸内缘,椭圆形,长径约2 cm,边缘光滑,与睾丸界限清晰。病灶内部质地均匀,未显示明显包膜。T1WI信号略高于睾丸和骨骼肌;脂相T1WI显示病灶不含脂质成分;T2WI信号与骨骼肌相似,低于睾丸;DWI(高b值)信号低于睾丸,约等于骨骼肌,显示弥散不受限;增强后,病灶信号稍高于骨骼肌,显示轻度均匀强化。

图2 横断位(A)与冠状位(B)T2WI
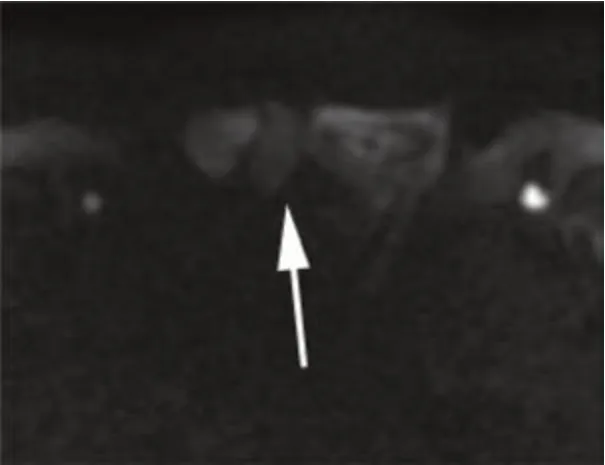
图3 高b值DWI(病灶弥散基本不受限)
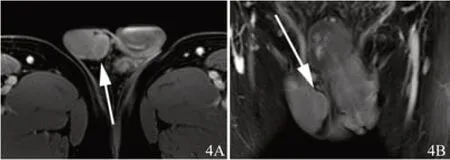
图4 横断位(A)与冠状位(B)增强MRI(病灶轻度均匀强化)
4.手术及病理
逐层切开阴囊、肉膜、睾丸鞘膜,将睾丸挤出阴囊,可见病灶为外生型肿瘤,位于附睾与睾丸交界处,大小约2 cm×1 cm,质地硬。完整剜除肿瘤,其表面光滑,切面呈灰粉色。镜下见形态单一的梭形细胞呈束状编织状排列,核分裂象罕见,诊断为平滑肌瘤(图5)。

图5 病理图片(H‑E染色)
讨 论
大多数睾丸实性肿瘤为恶性,以精原细胞瘤为主,非精原细胞性恶性肿瘤包括胚胎癌、畸胎癌、绒毛膜上皮癌、卵黄囊瘤、平滑肌肉瘤、淋巴瘤等。睾丸良性实性占位性病变非常少见,包括平滑肌瘤、表皮样囊肿、纤维瘤、结节病、结核和血肿等[1-2]。睾丸肿瘤临床症状和体征缺乏特异性。AFP、β‑HCG是非精原生殖细胞瘤最重要的标志物。所有卵黄囊瘤或含有卵黄囊成分者AFP均增高,而部分胚胎癌和不成熟畸胎瘤AFP亦增高;若β‑HCG增高,提示肿瘤中有合体滋养叶细胞成分,明显增高者应疑为绒毛膜上皮癌。本例患者AFP和β‑HCG均正常。
平滑肌瘤是来源于平滑肌细胞的良性肿瘤,理论上在任何含有平滑肌细胞的器官组织均可发生。平滑肌瘤在男性泌尿生殖系统中多见于肾盂,也可见于膀胱、精索,在睾丸中则非常罕见。目前,国内外文献对其均以个案报道为主,睾丸白膜、附睾和睾丸体均可发生,临床表现多为无痛性肿块,质地较硬,通常在无意中触摸发现,生长缓慢[3-7]。
MRI因其多参数成像的特点,尤其适于软组织病灶的诊断与鉴别诊断。本病例使用高场MRI设备,采用三维梯度回波LAVA‑Flex序列,一次扫描即可获得同一位置的正/反相位T1WI、脂肪/脂肪抑制T1WI,同时结合T2WI和DWI信号特点,可以分析病灶内脂肪、出血、肉芽肿及纤维化等各种组成成分信息。通过增强扫描的表现,可以分析病灶的血供情况。在本病例中,影像诊断医师综合分析判断MRI特征,结合临床资料综合分析,得出病灶为良性肿瘤的结论,指导手术医生采取了病灶剜除的治疗方式,避免了盲目扩大治疗范围对患者造成的伤害。
总之,虽然睾丸肿瘤的临床症状和体征缺乏特异性且诊断睾丸平滑肌瘤依赖于组织病理学,但是通过磁共振多参数成像的影像学特征,有利于将其从众多睾丸恶性肿瘤中定性区分,从而选择合适的治疗方案,避免过度医疗的损害。

