活性炭对海水养殖废水处理中动态膜污染的控制过程与作用机制研究*
李博涵, 李岿然, 戎慧敏, 相壮壮, 白 洁 ,3, 赵阳国,3**
(1.中国海洋大学环境科学与工程学院, 山东 青岛 266100; 2. 中国海洋大学海洋生命学院, 山东 青岛 266003;3.中国海洋大学海洋环境与生态教育部重点实验室, 山东 青岛 266100)
随着海水养殖业的快速发展,海水养殖废水直接排放量显著增加,导致近岸水体污染加重,生态系统失衡。由于海水养殖废水的高盐度、低碳氮比等特征,使之难以处理,亟需开发稳定高效的处理工艺[1]。动态生物膜反应器(Dynamic Membrane Bioreactor,DMBR)具有对悬浮颗粒物和氨氮、硝态氮等污染物进行高效截留的优点,在废水处理领域受到普遍关注[2],在海水养殖废水处理中具有一定优势,但膜污染仍是系统运行过程中普遍存在的问题。
有研究将某些颗粒物质,如活性炭,投入动态膜生物膜反应器中,借助其特有的强吸附性和大比表面积等特性来延缓膜污染进程[3],取得了很好的效果。Tsai等[4]通过向生物膜反应器中投加粉末活性炭(PAC),发现PAC对膜污染的控制具有一定作用。Guo 等[5]通过向膜生物反应器(MBR)中投加PAC研究其对膜过滤效率的影响,发现PAC可减小膜过滤压力,提高膜通量。同时,有研究发现,膜污染与微生物群落组成有关[6],高大文和辛晓东[7]研究了MBR膜污染过程中微生物群落的变化,发现微生物群落中变形杆菌和拟杆菌等菌群的丰度增加使得膜污染情况加剧。但是,目前尚缺少对海水养殖废水处理中动态膜污染控制以及动态膜污染与微生物群落变化之间关系的研究。
本研究采用厌氧/好氧-移动床-动态膜组合生物膜反应器(A/O-MB-DMBR)对模拟海水养殖废水进行处理,并通过投加粉末活性炭来探究颗粒物对反应器膜污染的延缓作用以及微生物群落组成与膜污染的关系,研究结果可为生物膜反应器处理海水养殖废水中膜污染控制提供理论依据和技术支撑。
1 材料与方法
1.1 反应器启动与运行
采用A/O-MB-DMBR组合工艺,装置由有机玻璃构成,有效体积为10 L。利用玻璃隔板将反应装置分为缺氧区、好氧区和沉淀区三个区域,动态膜组件以浸没式置于沉淀区。动态膜组件材料为100目0.08 mm孔径的不锈钢丝网,外部用中空塑料板固定,内部以K3圆柱形材料填充[8]。动态膜组件外部尺寸为10.4 cm×2 cm×12 cm,单侧膜面积为66.6 cm2,双侧有效过滤膜面积为133.2 cm2。动态膜装置运行时,利用曝气管于膜组件底部进行曝气,使动态膜表面的污泥混合液呈现错流并均匀运动的状态。利用在不锈钢丝网表面形成的动态膜对污泥混合液进行过滤截留,滤过液进入内部空腔,经出水管由泵抽出。
本试验采用人工模拟海水养殖废水,成分如下:NH4CL为18 mg·L-1、NaNO2为3 mg·L-1、NaNO3为30 mg·L-1、KH2PO4为15 mg·L-1、CH3COONa为210 mg·L-1、Na2CO3为130 mg·L-1。模拟养殖废水各指标浓度如表1所示[9]。

表1 模拟海水养殖废水各指标浓度Table 1 Concentration of simulated mariculture wastewater /mg·L-1
反应器启动时的种泥取自青岛团岛污水处理厂二沉池。将活性污泥与模拟海水养殖废水以1∶3的体积比加入反应器中,采用先间歇进水,并逐步提高盐度,达到最高后改为连续进水的方法进行驯化。污泥经驯化后投入使用,保持反应器内MLSS为2 g·L-1左右。HRT 为8 h,系统运行温度维持在25 ℃。盐度采用海水晶(青岛研瑞新材料有限公司)进行调节,启动完成后使其维持在30。
试验分为两个阶段,第一阶段利用静态吸附试验确定100目膜基材下PAC最适投加量:自反应器底部分别取驯化后污泥170 mL置于5个锥形瓶中,加入80 mL模拟海水养殖废水;加入PAC,使其浓度分别为600、800、1 000、1 200和1 400 mg·L-1,放入水浴恒温振荡器中在25 ℃下震荡2 h,静置30 min后取上清液,测定在不同PAC投加量下COD、氨氮、亚硝态氮和硝态氮的去除率以及EPS、Zeta电位和悬浮物粒径,以确定PAC最适投加量。第二阶段为海水养殖废水处理中的动态膜污染及控制过程研究,试验周期为48 d。0~16 d未向DMBR反应器中投加PAC,17~48 d向DMBR反应器中投加PAC,使其含量达到1 200 mg·L-1。
1.2 样品采集与测定
样品采集与预处理:实验期间每两天定时取实验组样品1次,测定悬浮物粒径和动态膜通量,研究PAC对动态膜组件膜污染的延缓作用;每天定时取污泥混合液样品,采用热提法提取污泥混合液中的EPS;试验结束时采集生物膜表面微生物样品,采用美国Mo-Bio公司的DNA提取试剂盒提取DNA并置于-20 ℃冷冻保存,进行高通量测序,分析其微生物群落结构的变化。
样品测定:COD采用重铬酸钾法,氨氮采用纳氏试剂分光光度法,亚硝态氮采用N-(萘)-乙二胺分光光度法,硝态氮采用紫外分光光度法[10],污泥浓度采用重量法,悬浮物粒径测定采用马尔文激光粒度仪(Zetasizer Nano ZS 90),EPS采用苯酚硫酸法[11]检测胞外多糖(PS);胞外蛋白质(PN)采用Folin酚试剂比色法[12],微生物群落结构样品提取的DNA送至诺和致源(天津)进行高通量测序。
2 实验结果
2.1 活性炭最适投加量
本研究所投加活性炭平均粒径为74 μm,在静态吸附试验中,不同PAC投加浓度下COD、氨氮、亚硝态氮和硝态氮去除率的变化情况如图1。COD的去除率随PAC投加浓度呈现先升高后降低的趋势,在PAC 使用量为1 200 mg·L-1处去除率达到最大。氨氮的去除率在PAC浓度600~1 200 mg·L-1内变化不大,高于1 200 mg·L-1时显著降低。亚硝氮去除率在PAC添加浓度为1 000 mg·L-1时去除率最高达到91.37%。综合比较废水中各污染物的去除效果,初步确定1 200 mg·L-1为活性炭最适投加浓度。
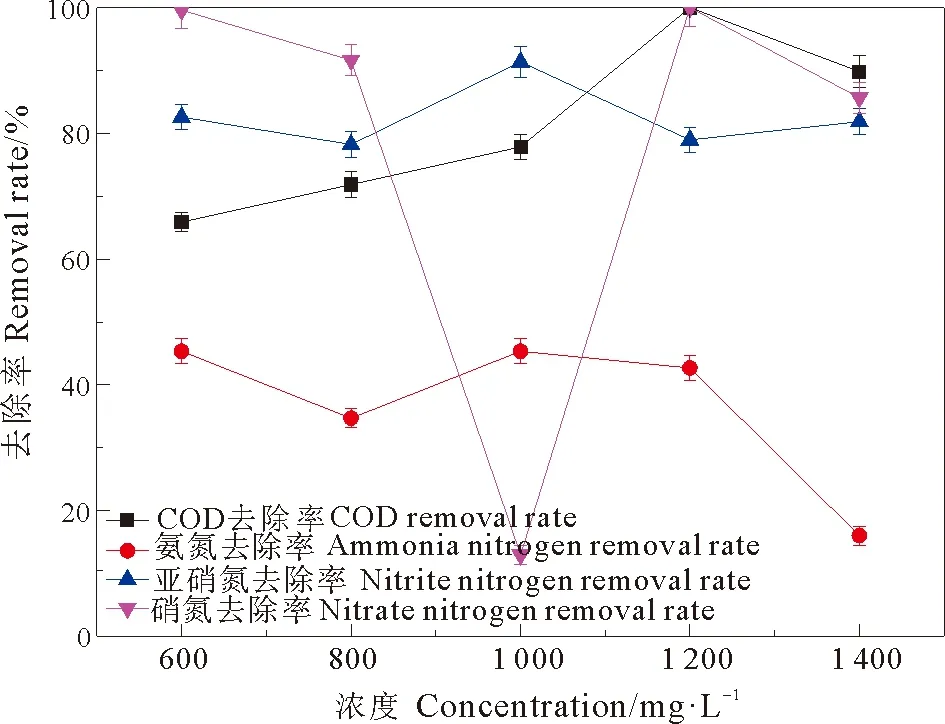
图1 2 h静态吸附实试验中PAC添加浓度对COD、氨氮、亚硝氮和硝态氮去除率的影响Fig. 1 Effects of PAC at different concentrations on removal rates of COD, ammonia, nitrous oxide and nitrous oxide in 2 h static adsorption test
有研究表明,EPS对膜污染具有显著影响,是造成膜污染的主要物质[13]。Zeta电位能够客观反映活性污泥性质的变化趋势,是胶体分散系稳定性的重要指标[14]。Zeta电位降低,表明活性污泥所带的负电荷增加,膜过滤阻力上升,膜污染加重。悬浮物粒径是影响膜污染的重要因素,悬浮物粒径越小,越易堵塞膜孔[15]。试验投加PAC粒径远大于污泥粒径,可使平均悬浮物粒径增大,膜污染程度减轻。
本研究EPS、Zeta电位和悬浮物粒径随活性炭添加浓度的变化如图2。EPS含量随着PAC的浓度增加呈现先减小后增大趋势。当PAC的添加浓度从600 mg·L-1增加至1 200 mg·L-1时,EPS含量从165 mg·g-1降至46 mg·g-1,降低了72.12%。超过1 200 mg·L-1后,EPS含量略有上升。PAC投加浓度对Zeta电位与悬浮物粒径大小的影响呈现相似的趋势。在PAC添加600 mg·L-1的浓度下Zeta电位和悬浮物粒径达到最大,分别为-9.5 mV以及615.35 nm。当添加浓度增加到80 mg·L-1时Zeta电位和悬浮物粒径急剧降低,然后随着浓度的增加呈现先上升后下降的趋势,在1 400 mg·L-1时悬浮物粒径降至最低,Zeta电位降至-11.08 mV。分析认为600 mg·L-1添加浓度下EPS的含量较高,不适合作为投加浓度;800和1 400 mg·L-1添加浓度下,Zeta电位和悬浮物粒径较低,不适合作为投加浓度;综合以上指标,当投加率为1 200 mg·L-1时,膜污染指标以及氨氮等污染物去除率最优,所以本试验选用1 200 mg·L-1作为PAC的最适投加量。
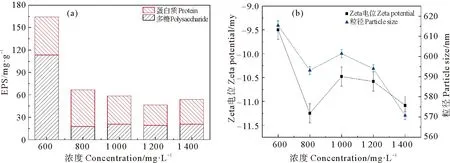
图2 2 h静态吸附试验中PAC浓度对EPS(a)和Zeta电位、悬浮物粒径(b)的影响Fig.2 Effects of PAC on EPS(a)and Zeta potential,particle size(b)in 2 h static adsorption test
2.2 活性炭对生物膜中EPS的影响
EPS主要由多糖和蛋白质组成,本研究采用多糖和蛋白质来表征EPS的含量,结果如图3(a)所示。
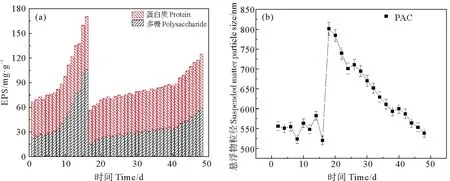
图3 DMBR系统中EPS(a)和悬浮物粒径(b)随运行时间的变化情况Fig. 3 Variation of EPS(a)and diameter of suspended solids(b)with running time in DMBR system
由图3(a)可看出,在反应器的两个阶段中EPS含量均呈现前期缓慢上升,后期迅速上升的规律。未投加PAC阶段,DMBR反应器中EPS含量在初始8 d内上升缓慢,第8天开始呈现迅速上升状态,EPS最大含量可达170.37 mg·g-1,最快增长速率为16.44%。在投加PAC阶段,DMBR反应器运行周期明显延长,至PAC投加32 d后EPS含量比未投加阶段运行末期降低了26.7%,为124.87 mg·g-1。
2.3 活性炭投加对悬浮物粒径的影响
本研究在检测悬浮物粒径前,将污泥混合液取出后静置半小时再上机进行测定,结果如图3(b)所示。在反应器未投加PAC阶段,污泥混合液中悬浮物粒径较小,在550 nm上下波动。投加PAC后悬浮物粒径急剧增长到800 nm左右,随后呈现逐渐下降趋势,至投加32 d后降至550 nm左右。PAC对小颗粒污泥具有吸附能力,可以吸附小粒径污泥形成较大粒径的菌胶团,从而实现减少小粒径悬浮物,延缓膜污染的作用。
2.4 活性炭投加对膜通量的影响
本研究活性炭投加对膜通量的影响结果如图4所示。
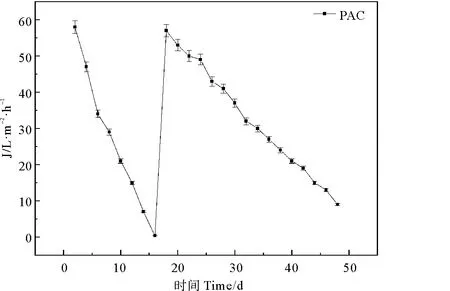
图4 动态膜试验阶段反应器中动态膜膜通量的变化情况Fig. 4 Dynamic membrane flux changes in the reactor during the dynamic membrane test phase
在两个阶段中,动态膜膜通量呈现下降的趋势。未投加PAC阶段,动态膜在16 d的运行周期内,由58 L·(m2·h)-1降低至0.4 L·(m2·h)-1,动态膜运行周期短,膜通量降低速率快。投加PAC阶段,动态膜运行周期明显延长,且动态膜降低速率显著减小。PAC投加第32天后,动态膜通量为9 L·(m2·h)-1,膜污染情况明显得到控制。
2.5 活性炭投加对动态膜微生物群落结构的影响
本研究在反应器运行48 d后,提取活性炭添加组和未添加组的动态膜表面微生物进行高通量测序,动态膜细菌的Alpha多样性变化结果如表2所示。
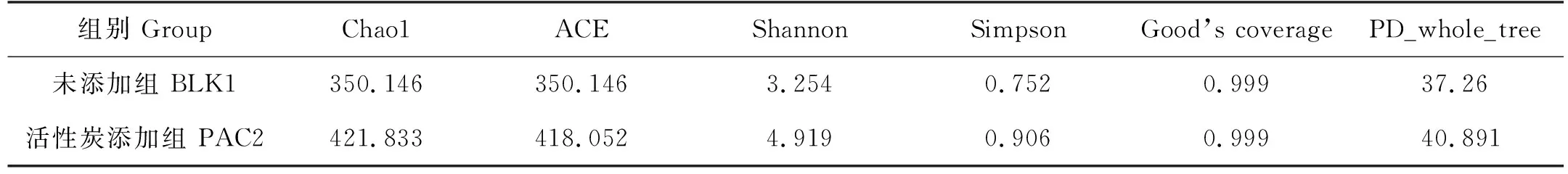
表2 PAC投加后动态膜细菌的Alpha多样性变化Table 2 Alpha diversity index of dynamic membrane samples with PAC addition
Alpha多样性是表征微生物群落结构丰度和多样性的重要指标。由表2可知,添加PAC组(PAC2)的样品中Chao1值和ACE值明显高于未添加的空白组(BLK1),研究表明Chao1和ACE值与群落的丰富度呈正相关[16],说明添加PAC对细菌物种丰富度的提升具有一定的促进作用。PAC添加组样品中的PD_whole_tree值为40.891,高于未添加组的37.26。而PD_whole_tree值可表征系统发育性,且与微生物群落中物种的亲缘关系成正比[16],因此可知PAC添加组样品中物种亲缘关系也同丰富度一样较未添加组复杂。此外对Shannon和Simpson值进行分析可知,PAC添加组样品中Shannon和Simpson值明显高于未添加组。而Shannon和Simpson值与菌群的多样性成正相关,说明PAC添加组菌群多样性高。两组样品的Good’s Coverage值均为0.999,Good’s Coverage值代表测序深度,其值越接近1,则表明对样品中的所有物种数覆盖率越大,说明本试验中测序深度几乎完全覆盖所包含的所有物种。
2.5.1 门水平微生物群落结构的变化 根据高通量测序,选取门水平上占比前十的门类进行分析,结果如图5所示。
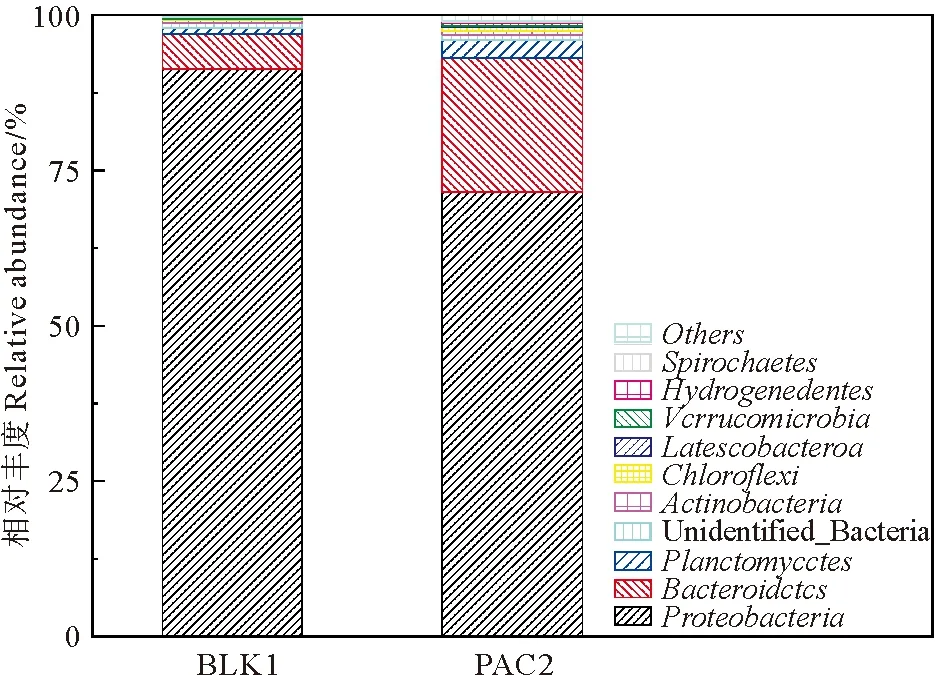
图5 动态膜微生物群落结构在门水平的变化Fig.5 Changes of microbial community structure in dynamic membrane at gate level
按照丰富度排列主要存在变形菌门 (Proteobacteria) 、拟杆菌门(Bacteroidetes) 、浮霉菌门( Planctomycetes) 、不确定菌门等,并以变形菌门、拟杆菌门、浮霉菌门的微生物为主,两组样品中的优势菌群均来自变形菌门。变形菌门在空白组和添加组中的相对丰度分别为91.61%和72.19%,PAC添加组相对降低了19.42%;拟杆菌门在两组中相对丰度分别为5.69%和21.76%,PAC添加组相对增加了16.07%。浮霉菌门在两组样品中相对丰度分别为0.91%和2.91%,相对增加2%。
2.5.2 属水平微生物群落结构的变化 动态膜微生物群落结构从属水平进行分析,结果如图6所示。选取属水平占比前十的属类分析,结果如表3所示。
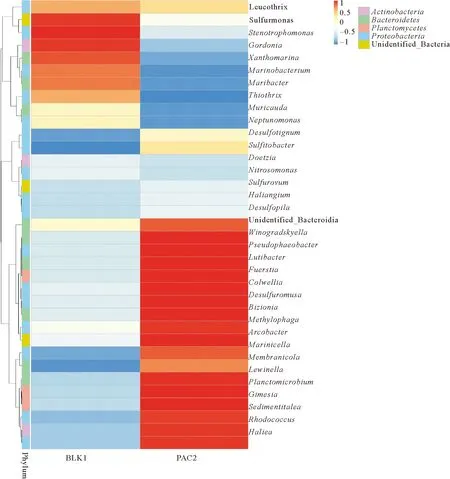
图6 动态膜微生物群落结构在属水平的变化Fig.6 Changes in the structure of dynamic membrane microbial community at the genus level
由图6和表3可知,两组样品中丰度最大且变化最为明显的是变形菌门的发硫菌属(Thiothrix)。在未添加PAC组中该属丰度为58.34%,在添加组中丰度下降至27.36%。而变形菌门中的亮发菌属(Leucothrix)在PAC未添加组和添加组样品中的丰度分别为20.38%、18.59%,丰度略有降低。
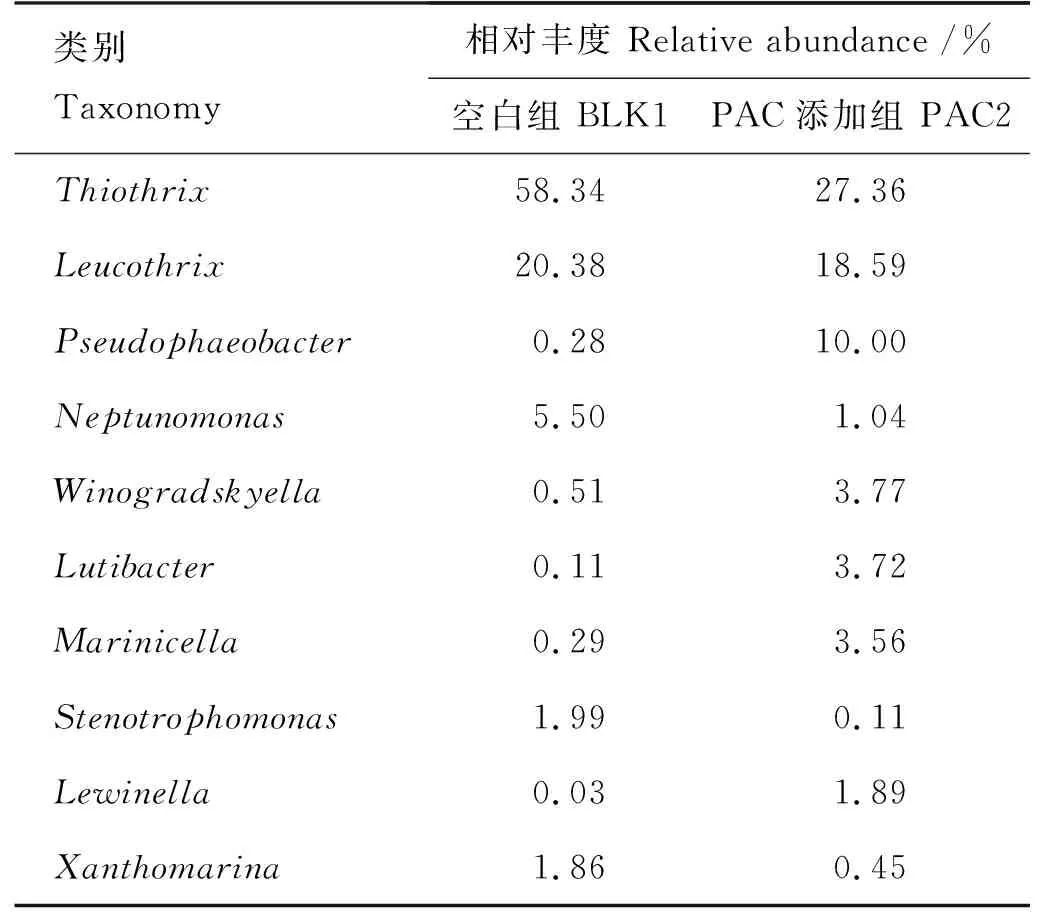
表3 占比前十的属水平种群丰度变化Table 3 Changes in abundance of top ten genus horizontal populations
3 讨论
本研究通过分析反应器混合液中EPS浓度及膜通量的动态变化,以探究PAC投加对膜污染的控制效果。分析认为未投加PAC时,反应器在8 d左右EPS开始迅速上升是导致膜污染及膜压差增大的原因[17]。投加PAC后EPS含量降低,增长速度放缓是由于PAC对EPS具有吸附作用,可降低混合液中EPS含量。此外,PAC吸附微生物,能够增强微生物对EPS的降解能力,也是投加PAC降低EPS含量的原因之一[18]。而混合液中EPS含量的下降以及增长速率的降低,减少了EPS在膜组件表面的沉积,降低了污泥混合液粘度,使膜污染得到较好的控制。膜污染会导致膜孔堵塞,出水膜通量降低,膜过滤阻力增大[19]。投加PAC能减缓膜通量降低,其原因是PAC空隙较大,与污泥絮体相互作用形成的絮体颗粒粒径更大、黏性更小,透水性更强,减缓了动态膜表面泥饼层的形成[20]。
对未投加及投加PAC的动态膜样品中微生物群落结构进行对比分析,发现大多数与氮代谢相关的微生物属于变形菌门,代谢类型多样,在本研究的动态膜反应体系中具有很好的适应生长能力[21]。未添加组中变形菌门相对丰度较大的原因可能是由于动态膜污染,厚度增加,更适于变形菌门的生长繁殖。变形菌表面疏水性较高,易附着于膜表面,引起膜污染,PAC添加组样品中变形菌门的减少显著地延缓了膜污染进程。拟杆菌门适宜在厌氧或缺氧的环境中生存,可将大分子有机物降解且对水解污泥絮体具有重要作用[22],PAC添加组样品中拟杆菌门丰度的增加对废水中有机物的去除起到积极作用。浮霉菌门中包含典型的厌氧氨氧化微生物,可将亚硝酸盐转化为氮气,在反应器脱氮方面起着非常重要的作用[23]。因此,在PAC添加组中拟杆菌门相对丰度的提升是EPS含量降低、膜污染缓解、反应器COD去除率升高的重要原因。而浮霉菌门相对丰度的提升可使反应器的脱氮效率增加,提高污染物处理效能。
从属水平微生物群落结构分析发现,投加PAC后,发硫菌、亮发菌和黄单胞菌属的丰度降低,是膜污染程度减轻的重要因素之一。发硫菌是自氧或异氧菌,主要存在于含硫废水以及MBR等污水处理工艺中,在污水处理反硝化过程中具有重要作用[24]。Wang等[25]指出,发硫菌的存在和过度生长可导致活性污泥发生丝状膨胀,沉降性能变差。Meng等[26]发现在膜过滤过程中,膜上的发硫菌属是导致膜污染的一个重要因素。而变形菌门中的亮发菌属(Leucothrix)具有好氧耐盐且能降解有机物的特性[27]。亮发菌属对有机物的降解代谢可产生较多的蛋白质、多糖等代谢产物,使得EPS含量升高,膜污染加重。黄单胞菌属是专性好氧的革兰氏阴性菌,可产生胞外荚膜多糖-黄原胶,增加EPS含量,加快膜污染进程[28]。
4 结论
(1) 通过静态试验,研究了PAC投加量对污染物去除率、EPS、Zeta电位和悬浮物粒径的影响,确定1 200 mg·L-1为海水养殖废水处理时膜污染控制的PAC最适投加量。
(2) 投加PAC可降低反应器中EPS的含量,最高可达26.7%,且投加PAC可增大悬浮物粒径,减缓膜污染进程。
(3) 投加PAC可提高膜通量,延长反应器运行周期,对动态膜膜污染具有控制作用。
(4) PAC投加对动态膜微生物菌群多样性以及物种丰富度具有促进作用,在门水平上使拟杆菌门和浮霉菌门相对丰度增加;在属水平上使得发硫菌属和亮发菌属相对丰度降低。PAC对膜污染具有显著的控制作用,通过改变微生物群落结构、降低EPS的含量是PAC膜污染控制的重要途径。

