原始生殖细胞的命运决定
沈仕君
对大多数多细胞动物来说,新生命起源于生殖细胞——精子和卵子,它们通过受精作用将遗传信息从上一代传递到下一代,以维持种群的延续。精子和卵子都来自一类特殊的细胞——原始生殖细胞,它们是动物个体在胚胎发育过程中最先产生的生殖细胞群体,也是未来成熟精子或卵子的发源地。原始生殖细胞如果出现问题,将直接影响生殖细胞的发育、后代的健康,甚至种群的延续。所以,研究原始生殖细胞的命运决定尤为重要。
基本发育路线
以小鼠为例,原始生殖细胞的基本发育路线大致可分为4个阶段(特化——迁移——增殖——分化)。
具体来说:在小鼠怀孕后大约7.25天(E7.25),早期胚胎中的一群细胞(约40个)会被诱导形成早期状态的原始生殖细胞(即特化);随着胚胎发育,这些细胞将最终迁移进入生殖嵴中,这里是未来形成生殖器官的地方;一直到小鼠怀孕后大约13.5天(E13.5),原始生殖细胞都在生殖嵴中不断分裂增殖;13.5天以后,原始生殖细胞开始雌雄分化,雌性原始生殖细胞在13.5天后迅速进行减数分裂,并最终停滞在第二次减数分裂时期等待受精(即卵子初步形成),而雄性原始生殖细胞则进入发育停滞阶段,直到出生后才会进行减数分裂,形成成熟的精子[1]。
原始生殖细胞的高通量研究历程
在很长一段时间,有关原始生殖细胞发育过程的研究结果大多来自形态学研究和少量特定基因的探索。随着21世纪基因组测序计划的完成和二代测序技术的兴起,对于原始生殖细胞的观察和研究已不再局限于低通量单个基因的研究,高通量研究开始成为一种新的趋势。
在高通量研究中,科学家们首先选择的突破口是转录组,因为它可以从全局范围上反映所有基因的最终表达情况,直观展示原始生殖细胞的分子生物学特征。目前科学家们已经成功绘制小鼠原始生殖细胞各个阶段的转录组图谱(PRJNA214836),鉴定出原始生殖细胞发育过程中的诸多关键基因,如Blimp1、Prdm14、Tfap2c等,同时揭示了这些基因的动态表达模式,为深入研究原始生殖细胞发育中的基因调控机制奠定了基础。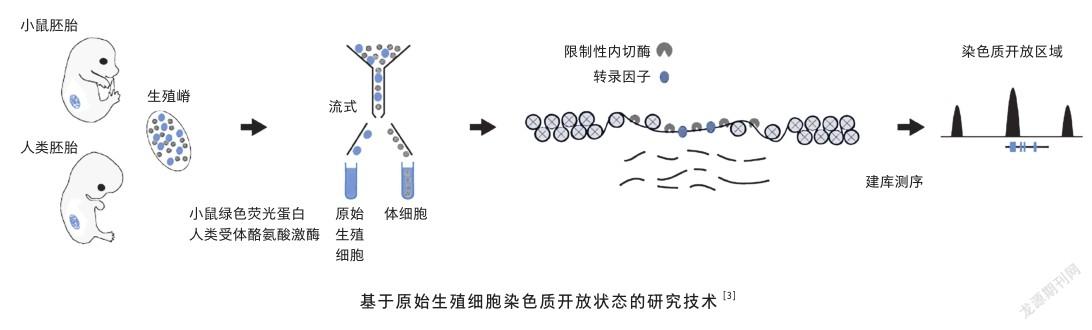
然而,由于转录组图谱是众多基因调控的最终结果,并不能及时反映上游的基因调控情况,所以仅仅依靠转录组来揭示细胞命运是不够精确的。于是,科学家们转而选择从表观基因组的角度对原始生殖细胞的命运进行更精准的研究。其实“表观遗传学”这一名词由来已久,早在20世纪40年代,发育生物学和遗传学家沃丁顿(C. Waddington)就提出了这一概念。形象地说,染色体DNA就像一本庞大的“百科全书”,而表观遗传学则是指导人们如何去阅读这本“书”。
目前,科学家们已成功绘制出小鼠原始生殖细胞中的全基因组DNA甲基化图谱(一种典型的表观遗传学研究方向)[2]。他们发现,在原始生殖细胞发育过程中会经历一次彻底的全基因组范围的DNA甲基化清除过程,全基因组DNA甲基化水平最低时只有4%~5%。而随后在形成精子和卵子的过程中,基因组的DNA甲基化又将重新建立。这种清除亲代表观遗传信息,再为子代建立新的表观遗传信息的过程,对于维持种群的多样性和环境适应性是至关重要的。
染色质开放状态
相较于表观遗传学众多的研究方向来说,目前对于原始生殖细胞的研究进展只局限于DNA甲基化这一方向,而对于原始生殖细胞发育过程中的染色质动态变化和转录调控研究更是鲜有报道。究其原因,主要是由于原始生殖细胞的数量过于稀少,在研究技术上存在瓶颈。早期的原始生殖细胞数量只有几十个,到小鼠怀孕12.5天以后也不过是数万个。而常规的高通量表观遗传学研究手段大多需要百万级别的细胞数量才能获得较好的实验数据。因此,亟需开发基于微量细胞的高通量表观遗传学研究方法,以进一步对原始生殖细胞的命运进行探索。
2018年,有科学家开发了基于微量DNA的限制性内切酶I (DNase I)建库测序(Low-input DNase-seq)技术[3],该方法通过减少反应步骤和容器置换次数,配合建库后切胶再回收策略,在微量细胞(最少可以达几百个)中极大提升了测序效果。利用此项技术,他们首次在小鼠和人的原始生殖细胞中观察到全基因组范围的染色质开放图谱,极大地丰富了原始生殖细胞中的表观遗传研究类型。
科学家们进一步以不同样本中特异的染色质开放位点为依据,成功绘制出原始生殖细胞的发育路径[3]。他们发现虽然原始生殖细胞的发育路径在性别上有着明显的差异,但其发育方向却是趋同的,这体现了生物体发育过程中“和而不同”的特点。同时,科学家们还专门对全局范围的染色质开放图谱与转录组图谱进行了系统的比较,结果发现利用染色质开放状态进行细胞命运预测要比转录组准确得多,这进一步验证了染色质开放状态在研究细胞命运调控上的优势。
除了能宏观地描绘整个发育路径外,染色质开放状态研究还能从微观上揭示关键调控蛋白的潜在DNA结合位点,从而揭示发育过程中的基因调控细节。而为了实现这一目标,科学家们需要找到染色质开放区域富集的基序,即模体,是染色质上出现的独特DNA序列片段,具有较强的特异性,可以被染色质开放探测技术所捕获,是转录调控因子蛋白潜在的结合位点。
全基因组同源重组位点探测
减数分裂与同源重组
对于多细胞生物来说,细胞分裂有两种关键类型:有丝分裂和减数分裂。其中,减数分裂与生殖细胞的产生密切相关。减数分裂的全过程可大致划分为4个阶段:间期Ⅰ、减数分裂Ⅰ、间期Ⅱ和减数分裂Ⅱ。其中减数分裂Ⅰ尤為重要,因为其间会发生一个重要的生物学事件——同源染色体联会,最终会使每对染色体形成一个紧密相伴的二价体,又称四分体。每条染色体的两条染色单体之间称为姐妹染色单体,同源染色体的不同染色单体之间称为非姐妹染色单体。同源染色体联会后,非姐妹染色单体的之间可发生片段互换,即交换,从而使得同源染色体之间的基因产生部分重新组合,即重组。整个过程统称为同源重组,交换染色体的位点就称为同源重组热点[4]。
同源重组过程使生殖细胞在继承父母源基因的同时,又能使子代通过染色体片段交换获得新的性状,从而丰富DNA的多样性。形象地说,这是一次生殖细胞的基因“大洗牌”,后代将拥有更多可能的基因组合。当然,凡事总有两面,虽然从基因组入手丰富性状是非常经济实惠的一种方法,但它也带来了一定的风险。由于同源重组涉及DNA断裂再修复的过程,一旦出现错误极易引起出生缺陷,所以科学家们一直致力于探寻同源重组过程背后的机制。
同源重组过程的分子机制研究
随着对同源重组的深入理解,有关同源重组过程的研究也逐渐进入分子生物学层面。2012年,科学家们发现组蛋白甲基转移酶PRDM9会在需要发生同源重组的位点附近标记特定的组蛋白修饰信号(H3K4me3,组蛋白第三亚基四号赖氨酸的三甲基化),这个信号会引导蛋白机器在这些指定位点进行双链断裂,为同源重组做准备[5]。而如果将PRDM9蛋白敲除,蛋白机器就会选择其他带有H3K4me3标记的位点进行双链断裂。而那些区域往往是启动子等具有重要生物学功能的地方。这样异常的操作不仅不能实现丰富DNA多样性的目的,反而还会造成基因的损坏,是极其危险的。因此,PRDM9蛋白在同源重组中具有不可替代的作用。而科学家们恰好在晚期雌性原始生殖细胞的染色质开放信号中发现了属于PRDM9的特异基序[3],这说明PRDM9蛋白可能在这一时期发挥着调控同源重组的功能。
那么PRDM9蛋白的基序为何特异出现在晚期雌性原始生殖细胞中,而晚期雄性原始生殖细胞中则没有呢?这就涉及雄性和雌性同源重组发生时期的重大差异。以小鼠为例,雄性生殖细胞一般在出生后(大约产后12天)才进行同源重组,而雌性生殖细胞一般在出生前(大约怀孕后14.5天)进行同源重组[1]。所以当雌性生殖细胞发生同源重组时,雄性生殖细胞离同源重组开始还有很长一段时间。
此外,这种时期不同步现象也造成了有关雌性和雄性生殖细胞研究进展的巨大差距。正因为雄性生殖细胞可以在出生后获得,取材相对容易,所以对于雄性生殖细胞的同源重组分析已经拓展到全基因组位点的高通量研究。早在2012年和2016年,科学家们就曾利用同源重组中两个至关重要的蛋白DMC1和SPO11,实现了雄性生殖细胞全基因组同源重组热点的探测[6,7]。而对于雌性生殖细胞而言,由于在其出生前还处于原始生殖细胞阶段,取材困难且细胞数量较少,尚没有很好的关于其同源重组位点的全基因组范围的报道。
基于染色质开放状态的全基因组同源重组位点探测
那么有没有机会在雌性生殖细胞的同源重组研究上再进一步呢?目前已知:①雌性生殖细胞同源重组发生的时期是晚期雌性原始生殖细胞阶段;②晚期雌性原始生殖细胞的染色质开放信号中富集着PRDM9蛋白的基序;③同源重组过程中伴随着DNA双链断裂,而这种裸露的DNA恰好是限制性内切酶I(DNaseI)所青睐的区域。似乎这些证据都在暗示利用染色质开放信号可以在全基因组范围探测雌性生殖细胞的同源重组位点。那么事实是否如此呢?
科学家们通过大量实验计算发现,利用Lowinput DNase-seq技术所得到的DNaseI超敏感位点(DNase I hypersensitive site, DHS,可代表染色质开放程度较高的区域),配合同源重组过程中重要蛋白的已知全基因组坐标,如PRDM9、 DMC1等,可以很好地探测到雌性生殖细胞中全基因组范围内的同源重组位点[3]。同时,科学家们通过小鼠品系特异性证明实验、DNaseI超敏感位点与同源重组热点对应证明实验等,确认了上述探测方法的可靠性和高检出效率。
此外,已知PRDM9蛋白会在同源重组过程中为即将进行双链断裂的基因位点标记组蛋白修饰信号H3K4me3。研究发现,在同源重组之前(E13.5),同源重组热点上几乎没有H3K4me3信号,而只有当发生同源重组的时候(E14.5),同源重组热点上才会迅速建立H3K4me3信号。该结果很好地建立了遗传物质交换和表观遗传调控的相关性,进一步强化了PRDM9蛋白在同源重组过程中的重要性。
对原始生殖细胞的染色质开放状态进行研究,不仅丰富了有关原始生殖细胞的研究类型和实验方法,展现了整体发育过程中的诸多变化,同时也揭示了诸如同源重组等关键生物学事件的机制细节。其中,对于雌性原始生殖细胞全基因组同源重组位点的鉴定尤其具有重要意义,研究人员只需要1只胎鼠即可完成实验,实现了个体水平上的位点检测,而2018年其他研究者利用傳统方法操作时则需要约300只胎鼠才能完成实验[8]。显然,利用染色质开放状态的实验策略更具推广价值,特别是在人雌性原始生殖细胞样本更难获得的情况下。
关于原始生殖细胞还有很多未解之谜,但生命科学技术也同时在高速发展,期待在不久的将来,该领域会涌现更多新的探索成果。
[1]Saitou M, Yamaji M. Primordial germ cells in mice. Cold Spring Harbor perspectives in biology, 2012, 4.
[2]Kobayashi H, Sakurai T, Miura F, et al. High-resolution DNA methylome analysis of primordial germ cells identifies genderspecifi c reprogramming in mice. Genome research, 2013, 23: 616-627.
[3]Li J, Shen S, Chen J, et al. Accurate annotation of accessible chromatin in mouse and human primordial germ cells. Cell Research, 2018.
[4]Baudat F, Imai Y, de Massy B. Meiotic recombination in mammals: localization and regulation. Nature reviews Genetics, 2013, 14: 794-806.
[5]Brick K, Smagulova F, Khil P, et al. Genetic recombination is directed away from functional genomic elements in mice. Nature, 2012, 485: 642-645.
[6]Khil P P, Smagulova F, Brick K M, et al. Sensitive mapping of recombination hotspots using sequencing-based detection of ssDNA. Genome research, 2012, 22: 957-965.
[7]Lange J, Yamada S, Tischfi eld S E, et al. The landscape of mouse meiotic double-strand break formation, processing, and repair. Cell, 2016, 167: 695-708 e616.
[8]Brick K, Thibault-Sennett S, Smagulova F, et al. Extensive sex diff erences at the initiation of genetic recombination. Nature, 2018, 561: 338-342.
关键词:原始生殖细胞 染色质开放状态 同源重组 ■

