白蜡窄吉丁气味结合蛋白AplaOBP2的定位、配体结合特性及配体活性*
宋 玄 王泽华 虞国跃 王 凡,4 单 双 张永军 王山宁
(1.北京市农林科学院植物保护环境保护研究所 北京 100097; 2.中国农业科学院植物保护研究所 植物病虫害生物学国家重点实验室 北京 100193; 3.中国农业大学植物保护学院 北京 100193; 4.新疆生产建设兵团第三师农业科学研究所 图木舒克 843900)
嗅觉在昆虫寻求寄主、配偶、产卵场和躲避天敌等行为中发挥重要功能(Bruceetal., 2005; Takken, 1991; Vetetal., 1992; Visser, 1986 )。触角作为昆虫主要的嗅觉器官,其表面分布多种形态的嗅觉感器。嗅觉感器腔内的嗅觉受体神经元(olfactory receptor neurons, ORNs)树突,能够特异地感受外界的化学信号(Binyameenetal., 2012; Steinbrecht, 1997; Zacharuk, 1980)。气味分子由嗅觉感器壁上的微孔进入感器腔,穿过感器淋巴液,到达ORNs树突,激活树突上的受体蛋白,最终引起昆虫的不同行为反应(Hanssonetal., 2011; Pelosi, 1996; Kriegeretal., 1999; Wilsonetal., 2006)。研究表明多种功能蛋白参与这一过程,其中气味结合蛋白(odorant binding proteins, OBPs)是主要的外周嗅觉蛋白,在昆虫嗅觉系统中发挥重要功能(Leal, 2013; Pelletieretal., 2010; Vogtetal., 1981; Xuetal., 2005; Yeetal., 2017)。
昆虫OBPs是一类小分子量的水溶性蛋白,最早是从鳞翅目昆虫触角中分离鉴定,目前认为OBPs几乎在所有的昆虫中都有表达(Hekmat-Scafeetal., 2002; Pelosietal., 2014; Vieiraetal., 2011; Vogtetal., 1981)。在昆虫触角中,OBP蛋白由位于感器下方的辅助细胞合成,随后被大量分泌到感器腔的淋巴液中(Laueetal., 1994; Steinbrechtetal., 1995; Vogtetal., 1981)。尽管OBPs在嗅觉感知中的特定生理作用尚不完全清楚,但人们普遍认为它们在结合、运输疏水性气味通过水溶性淋巴液到达ORNs树突上的嗅觉受体中起着重要作用(Leal, 2013; Pelosietal., 2014)。随着OBPs在越来越多的昆虫中被鉴定,不同昆虫OBPs的表达分析表明,仅有部分OBP基因特异表达在化学感觉器官,OBP基因在其他非化学感觉器官也有表达,可能参与多种生理功能(Dippeletal., 2014; Forêtetal., 2006; Mckenzieetal., 2014; Pelosietal., 2017; 杨叶青等, 2017)。触角表达的OBPs选择性地表达在不同类型的嗅觉感器中,参与不同化合物的结合运输,但是并不是所有嗅觉感器都需要OBP蛋白参与运输气味分子到嗅觉受体(Huangetal., 2018; Jiangetal., 2018; Larteretal., 2016; Pikielnyetal., 1994; Wangetal., 2018 )
白蜡窄吉丁(Agrilusplanipennis),是近年来发生和危害比较严重的国际性检疫害虫,主要为害木犀科(Oleaceae)白蜡树属(Fraxinus)树木。该虫是东北亚地区的本土昆虫, 2002年传入北美,迄今已造成北美地区数百万白蜡树死亡(Hermsetal., 2014; Morinetal., 2017)。同其他昆虫一样,白蜡窄吉丁成虫通过感受不同类型的信息化合物来寻找配偶以及适宜寄主。近年来,国外研究者对该虫的化学生态学做了大量的研究: 明确了白蜡窄吉丁寄主识别相关的信息化合物主要种类,鉴定了参与雌雄虫交配的性信息素组分,并挖掘了12个OBPs基因和47个气味受体基因(odorant receptors, ORs)等多种可能参与嗅觉识别的基因(Anderssonetal., 2019; Crooketal., 2008a; de Grootetal., 2008; Mamidalaetal., 2013; Rodriguez-Saonaetal., 2006; Silketal., 2009),然而各种嗅觉基因的功能尚未展开研究。本实验室前期对白蜡窄吉丁基因组数据进行分析,鉴定了11个气味结合蛋白(AplaOBP1-11)序列,组织表达谱结果表明3个OBP基因(AplaOBP1-3)在雌雄触角特异表达,其中AplaOBP1可以识别月桂烯、柠檬烯、橙花叔醇等多种寄主挥发物(Wangetal., 2020),推测其他触角特异表达的OBPs在白蜡窄吉丁嗅觉识别中同样发挥重要功能。
因此,本研究重组表达了AplaOBP2蛋白,采用免疫组织化学技术从蛋白水平进一步对AplaOBP2在触角感器中进行定位,通过荧光竞争结合试验研究AplaOBP2重组蛋白的配体结合特性,并通过昆虫电生理和行为学试验研究配体的生物活性,以期为阐明白蜡窄吉丁嗅觉识别机制和通过气味结合蛋白筛选该虫信息化合物提供依据。
1 材料与方法
1.1 试验材料
1.1.1 供试昆虫 分别于2018年和2019年4月中旬,于北京郊区(延庆、平谷、通州和昌平)白蜡树林地,将受害美国红梣(F.pennsylvanica)砍伐(10棵),主干截成约50 cm的木段,带回北京市农林科学院。将木段置于户外背阴处,用100目的尼龙网罩住,待白蜡窄吉丁成虫自然羽化。5月上旬观察到羽化成虫,将成虫转移至养虫盒内,饲喂白蜡树叶片,用于试验。
1.1.2 主要试剂 表达感受态细胞BL21(DE3) 及测定蛋白浓度试剂购自天根生化科技(北京)有限公司; 柱填料购自北京信诺晶科生物技术有限公司; 重组肠激酶Ecombinant Entherokinase 购自安诺伦(北京)生物科技有限公司; 组织蛋白抽提试剂盒、Western Blot Kit和eECL Western Blot试剂盒购自康为世纪生物科技有限公司; 荧光探针N-苯基-1-萘胺(N-phenyl-1-naphthylamine, 1-NPN)和气味标样分别购自美国Sigma 公司、日本东京化成工业株式会社(TCI) 、上海麦克林生化科技有限公司和化学慧; 南京金斯瑞公司提供基因合成和表达载体构建; 北京信诺晶科生物技术有限公司提供抗体制备服务。
1.2 试验方法
1.2.1 AplaOBP2重组表达 白蜡窄吉丁AplaOBP2基因(GenBank登录号: KU342581)序列从白蜡窄吉丁基因组数据中获得。去信号肽后的AplaOBP2基因序列由南京金斯瑞进行合成并克隆到表达载体pET30a(+)。重组质粒测序正确后转化至BL21(DE3)感受态细胞中进行诱导表达。单克隆菌株在含有100 mg·mL-1卡那霉素的培养基中37 ℃培养,待OD600值为0.6~0.8时,向培养基中加入IPTG 至终浓度为1 mmol·L-1,在18 ℃下进行诱导表达16 h。超声破碎后,离心收集包涵体,用于蛋白纯化。包涵体处理步骤如下: 用溶液Ⅰ(50 mmol·L-1Tris, 0.2%Triton X-100, pH6.8) 洗包涵体沉淀,离心后将沉淀溶于10 mL 6 mol·L-1盐酸胍,加入10 mL 溶液Ⅱ(10 mmol·L-1DTT, 200 mmol·L-1Tris, pH8.0),室温100 r·min-1孵育60 min; 加入4 mL 溶液Ⅲ( 0.5 mol·L-1NaOH, 5 mmol·L-1Cystine),室温孵育10 min; 加入10倍体积的溶液Ⅳ(5 mmol·L-1Cysteine, 100 mmol·L-1Tris, pH 8.0),室温100 r·min-1孵育过夜; 离心收集上清并用透析袋在PBS蛋白缓冲液中透析过夜。利用HisTrap亲和层析柱对蛋白进行纯化,纯化蛋白用重组肠激酶30 ℃孵育12 h。再次用HisTrap亲和层析柱纯化,经超滤浓缩后得到无His-tag的AplaOBP2重组蛋白。采用Bradford法对AplaOBP2蛋白浓度进行测定(Bradford, 1976),通过4%~20% SDS-PAGE电泳检测各阶段目的蛋白的表达情况。纯化的无His标签AplaOBP2重组蛋白送北京信诺晶科生物技术有限公司制备多克隆抗体。
1.2.2 Western blot检测 取羽化1~3天的白蜡窄吉丁触角30对,参照组织蛋白抽提试剂盒说明书提取触角粗蛋白。具体操作步骤如下: 将提取试剂置于冰上预冷2~3 min,按照1∶99的比例加入蛋白酶抑制剂,配成1×工作液。向1.5 mL 离心管中加入400 μL工作液,碾磨触角样品,置于冰中孵育20 min,然后在4 ℃、12 000 r·min-1下离心15 min,将上清转移至新的离心管中,获得触角组织粗蛋白,-80 ℃保存备用。
AplaOBP2重组蛋白和触角粗蛋白通过4%~20% SDS-PAGE电泳分离,采用湿转法将蛋白从聚丙烯酰胺凝胶转移至聚偏二氟乙烯(PVDF)膜上。参照Western Blot Kit说明书进行Western blot操作。参照eECL Western Blot试剂盒说明书,将增强型发光剂和稳定剂等体积混合,配成化学发光检测底物工作液,使用化学发光成像分析仪(AI680, GE, USA) 进行检测。
1.2.3 免疫组织化学检测 将白蜡窄吉丁雌、雄成虫触角浸入含4%多聚甲醛和2%戊二醛的0.1 mol·L-1PBS(pH7.4)溶液中4 ℃固定过夜; 样品经乙醇梯度脱水后,置于LR白色树脂(Taab, Aldermaston, Berks, UK)中60 ℃聚合。使用Reichert Ultracut超薄切片机(Reichert Company, Vienna, Austria)进行切片,厚度为60~80 nm,切片用铜网收集。将含有切片的铜网用双蒸水冲洗后,置于20 μL PBSG(PBS含有50 mmol·L-1甘氨酸)中孵育5 min,重复该步骤1 次; 铜网用重蒸水冲洗6 次,转移到20 μL PBST(PBS含0.01%的明胶、1%牛血清白蛋白和0.02%Tween-20)孵育5 min,重复该步骤1次。双蒸水冲洗后,铜网置于20 μL一抗(PBST稀释,1∶5 000),室温孵育1 h后,4 ℃过夜。双蒸水冲洗后,将铜网移至胶体金颗粒偶联的羊抗兔二抗(PBST稀释,1∶20)室温避光孵育90 min; 经PBST、PBSG和双蒸水清洗后,加增感液避光20 min进行银增感; 双蒸水清洗后,用2%醋酸双氧铀染色10 min; 再用双蒸水清洗,干燥后用Hitachi H-7500 TEM(Hitachi Ltd., Tokyo, Japan)透射电镜进行观察; 用免疫前的兔血清代替一抗作为阴性对照。雌虫和雄虫纵切和横切样品,各3个重复。
1.2.4 荧光竞争结合试验 以58种气味物质为候选配体,其中包括27种寄主植物挥发物(表1),利用F-380荧光分光光度计(天津港东科技发展股份有限公司,天津)进行荧光竞争结合试验,扫描发射波长范围370~550 nm,激发波长337 nm。使用色谱级甲醇溶解荧光探针1-NPN,母液使用浓度为1 mmol·L-1。在测定AplaOBP2与探针的结合能力曲线时,比色杯中加入溶解在pH7.4的PBS缓冲液中的重组蛋白AplaOBP2溶液,终浓度为2 μmol·L-1,在337 nm的激发波下,加入探针的浓度从2 μmol·L-1梯度递增至12 μmol·L-1,记录与蛋白的结合值,重复3 次。筛选配体时,加入配体的浓度从2 μmol·L-1梯度递增至20 μmol·L-1,通过Scatchard 方程计算竞争解离常数KD:KD=[IC50]/(1 +[1-NPN]/K1-NPN) 。式中,IC50是配体置换50%探针1-NPN时的浓度,[1-NPN]是未结合的1-NPN的浓度,K1-NPN为AplaOBP2与1-NPN的解离常数(Guetal., 2011)。
1.2.5 EAG反应 将待测试化合物溶于石蜡油配成10 mg·mL-1的溶液,取20 μL滴加于滤纸条上(5 cm×1 cm),置于1 mL移液枪头内作为给药筒。用刀片将白蜡窄吉丁雌雄成虫触角从基部切下,去除尖端后插入参考电极(毛细管中浸3 mol·L-1的KCl溶液),连接至EAG微操作台,触角另一端插入记录电极。EAG仪器通过IDAC-2信号采集器与计算机相连。触角距离气味混合管1 cm。以30 s的间隔产生0.5 s的刺激,恒定流量为10 mL·s-1。触角产生的信号用EAG Pro软件(Syntech)记录。以乙酸顺-3-己烯酯作为标准参照刺激对各测试样品的刺激反应进行标准化校正。每次进行样品刺激前先进行1次对照(石蜡油)和标准参照刺激,然后随机测试待测样品,再进行对照和标准参照刺激,每根触角测试1个循环。对每个待测样品,分别记录雌虫和雄虫不同个体的8根触角电位反应。将2次邻近的标准参照刺激的EAG平均值减去2次邻近的对照刺激的EAG平均值作为标准参照值,其他样品的EAG值减去对照的EAG平均值后再除以标准参照值进行标准化校正。
1.2.6 嗅觉行为反应 “Y”型嗅觉仪内径2.5 cm,主臂长25 cm,两侧臂长均为20 cm,两者夹角为60°。载气由大气采样仪泵入,流量设为1.0 L·min-1,空气经过活性炭过滤和空气加湿后进入“Y”型管,各部件之间用硅胶管连接。“Y”型管两臂端部分别与含有20 μL测试样品(浓度10 mg·mL-1,用石蜡油稀释)和对照石蜡油滤纸条的样品瓶连接。白蜡窄吉丁雌、雄成虫饥饿24 h 后用于测量,试验测定在成虫活跃的10:30—15:30进行。将试虫放在主臂入口,使其头部朝向两侧臂,观察成虫的选择反应。若试虫在5 min内沿主臂进入任一侧臂内超过2 cm,并停留30 s以上,则视为有选择; 若停留在主臂则视为无反应。每测试5头成虫即交换左右臂位置,并更换滤纸条,测试10头后更换干净的“Y”型管。每种测试样品至少记录30头有反应成虫。
1.3 数据分析
利用SPSS软件(SPSS 7.0, SPSS Inc., USA),采用Tukey’s HSD多重比较方法对白蜡窄吉丁雌、雄成虫对不同挥发物的EAG反应进行差异显著性分析; 雌、雄成虫间对同一化合物的EAG反应采用t-检验检测差异显著性; 嗅觉行为反应的数据采用卡方检验进行差异显著性分析。
2 结果与分析
2.1 气味结合蛋白AplaOBP2的重组表达
AplaOBP2重组蛋白在上清中不表达,而在包涵体中大量表达(图 1),因此选择包涵体进行蛋白纯化。重组蛋白经过亲和层析纯化及肠激酶切后得到分子质量约为14 kDa的目的蛋白(预测的分子量13.8 kDa)。超滤后得到浓度为1 mg·mL-1纯化蛋白,用于抗体制备及竞争性结合试验。

图1 白蜡窄吉丁AplaOBP2重组蛋白SDS-PAGE分析Fig.1 SDS-PAGE analysis of the recombinant AplaOBP2 of A. planipennisM: 蛋白质分子质量标准Protein molecular weight marker; 1: 未诱导的大肠杆菌菌体Non-induced Escherichia coli; 2: 诱导的大肠杆菌菌体Induced E. coli; 3: 上清液Supernatant; 4: 包涵体蛋白Inclusion body protein; 5: 带His 标签AplaOBP2 蛋白Recombinant AplaOBP2 with His-tag; 6: 无His 标签AplaOBP2蛋白Recombinant AplaOBP2 without His-tag.
2.2 Western blot检测
AplaOBP2重组蛋白和触角粗蛋白分别能够与AplaOBP2抗体特异性结合(图2),均出现一条特异性条带,表明AplaOBP2抗体的特异性能够满足后续的免疫组织化学检测。
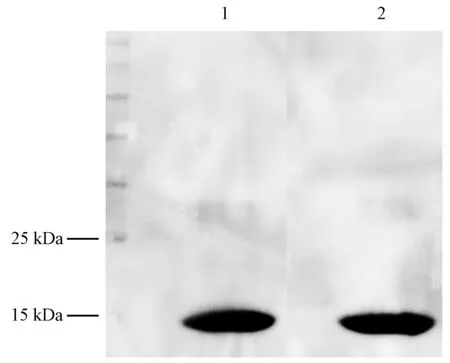
图2 AplaOBP2蛋白Western blot检测Fig.2 Western blot analysis of AplaOBP21: AplaOBP2重组蛋白Recombinant AplaOBP2; 2: 提取自白蜡窄吉丁的触角粗蛋白Crude protein extracted from antennae of A. planipennis.
2.3 气味结合蛋白AplaOBP2在触角中的表达定位
免疫组化试验结果表明,黑色颗粒标记的AplaOBP2蛋白分布在锥形感器类型Ⅰ的感器腔中,在锥形感器类型Ⅱ、 类型Ⅲ和单孔化学感器的感器腔中均未检测到特异的黑色标记颗粒(图3) 。
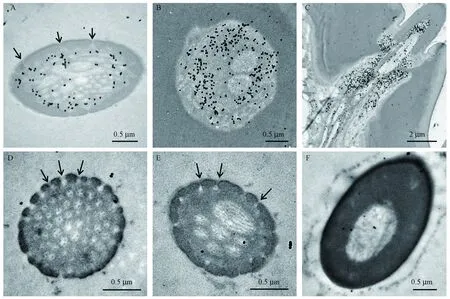
图3 AplaOBP2蛋白在白蜡窄吉丁触角的免疫定位Fig.3 Immunocytochemical localization of AplaOBP2 protein in the antenna of A. planipennisA: 黑色颗粒标记的AplaOBP2蛋白分布在锥形感器类型I的感器腔中 Black spots labeled AplaOBP2 proteins were distributed in the hair lumen of the sensilla basiconica type I; 横切(B)和纵切(C)显示AplaOBP2蛋白在锥形感器I基部表达 A cross section(B) and longitudinal section(C) showed the expression of AplaOBP2 proteins at the base of s.basiconica type I; 锥形感器Ⅱ(D)、锥形感器Ⅲ(E)和单孔化学感器(F) 的感器腔未被标记 The hair lumen of s.basiconica type Ⅱ(D), s.basiconica type Ⅲ (E) and uniporous chemoreceptors (F) was never labeled; 箭头表示嗅觉感器上的壁孔Arrows indicate wall pores on the sensillum.
AplaOBP2蛋白在锥形感器的表达,推测其可能在嗅觉识别中发挥功能。
2.4 AplaOBP2重组蛋白配体结合特征
以1-NPN为荧光探针,利用竞争性结合试验测定了58种挥发性化合物与AplaOBP2重组蛋白的亲和力,其中27种挥发物属于白蜡树挥发物。首先,测定了AplaOBP2对1-NPN的亲和力常数。AplaOBP2与1-NPN可逆结合,解离常数KD为1.26 μmol·L-1,表明1-NPN是一种合适的荧光探针(图4)。荧光竞争结合试验结果表明,6种化合物与AplaOBP2重组蛋白有较强的结合能力,包括: 反-2-己烯醛、反-2-庚烯醛、苯甲醛、3′,4′-二甲氧基苯乙酮、4′-乙基苯乙酮和β-紫罗兰酮(图 5)。AplaOBP2重组蛋白与β-紫罗兰酮结合能力最强,解离常数KD为0.63 μmol·L-1(表1)。
2.5 白蜡窄吉丁成虫对AplaOBP2配体的EAG反应
为明确AplaOBP2结合配体对白蜡窄吉丁成虫是否具有活性,首先测定了白蜡窄吉丁雌雄成虫对6 种配体在10 mg·mL-1浓度的触角电位反应(表2)。结果表明,所有配体均能引起雌虫和雄虫EAG反应,并且雌雄虫之间的差异不显著。由表2可以看出,不同挥发物引起的白蜡窄吉丁触角反应不同,其中反-2-己烯醛和反-2-庚烯醛在雌雄触角中能够引起较大的EAG反应,而β-紫罗兰酮引起的雌雄触角反应最弱。
2.6 白蜡窄吉丁成虫对AplaOBP2配体的“Y”型嗅觉行为反应
进一步采用“Y”型嗅觉仪检测了雌虫和雄虫对AplaOBP2配体的行为反应。在10 mg·mL-1测试浓度下,反-2-己烯醛对白蜡窄吉丁雌虫具有显著的引诱作用(P<0.05),对雄虫的引诱量略多于对照,但未达到显著水平; β-紫罗兰酮对白蜡窄吉丁雌虫具有显著的驱避作用(P<0.05),对雄虫驱避作用未达到显著水平; 剩余的4种测试样品对白蜡窄吉丁雌虫和雄虫没有表现出显著的引诱或者驱避作用(图6)。
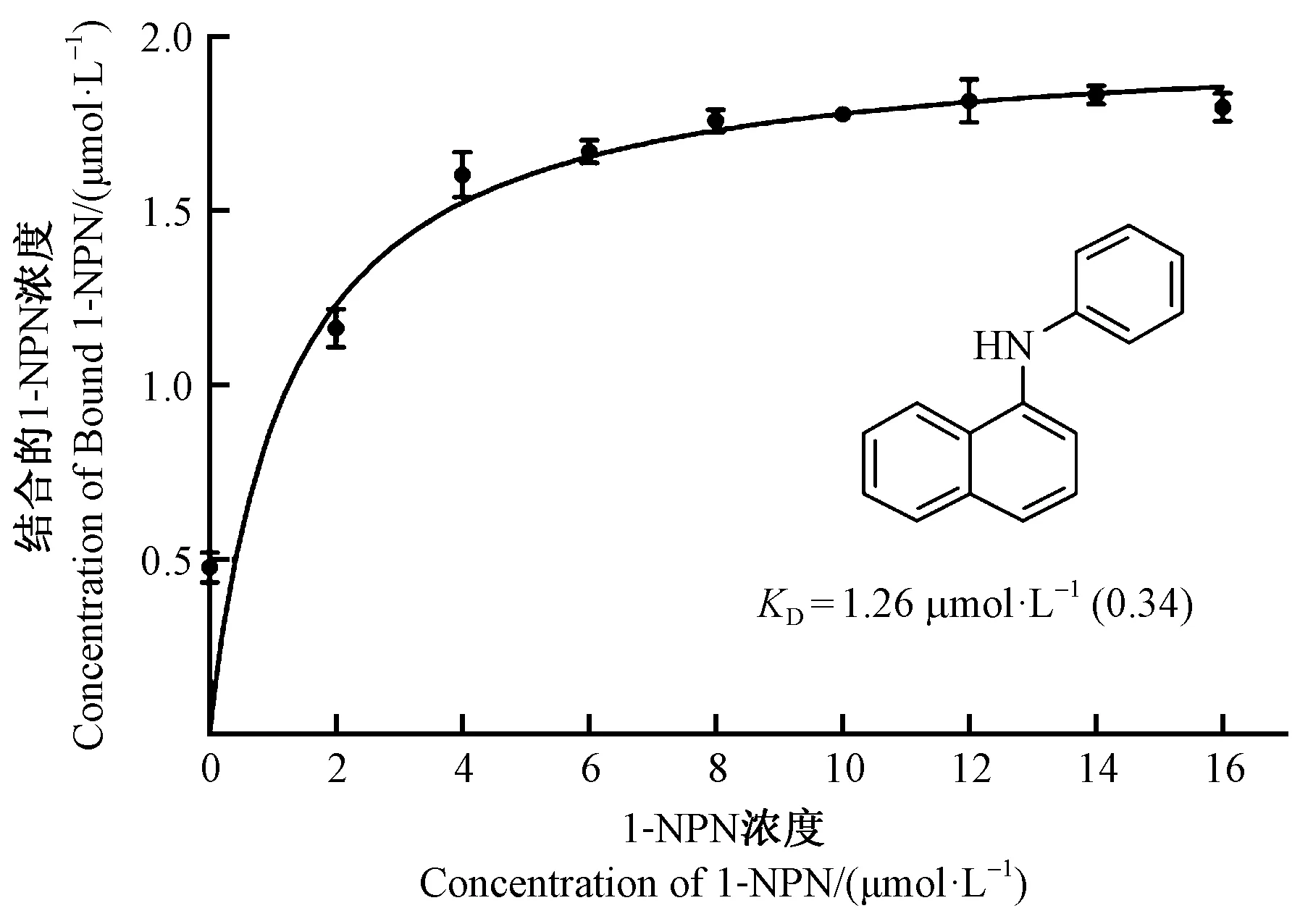
图4 1-NPN和重组蛋白AplaOBP2的结合曲线Fig.4 Binding curve of 1-NPN to recombinant AplaOBP2
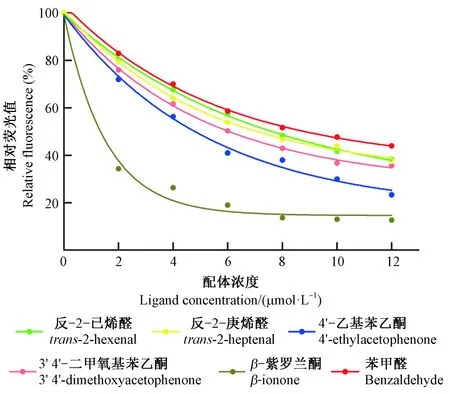
图5 AplaOBP2与6种配体的竞争结合曲线Fig.5 Competitive binding curves of 6 kinds of ligands to AplaOBP2
3 讨论
白蜡窄吉丁触角共分布有4种化学感受器,其中锥形感器类型Ⅰ、Ⅱ和Ⅲ具有壁孔,是典型的嗅觉感受器,而没有壁孔的单孔化学受器则属于味觉感受器,每种化学感器可能参与不同类型化学信号的识别(Crooketal., 2008b)。本研究免疫组化结果表明,气味结合蛋白AplaOBP2在白蜡窄吉丁锥形感器Ⅰ中特异表达,表明它可能选择性结合运输特定类型的气味分子,以满足该类型嗅觉感器的生理功能。荧光竞争结合试验显示AplaOBP2重组蛋白选择性结合醛类和酮类化合物,并表现出强的结合能力,表明AplaOBP2可能参与白蜡窄吉丁的嗅觉识别行为,这与其在嗅觉感器的表达具有一致性。AplaOBP2与AplaOBP1表现出不同的表达及配体结合特征。尽管AplaOBP1同样在锥形感器中表达,但其在类型Ⅰ和类型Ⅲ中均有表达,并且其识别物质主要为萜类物质(Wangetal., 2020)。与AplaOBP2结合的配体化合物中,反-2-己烯醛和4′-乙基苯乙酮属于寄主植物挥发物组分(Rigsbyetal., 2017),因此进一步推测AplaOBP2可能在白蜡窄吉丁寄主识别中发挥功能。
前人的研究发现,白蜡窄吉丁成虫对包括反-2-己烯醛在内的多种寄主绿叶挥发物、单萜和倍半单萜表现出触角反应(Crooketal., 2008a; de Grootetal., 2008; Rodriguez-Saonaetal., 2006)。在本研究中,除反-2-己烯醛以外的其他5种配体也能引起雄虫和雌虫的触角反应,推测它们同样是白蜡窄吉丁潜在的信息化合物。不同配体化合物的EAG值在雌雄间差异均不显著,此次试验仅测定了雌雄各8根触角的EAG反应,因此并不排除由于样本数量少、标准偏差大引起的EAG值差异不显著,其样本量还需进一步增加。反-2-己烯醛是一种常见的绿叶挥发物,尽管前人已经报道了该化合物对白蜡窄吉丁成虫的触角电位活性(Rodriguez-Saonaetal., 2006),但对其行为活性未见报道。本研究通过“Y”型嗅觉仪研究发现,反-2-己烯醛对白蜡窄吉丁雌虫具有明显的吸引活性,因此该化合物可以作为潜在的诱饵组分用于成虫的监测或诱杀。β-紫罗兰酮对白蜡窄吉丁雌虫具有显著地驱避效果,前期研究发现β-紫罗兰酮对跳甲(Phyllotretacruciferae)和稻纵卷叶螟(Cnaphalocrocismedinalis)等均有显著驱避作用(Cceresetal., 2016; Sunetal., 2016),与本研究结果相类似。
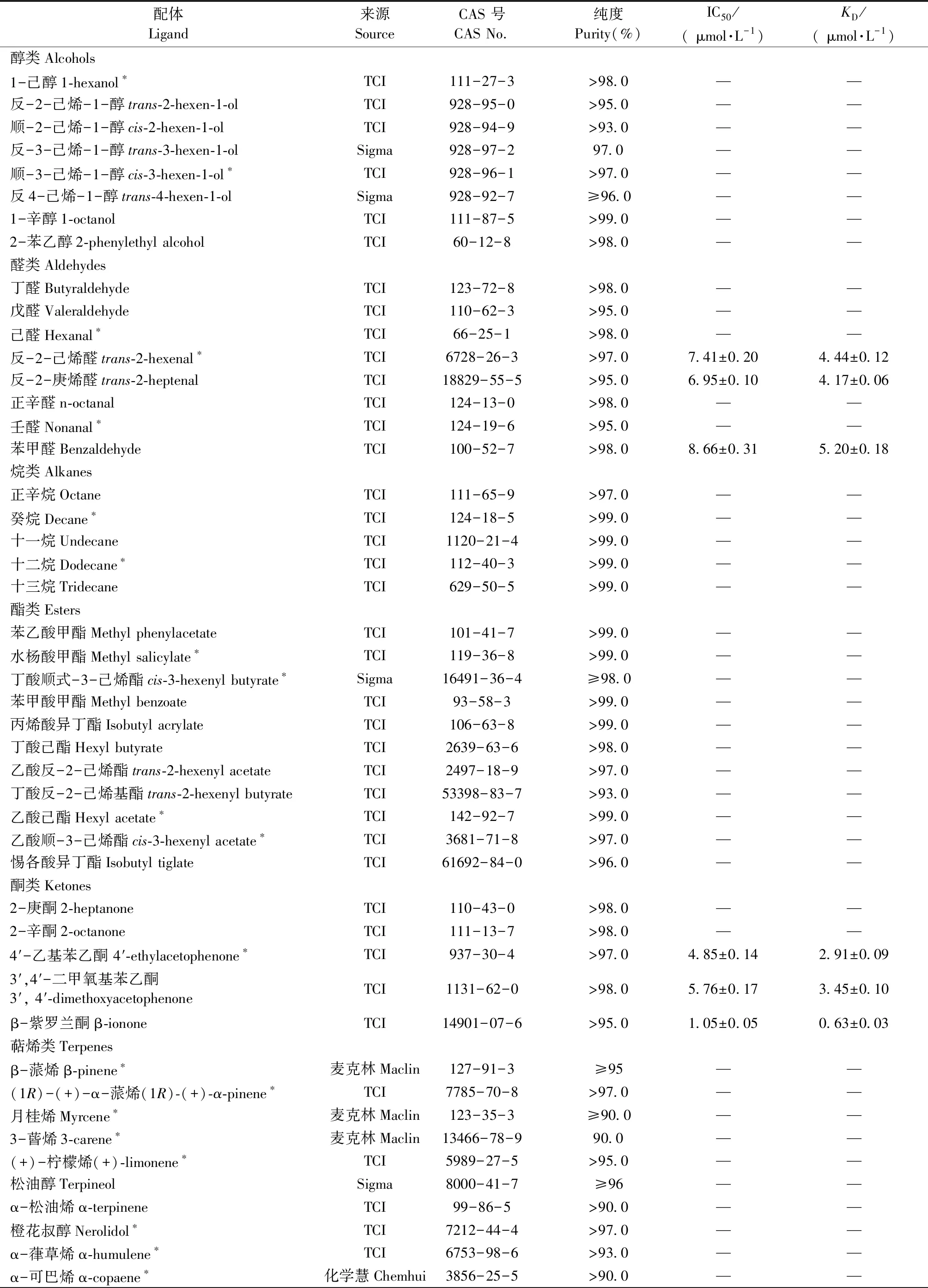
表1 重组AplaOBP2 蛋白与候选配体结合能力①Tab.1 Binding capabilities of the recombinant AplaOBP2 to candidate ligands

续表1 Continued

图6 白蜡窄吉丁雌雄虫对AplaOBP2配体(10 mg·mL-1)的行为反应Fig.6 Behavioral responses of male and female A. planipennis to the ligands(10 mg·mL-1) of the AplaOBP2数据统计采用卡方检验,星号表示在0.05水平下处理和对照(石蜡油)间存在显著差异,ns表示不存在显著性差异( P>0.05)。 The Chi-square test was used for data analysis.The asterisk indicate significant difference between the treatment and the control(paraffin oil) at the 0.05 level, while ns indicates no significant difference(P>0.05).

表2 白蜡窄吉丁雌雄成虫对AplaOBP2配体(10 mg·mL-1) 的EAG反应①Tab.2 EAG responses of male and female A. planipennis to the ligands(10 mg·mL-1) of the AplaOBP2
目前,寄主绿叶挥发物顺-3-己烯醇作为白蜡窄吉丁诱饵的主要组分,已广泛用于白蜡窄吉丁成虫的监测,田间诱集效果表明,顺-3-己烯醇对雄虫的诱集效果优于雌虫(Grantetal., 2010; 2011)。本研究发现反-2-己烯醛对白蜡窄吉丁雌虫表现出显著的引诱活性,因此可以考虑将其与顺-3-己烯醇联合使用,增强现有诱饵对白蜡窄吉丁雌虫的诱集效果,但是其诱集活性还需进一步通过田间试验验证。另外,本研究仅测定了单一剂量的单一组分化合物对白蜡窄吉丁成虫的行为反应,化合物不同浓度和混配可能对白蜡窄吉丁成虫具有不同的行为活性,还需进一步试验验证。
4 结论
免疫组织化学研究显示AplaOBP2蛋白在白蜡窄吉丁嗅觉感受器——锥形感器Ⅰ中表达,荧光竞争结合研究发现AplaOBP2重组蛋白能与反-2-己烯醛、反-2-庚烯醛、苯甲醛、4′-乙基苯乙酮、3′,4′-二甲氧基苯乙酮和β-紫罗兰酮6种化合物结合,并且6种配体均能引起成虫触角的电生理反应,推测AplaOBP2在白蜡窄吉丁嗅觉识别中发挥功能。室内行为学试验发现反-2-己烯醛能显著吸引白蜡窄吉丁雌成虫,而β-紫罗兰酮则对雌虫具有明显的趋避作用,2种化合物可作为潜在的信息素组分用于白蜡窄吉丁行为调控。本研究为阐明白蜡窄吉丁的嗅觉识别机制奠定了基础,也为以OBP蛋白作为靶标筛选白蜡窄吉丁嗅觉行为调控剂用于该虫防治提供了依据。

