神经导航辅助显微手术对胶质瘤的疗效观察
潘万喜,陈少军,刘甜甜,姜莱,韩晶,姚龙飞,黄鑫
胶质瘤约占原发性中枢神经系统(central nervous system,CNS)肿瘤的27%,其恶性程度较高,占恶性CNS 肿瘤的80%以上[1]。手术切除是目前治疗胶质瘤最有效的手段,目前以创伤较小的显微技术应用较多,相较于传统外科开颅手术创伤更小,对正常脑组织的干扰更小[2]。但由于胶质瘤常生长于脑功能区或近功能区,加之常呈浸润性生长,与周围正常组织界限模糊,术中往往难以准确分辨其边界而导致肿瘤不能完全切除或伤及毗邻正常组织,术后容易遗留并发症或预后不良[3]。神经导航技术融合了立体定向技术、影像学技术及微创手术技术等多种技术,以术前手术方案设计及术中手术操作实时指导精确定位病变位置及边界,确保手术的精准化和微创化[4]。目前,神经导航技术已应用于多种颅内病变手术的治疗,被认为是颅内显微手术的有效辅助手段[5]。对于脑功能区和近功能区胶质瘤患者而言,应用神经导航技术辅助显微手术是否能使患者进一步获益目前仍缺乏充分研究证据。本研究观察神经导航辅助显微手术治疗脑功能区和近功能区胶质瘤的疗效及对神经功能的影响,旨在为这类胶质瘤的治疗及神经导航技术的推广提供依据。
1 资料与方法
1.1 一般资料
选取2017 年1 月至2019 年6 月在本院神经外科接受显微手术治疗的脑功能区和(或)近功能区胶质瘤患者89 例,纳入标准:经头颅CT 和/或MRI检查确诊脑胶质瘤,且颅内占位性病变位于功能区或距离功能区≤2 cm;术后组织切片病理检查确诊为脑胶质瘤;具有手术指征;年龄19~65 岁,性别不限;初次接受颅脑手术;意识清楚,术前认知功能基本正常,能配合诊疗与临床评估;术前Karnofsky功能状态量表(Karnofsky performance status,KPS)评分≥60分;预计生存期≥3月;能配合术前检查及术后评估,本人和(或)其家属自愿且知情同意。排除标准:术前肢体完全瘫痪(肌力为0级);既往脑血管疾病病史、脑部手术史或颅脑外伤史;术前接受放化疗等辅助治疗;合并严重心、肝、肺、肾等重要脏器功能障碍、凝血功能障碍;合并其他恶性肿瘤及自身免疫性疾病;具有其他手术禁忌证;既往精神类疾病史或具有精神心理异常;临床资料、病理资料及随访资料不完整。男63例,女36例;反复头晕头痛38例,一侧肢体乏力或麻木21例,言语障碍或口齿不清10 例,视力下降或视野缺损3 例,癫痫26例,体检偶然发现11例。所有患者按随机数字表法分为2 组:①对照组48 例,男30 例,女18 例;年龄(41.05 ± 5.13)岁;体质量指数(body mass index,BMI)(22.76±1.44)kg/m2;肿瘤直径(3.82±1.26)cm;病理分级Ⅱ级11例(22.92%),Ⅲ级29例(60.42%),Ⅳ级8 例(16.67%);病灶于中央回32 例(66.67%),于Broca 区7 例(14.58%),于Wernicke 区5 例(10.42%),其他位置9例(18.75%);累及功能区1处44例(91.67%),2处3例(6.25%),3处1例(2.08%);②观察组41 例,男23 例,女18 例;年龄(42.36±5.27)岁;BMI(22.69±1.36)kg/m2;肿瘤直径(4.16±1.41)cm;病理分级Ⅱ级8 例(19.51%),Ⅲ级24 例(58.54%),Ⅳ级9 例(21.95%);病灶于中央回32 例(78.05%),于Broca 区5 例(12.20%),于Wernicke 区4 例(9.76%),其他位置6 例(14.63%);累及功能区1 处36 例(87.80%),2处4例(9.76%),3处1例(2.44%)。2组的一般资料比较差异均无统计学意义(P>0.05)。本研究设计符合《世界医学协会赫尔辛基宣言》(2013 年版)要求,并经医院伦理委员会审核通过。
1.2 方法
1.2.1 术前准备 所有患者术前均接受3.0 T颅脑MRI平扫联合增强扫描和弥散张量成像(DTI),MRI 成像包括三维T1加权成像(T1WI)、T2加权成像(T2WI)及T2液体衰减反转恢复(T2-FLAIR)成像。病灶位于语言中枢者,加行血氧水平依赖功能磁共振成像(blood oxygen level dependent-fMRI,BOLD-fMRI)。术前MRI检查提示存在肿瘤周围水肿或颅内压增高症状者,给予激素及甘露醇治疗,预防性使用抗癫痫药物及抗感染药物。
1.2.2 导航计划 观察组患者的影像学数据均导入神经导航系统计算机工作站Brain Lab(iPlan 3.0)中,融合相同解剖位置断面解剖图进行三维重建,利用靶点描绘技术描记肿瘤范围。Ⅱ级肿瘤以T2WI或T2-FLAIR序列进行融合后描绘,Ⅲ~Ⅳ级肿瘤则以T1WI序列融合描绘,并利用BOLD 映射分析技术生成相应功能区三维结构。根据三维结构设计最佳手术切口及入路,并拟定手术计划。
1.2.3 手术方法 所有患者的手术均由同一团队完成手术,均于气管插管麻醉下手术。对照组:按常规显微手术步骤,术者根据术前影像学参数结合手术经验及患者的具体情况拟定手术切口、入路及计划,镜下定位肿瘤边界及相应功能区,避开功能区切除肿瘤,同时尽量保护皮质下重要白质纤维束。观察组:麻醉后摆放手术体位,患者的头部以Mayfield头架固定,安装神经导航参考架于头架上,启动神经导航系统,确认头皮坐标与影像学定位坐标匹配,并根据患者的面部标志以激光定位器实施表面注册,如平均注册匹配误差(MFE)>4 mm 则重新注册。肿瘤、功能区及纤维束投影至患者头皮表面,确认头皮切口后逐层切开,钻孔开颅,硬脑膜四周予以悬吊止血,打开硬脑膜前再次导航定位肿瘤边界及功能区的毗邻关系,避开功能区剪开硬脑膜,在导航指引下利用显微镜尽量切除肿瘤,直至肿瘤切除已达术前计划范围或完全切除。术区严密止血,缝合硬脑膜,回纳骨瓣并采用颅骨锁固定,逐层缝合,术毕。
1.2.4 术后处理 术后均予预防感染、降颅内压及营养支持等常规治疗,Ⅱ级患者术后不予特殊处理,如为次全切除或部分则实施放疗,采用直线加速器6MVX 放疗,放射剂量为40~60 Gy/28~32 次;Ⅲ~Ⅳ级患者术后均增加放化疗,放疗方案如上,化疗药物为替莫唑胺单药口服,75 mg/m2,1 次/d,连续服用42 d,放疗结束后改为替莫唑胺150~200 mg/d,5 d/周,4 周为1疗程,连续服用6个疗程。放化疗均于术后2~4周开始。
1.3 观察指标
术后72 h复查头颅MRI,计算肿瘤体积(V)=π×a×b×c/6(a、b、c 对应肿瘤三轴长径),计算切除率=(V术前-V术后)/V术前×100%。根据切除率评价胶质瘤切除程度:完全切除,肿瘤完全切除且头MRI 复查未见病灶残留;次全切除,肿瘤切除率≥80%;部分切除,肿瘤切除率50%~80%。术前及术后7 d,晨取空腹静脉血4 mL,采用酶联免疫吸附法(ELISA)测定血清转化生长因子β(transforming growth factor-β,TGF-β)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)和低氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)水平。术前及术后3月,用KPS评分评价患者功能状态与生存质量,总分0~100分,得分越高则表示功能状态越好;采用日常生活能力量表(activity of daily living scale,ADL)评价日常生活活动能力,总分14~56分,得分越高则生活活动能力越差;采用美国国立卫生研究院卒中量表(NIH stroke scale,NIHSS)评价神经功能,总分0~42 分,得分越高表明神经功能缺损越严重。术后3月根据肌力情况评价致残率,肌力分为0级(完全瘫痪)、1级(仅肌肉轻微收缩)、2级(肢体可床上平移)、3 级(可对抗地心引力运动但不能对抗阻力)、4 级(肢体可对抗外界阻力运动)、5 级(肌力正常),与术前比较分为无变化或改善、轻度变化(下降1~2 级)、重度变化(下降≥3级)。
1.4 随访
采用门诊复查结合电话随访的方式完成术后随访,分别于术后3、6、12 月复查颅脑MRI,此后每年定期复查1 次,观察临床症状变化,统计生存情况。
1.5 统计学处理
采用SPSS22.0统计学软件分析数据。计量资料以(±s)表示,t检验;计数资料以[率(%)]表示,χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 2组肿瘤切除程度比较
观察组41 例患者神经导航注册MFE 均<2 mm,平均为(0.98±0.09)mm,均在神经导航辅助结合IOUS探查3~8次,平均(5.01±1.54)次后顺利完成手术,肿瘤发现率和准确定位率均为100%。2 组均无术中或术后住院期间死亡,对照组颅内感染2例,给予抗感染治疗后好转。观察组的完全切除率显著高于对照组,有显著性差异(χ2=13.425,P=0.000),见表1。
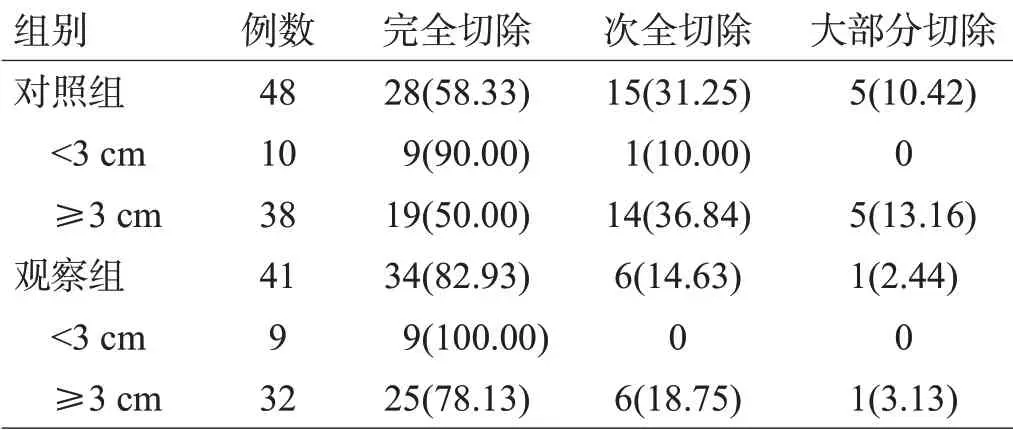
表1 2组肿瘤切除程度比较[例(%)]
2.2 2组血清TGF-β、VEGF、GFAP、HIF-1α水平比较
术前,2组血清TGF-β、VEGF、GFAP、HIF-1α水平比较差异无统计学意义(P>0.05),术后7 d 复测均有明显降低,且观察组均明显低于对照组(P<0.05),见表2。
表2 2组血清TGF-β、VEGF、GFAP、HIF-1α水平比较(±s)

表2 2组血清TGF-β、VEGF、GFAP、HIF-1α水平比较(±s)
组别对照组观察组t值P值例数48 41 TGF-β/(ng/L)术前53.85±10.76 56.49±12.18 1.086 0.281术后7 d 26.32±8.43①20.11±6.79①3.783 0.000
2.3 2组KPS、ADL、NIHSS评分比较
2 组术前KPS、ADL、NIHSS 评分比较差异无统计学意义(P>0.05),术后3月复评,KPS 评分均明显升高,ADL、NIHSS评分均明显降低,且观察组的改善程度较对照组更显著(P<0.05),见表3。
表3 2组KPS、ADL、NIHSS评分比较(分,±s)

表3 2组KPS、ADL、NIHSS评分比较(分,±s)
注:与术前比较,①P<0.05
组别对照组观察组t值P值例数48 41 KPS术前72.12±5.11 70.85±4.79 1.203 0.232术后3月90.22±5..17①94.21±5.31①3.584 0.001 ADL术前32.18±5.19 33.85±5.24 1.506 0.136术后3月18.44±4.46①15.72±4.01①3.003 0.003 NIHSS术前13.75±3.26 14.03±3.11 0.412 0.681术后3月8.23±2.02①6.41±1.32①4.937 0.000
2.4 随访结果
2组术后均随访3~18月,平均随访时间分别为(9.62±2.64)月、(9.51±2.51)月。随访期间,2组术前头晕头痛症状均明显改善,其余症状均有不同程度的改善,术前癫痫患者均继续口服抗癫痫药物,随访期间未见癫痫复发。观察组肌力下降2 例(4.88%),均为轻度变化。对照组肌力下降8 例(16.67%)(轻度变化5例,重度变化3例);小病灶3例,1例小病灶患者新增感觉性失语,1 例小病灶患者失语较术前加重,并发症总发生率为20.83%(10/48),观察组显著低于对照组(χ2=9.976,P=0.001)。
随访期间,观察组复发4例,均为局部复发,1例接受二次手术后仍存活,另3例放弃再次手术并在术后9~12月死亡,1年生存率为92.68%(38/41)。对照组1例患者术后5月失访,另47例患者中,复发11例,仅3例再次手术,其余8例患者均于术后6~12 月死亡,1 年生存率为82.98%(39/47)。2 组的1 年生存率差异无统计学意义(χ2=3.541,P=0.060)。
3 讨论
脑胶质瘤是起源于神经胶质细胞的肿瘤,低级别胶质瘤(Ⅰ~Ⅱ级)因细胞分化程度且生长速度缓慢,多可经手术切除获得良好预后,而高级别胶质瘤(Ⅲ~Ⅳ级)由于恶性程度高且侵袭性强,术后极易复发,临床预后较差,中位生存期仅11.23~18.56月[6]。肿瘤切除程度直接影响胶质瘤患者的预后,不仅提高后续治疗效果,且可延迟肿瘤复发,降低复发率[7]。由于脑胶质瘤呈浸润性生长,且往往未局限于单一脑叶,手术完全切除难度大,尤其是对于脑功能区及近功能区胶质瘤患者而言,因术中难以准确判断肿瘤灶范围及与周围重要白质纤维束之间的解剖关系,即便是使用功能显微镜辅助手术仍很难获得肿瘤完全切除,术后复发、转移风险较高,而切除范围过大极易造成周围正常脑组织损伤[8]。因此,胶质瘤显微手术中如何更准确地分辨肿瘤与毗邻关系,提高切除精准度非常关键。
常规显微手术中术者主要根据术前影像资料(CT、MRI等)结合手术经验施术,术中定位难度相对较大,且盲目探查可能增加手术创伤及出血,尤其是对脑功能区及近功能区肿瘤如处理不当,容易损伤周围正常脑组织,引起失语、运动功能障碍等严重后遗症[9]。但切除范围不足可致肿瘤残留,增加肿瘤复发转移风险,导致术后生存时间缩短。尤其是对小病灶(直径<3 cm)患者,术中往往因难以精确定位和难以界定肿瘤边界,对肿瘤精准切除及功能区保护均是极大的挑战。神经导航技术可融合术前影像学数据,利用三维重建直观、立体地显示肿瘤及周围解剖关系,便于术者选择最佳手术切口、入路及切除范围等,避免因定位困难而被迫延长切口或扩大骨窗[10]。同时,神经导航技术有利于术者精准定位肿瘤边界,指导术者更精准地切除病变。此外,精准神经导航引导便于术者避开重要血管、神经等解剖结构,降低术后并发症发生风险[11,12]。本研究结果显示,观察组均在神经导航辅助下顺利完成手术,肿瘤发现率和准确定位率均为100%;观察组9例小病灶均获得完全切除,对照组1例小病灶未能获得完全切除,且在≥3 cm病灶中完全切除率亦明显高于对照组(P<0.05),提示神经导航辅助显微手术能使功能区或近功能区胶质瘤患者获益,提高切除效果。术后随访显示,对照组有8例肌力下降,1例失语加重,另有1例新增感觉性失语,其中5 例为小病灶,考虑与术中误伤功能区或周围正常组织所致。观察组术后仅2 例肌力有轻度下降,未见其他症状加重或新增功能缺失,与对照组相比差异显著。提示神经导航技术可能有助于术者更高效、精准地切除病灶,降低医源性损伤,从而降低并发症发生风险,更好地保护神经功能。本研究还显示,术后3月,2 组患者的ADL、NIHSS 评分较术前明显降低,KPS 较术前明显升高,且观察组优于对照组(P<0.05),进一步表明神经导航技术的应用可能有利于保护患者的神经功能,也间接提高了患者的生存质量。究其原因,可能是由于神经导航辅助显微手术能更直观、准确地定位肿瘤并辨别毗邻组织结构,提高肿瘤切除准确度,并更好地分辨和保护神经、血管等重要结构,既充分兼顾肿瘤全切的需求,又可最大限度地避免不必要的暴露或损伤,术后恢复更好[13]。秦海杰等[14]研究显示,脑胶质瘤全切除手术较次全切除手术可更好地改善患者的神经、认知功能。本研究中,观察组的肿瘤完全切除率明显高于对照组,这可能也是观察组术后ADL、NIHSS及KPS改善更理想的原因之一。

注:与术前比较,①P<0.05
相关研究显示,显微手术能降低胶质瘤患者脑脊液中神经肽表达水平,降低复发转移风险[15]。受条件限制及患者接受度等因素影响,本研究未能获得脑脊液神经肽变化数据。但术后7 d时观察组的血清TGF-β、GFAP、HIF-1α、VEGF水平均低于对照组(P<0.05)。其中,TGF-β、VEGF与血管新生关系密切,被证实参与多种恶性肿瘤的生长及转移、复发等过程,可作为肿瘤治疗的新靶点[16]。GFAP参与胶质细胞的增殖和分裂过程,并参与血-脑脊液屏障的保护,是脑胶质瘤诊断及病情评估的敏感标志蛋白;HIF-1α是一种组织低氧应答调控因子,可在低氧环境下诱导多种基因的表达,参与肿瘤细胞的浸润及转移过程,已被证实与胶质瘤的恶性程度及临床预后相关[17]。李密等[18]研究表明,胶质瘤患者的血清GFAP、HIF-1α、VEGF均呈明显高表达,且与病理分级、临床预后密切相关。分析其原因,认为神经导航能在较大程度上充分切除病灶,并可阻断肿瘤血供,减少对周围正常脑组织的损伤,可能更有利于肿瘤的控制。随访结果显示,2组的1 年生存率差异无统计学意义(P>0.05),可能是由于本组研究对象以Ⅲ~Ⅳ级胶质瘤居多,鉴于其恶性程度高、增值快等缺陷,这类患者术后多辅以放疗或放化疗,故短期生存率差异并不显著,远期效果仍有待延长随访时间加以验证。
综上所述,神经导航辅助显微手术治疗脑功能区及近功能区胶质瘤近期获益明显,可有效提高肿瘤切除效果并保护神经功能,改善患者的日常生活自理能力及生活质量。但本研究样本有限且随访时间不足,其远期效果还有待进一步随访观察。

