亚甲蓝治疗腰椎关节突关节综合征的临床效果及安全性研究*
余秀琴. 方洪伟. 张金源. 王明霞. 王祥瑞
(同济大学附属东方医院疼痛科,上海 200210)
随着我国人口老龄化不断加剧,腰痛已成为影响老年人生活的主要疾患之一。据统计,腰痛在门诊病例中成为仅次于上呼吸道疾患的第二常见疾病,严重影响人们的生活质量,并给社会及家庭带来巨大经济负担。腰椎间盘、腰部肌肉、韧带、关节突关节等任何部位病变均可能导致腰痛,临床研究证实15%~52% 的腰痛与腰椎关节突关节退变有关[1]。1933 年 Ghormley[2]将腰椎关节突关节退变伴腰腿痛的临床症状定义为腰椎关节突关节综合征(lumbar facet joint syndrome, LFJS) ,又称“小关节综合征”。腰椎关节突关节是由相邻椎弓上、下关节突形成的可动滑膜关节,脊神经根后支的内侧分支向尾侧走行环绕下一椎体上关节突基底部到达关节突关节,继而走行于上关节突与横突间的沟槽中,发出分支支配邻近上下关节突关节,并以神经末梢形式广泛分布于关节突关节关节囊及滑膜上[3];故腰椎关节突关节至少由两个脊神经后支的内侧支支配,关节突关节各神经支间存在丰富的节段性吻合及变异,这种支配方式形成了复杂的腰腿痛发病机制。目前LFJS 的治疗方法主要有药物治疗、微创介入治疗、外科手术治疗等。其中微创治疗中关节突关节囊内注射对其周围神经阻滞更为完善,且疗效确切,创伤小、易操作,为临床普遍采纳。随着可视化技术发展,超声引导下能够实时清晰地辨认颈胸腰关节突关节的结构,使得这一治疗方式在临床上运用越来越多[4,5]。目前临床上多采用局部麻醉药和糖皮质激素进行关节突关节囊内神经阻滞,但由于糖皮质激素可造成关节软骨表面磨损及软骨硬度降低,诱导软骨细胞变性并抑制其功能等不良反应[6],其临床应用一直饱受争议。亚甲蓝是一种鸟苷酸环化酶抑制剂,可通过影响机体一氧化氮/环鸟核糖单磷酸盐系统 (NO-cGMP) 的兴奋性而产生抗炎镇痛作用,现已用于椎间盘源性腰痛、带状疱疹后神经痛等慢性疼痛的治疗,目前未见关节突关节囊内注射亚甲蓝治疗LFJS 的报道。本研究在充分了解亚甲蓝的相关临床应用、可能的作用机制及不良反应后,对我科 LFJS 病人采用亚甲蓝关节突关节囊内注射治疗,并将临床资料及随访结果进行分析,探讨其临床可行性。
方 法
1. 一般资料
本研究经同济大学医学院附属东方医院伦理委员会批准([2020]研预审第 (070) 号),选取2020年6 月至2020 年11 月疼痛科收治的符合纳入标准的LFJS 病人120 例,采用抽签法随机分为亚甲蓝组(MB 组)和复方倍他米松组(对照组),每组60 例。
纳入标准[7]:①年龄> 18 岁;②慢性腰背部或下肢疼痛时间> 3 个月;③腰痛伴或不伴臀部放射痛提示关节突综合征(脊柱向受累侧伸展或弯曲疼痛加重;久坐、上台阶、长时间保持一个姿势疼痛加重);④保守治疗(物理疗法、药物治疗等)失败。
排除标准:①年龄 < 18 岁;②有腰椎外伤史或接受过腰椎手术者;③腰椎影像学表现异常,但无腰背部疼痛症状者;④诊断为其他病变引起的腰背部疼痛(如腰椎畸形、腰椎结核或肿瘤、椎间盘病变、椎管内病变、其他部位的放射痛、心血管疾患、风湿免疫系统疾病等);⑤1 个月内接受过糖皮质类全身治疗或6 个月内接受过糖皮质类关节突关节囊内注射治疗;⑥妊娠或哺乳期妇女、精神病者、其他重大疾病者。
脱落标准:随访过程中失访。
2. 样本量计算及随机分组
根据预试验结果(每组纳入10 例病人,分别给予亚甲蓝和复方倍他米松(得宝松)治疗,随访6 个月,根据数字评分法 (numerical rating scale,NRS) 评分、症状及局部体征等综合评估,亚甲蓝组8 例病人有效,对照组6 例病人有效),假设治疗组有效率为80%,对照组有效率为60%,a 值取0.025,β 取0.1,假设每组失访率为20%。计算最小样本量为每组56 例,计划每组纳入60 例。
采用抽签法进行随机化分组,制作1~120一百二十张序列号,将序列号装入不透明信封并放置于暗箱中,每名入组受试者签署知情同意书,完成术前基线评估后进行暗箱抽签,抽到序列号为2的倍数入亚甲蓝组(MB 组),序列号数除2 余1的入对照组(复方倍他米松组)。
3.治疗方案
亚甲蓝组采用亚甲蓝注射液2 ml(20 mg/支,生产批号:2002123,济川药业集团有限公司),2%利多卡因5 ml(生产批号:C20A038,山东华鲁制药有限公司),加生理盐水稀释至20 ml,于关节突关节囊内注射阻滞液1.0~1.5 ml。
对照组采用复方倍他米松注射液1 ml(包括二丙酸倍他米松5 mg 与倍他米松磷酸钠2 mg,生产批号:0001162870,上海先灵葆雅制药有限公司),2%利多卡因5 ml,加生理盐水稀释至20 ml,注射量同亚甲蓝组。
根据病人临床症状及体征、影像学表现,确定治疗节段并作好标记。病人取俯卧位,前下腹部垫薄枕。采用聚维酮碘对皮肤进行消毒,并铺置无菌手术巾(见图1A)。选择低分辨率(12~16 MHz)线性阵列换能器探头(S Nerve, Sonosite, Bothell,WA, USA),涂耦合剂,套无菌薄膜,扫描矢状面和冠状面的标记区域,探测到关节突关节后固定超声探头,用1%的利多卡因(生产批号:C20A038,山东华鲁制药有限公司)进行局部麻醉,22G 腰椎穿刺针经超声引导进针,进入皮肤后在超声屏幕上观察针的行进过程,准确到达目标位置关节囊内,MB 组注射亚甲蓝阻滞液1.0~1.5 ml,用同样的方法进行下一关节囊内注射(见图1B)。
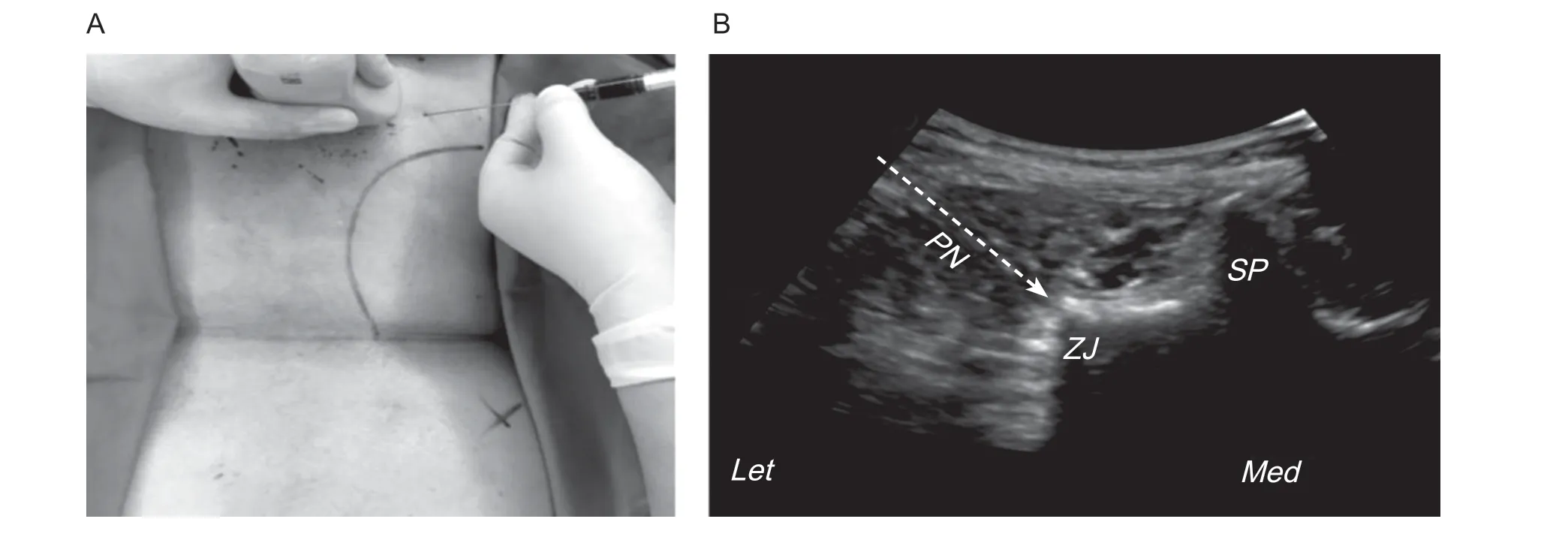
图1 腰椎关节突关节注射治疗示意图
4. 评价指标
(1)疼痛强度采用NRS 评分(0 分为无痛,1~3分为轻度疼痛,4~6 分为中度疼痛,7~9 分为重度疼痛,10 分为剧痛)。于术前、术后1 周、1 个月、3 个月、6 个月进行评估。
(2)腰椎功能障碍指数 (Oswestry disability index, ODI) 评分:一种自行填写的问卷,共有10 个项目,涉及疼痛强度、举重、自理能力、行走能力、坐下能力、性功能、站立能力、社交生活、睡眠质量和旅行能力。ODI 评分中的每个项目有6 个选项表示从0~5 的分数。以百分比评分表示结果:病人总评分/总原始评分×100%。如无完成所有项目,原始总评分将删除未完成项目的评分[8]。于术前及术后6 个月进行评估。
(3)睡眠质量指数:中文版匹兹堡睡眠质量指数 (Pittsburgh sleep quality index, PSQI) 评分:用于评定被试最近1 个月的睡眠质量,由19 个自评和5 个他评条目构成。其中第19 个自评条目和5 个他评条目不参与计分,参与计分的18 个自评条目组成7 个成份,每个成份按0~3 等级计分,累积各成份得分为PSQI 总分,总分范围为0~21,得分越高,表示睡眠质量越差[9]。于术前、术后6 个月随访记录。
(4)焦虑抑郁程度:健康问卷抑郁障碍量表(patient health questionnaire-9, PHQ-9)评分:5~10 分为轻度抑郁,10~15 分为中度抑郁,15~20 分为重度抑郁,15~20 分为重度抑郁[10]。于术前、术后6 个月进行评估。
(5)补救药物评价:术后若出现轻中度疼痛(NRS 评分≤6),给予口服塞来昔布镇痛,若出现重度疼痛(NRS 评分> 7),口服羟考酮镇痛,记录两组病人术后1、3、6 个月内服用补救药物的人数,并评估术后疼痛改善情况。
(6)疗效评价:根据NRS 评分、症状及局部体征等进行综合评估。治愈:症状、体征基本消失,恢复原生活质量;显效:症状体征明显缓解,生活质量改善,但仍有间断的可耐受性疼痛;有效:症状体征有所缓解,但效果不能巩固常有反复;无效:与治疗前相同。有效率 =(治愈+显效+有效)/总例数×100%
(7)安全性指标:术后第1 天观察记录两组病人不良反应(高血糖、高血压、恶心、呕吐)的发生情况;术前及术后6 个月监测病人肝肾功能情况。随访者详细记录每次不良事件并及时上报。
5. 统计学分析
使用 SPSS 22.0 统计软件对数据进行统计学分析,符合正态分布的计量资料采用均数±标准差 (±SD)表示。重复测量计量资料组间比较采取重复测量方差分析,组内比较采用单样本t检验,非正态分布的计量资料与等级资料,组间比较采用 Mann-Whitney 非参数检验。P< 0.05 为差异有统计学意义。
结 果
1.受试者一般资料比较
共104 例受试者完成试验,MB 组53 人(7 人失访);对照组51 人(5 人失访、4 人中途退出临床试验),两组病人在年龄、性别、身体质量指数(body mass index, BMI)、病程、NRS、ODI、PHQ-9及PSQI 评分及肝肾功能等指标比较差异无统计学意义(P> 0.05,见表1)。
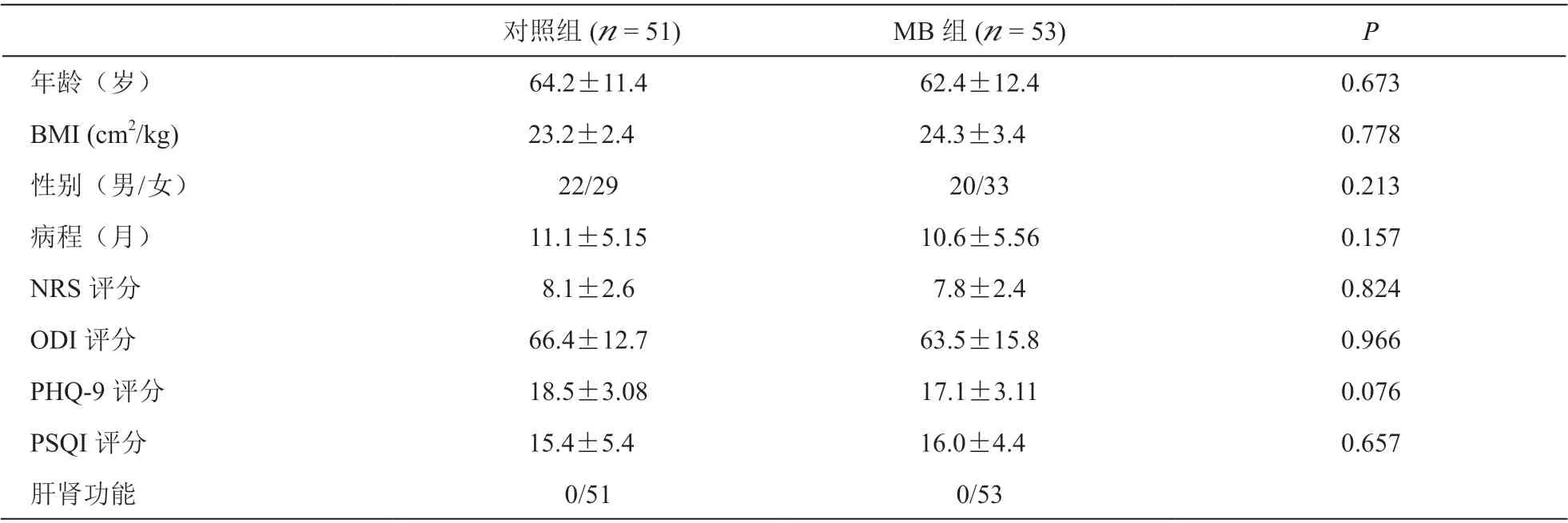
表1 两组病人一般资料和基线评估
2.两组病人疼痛改善、腰椎功能改善情况、睡眠及焦虑抑郁情况
与治疗前相比,两组病人治疗后各时间点的NRS、ODI、PHQ-9 及PSQI 评分均明显下降且差异具有统计学意义(见表2、3)。术后1 周及1 个月MB 组NRS 评分较对照组低,但无统计学差异,术后3 个月和6 个月时MB 组NRS 评分较对照组差异有统计学意义(P< 0.05,见表2)。两组病人术后6 个月时ODI、PHQ-9 及PSQI 评分差异有统计学意义(P< 0.05,见表3)。

表2 两组病人各时间点NRS 评分比较
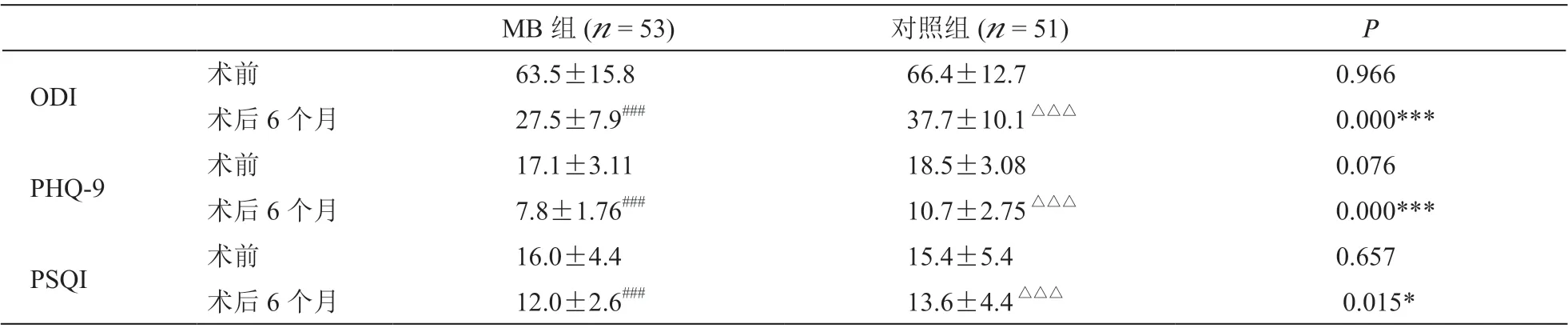
表3 两组病人ODI、PHQ-9 及PSQI 评分比较
3. 补救药物及治疗效果比较
亚甲蓝组病人术后1、3、6 个月口服塞来昔布和羟考酮镇痛较对照组少,但无统计学差异(见表4)。术后6 个月时MB 组和对照组的有效率分别为94.3% 和78.4%(有效率 =(治愈 + 显效 + 有效)/总例数×100%),组间比较差异有统计学意义(P<0.05,见表4)。

表4 两组病人补救药物及治疗效果比较
4. 不良反应及肝肾功能
术后第1 天两组病人不良反应中高血糖的发生情况比较差异有统计学意义,其中MB 组病人中合并糖尿病者高血糖的发生率明显低于对照组(P<0.05,见表5);高血压、恶心、呕吐的发生情况比较无统计学差异。术后6 个月,两组病人均未出现肝肾功能异常变化(见表5)。
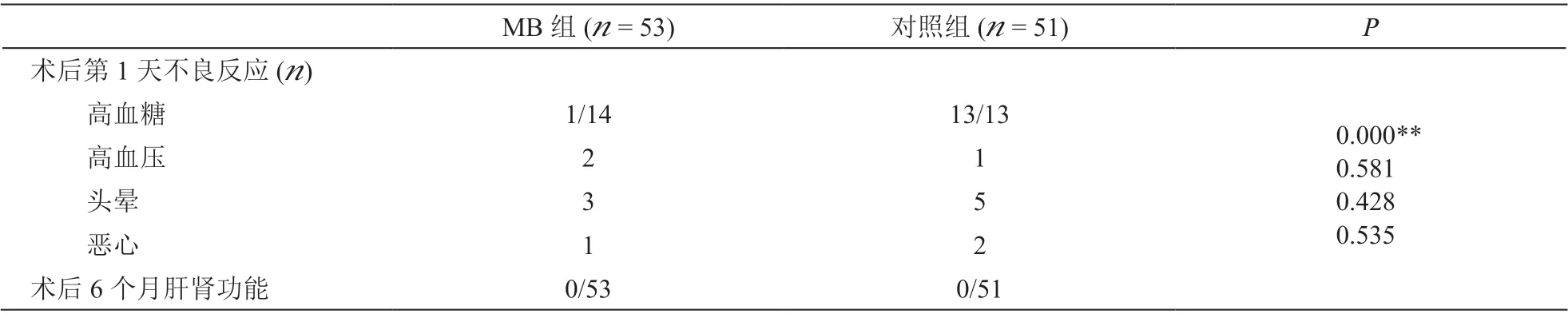
表5 两组病人不良反应及肝肾功能比较
讨 论
本研究采用亚甲蓝与复方倍他米松治疗LFJS病人共完成随访104 例病人,结果分析显示: MB组术后1 周和术后1 月 NRS 评分较对照组低,但术后3 个月和6 个月时NRS 评分差异有统计学意义,表明与对照组比,亚甲蓝具有良好的镇痛效果,且作用时间持久。
亚甲蓝因其抗氧化、抗炎镇痛、神经保护等作用已广泛运用于临床。目前多用于肛管直肠疾病术后痛、椎间盘源性腰痛、带状疱疹后神经痛、三叉神经痛等疼痛相关疾病的治疗[11,12]。有研究表明,亚甲蓝具有较强的亲神经性[13],能够灭活皮肤神经末梢,破坏有髓神经纤维髓鞘,直接阻碍感觉神经的异常传导[12];动物实验证实亚甲蓝通过调节电压门控钠通道,抑制神经放电,显著减弱神经兴奋性进而减轻疼痛[14]。研究表明线粒体功能障碍在周围病理性神经痛中发挥重要作用[15],而亚甲蓝可作用于线粒体内膜,通过影响电子呼吸链中活性氧的产生,从而抑制氧化应激反应,达到抗炎镇痛作用[16,17]。在兔骨性关节炎 (OA) 模型中发现亚甲蓝可上调incRNA MEG3 水平抑制P2X3 蛋白的表达,降低IL-6、TNF-α、IL-1β 和IL-8 水平,显著缓解兔OA模型中炎症和疼痛反应[18]。在大鼠脊髓损伤 (SCI)模型中,亚甲蓝显著改善脊髓损伤后神经炎症,其机制可能为亚甲蓝抑制小胶质细胞NLRP3 和NLRC4炎症小体的激活,进而抑制炎症因子IL-1β 和IL-18的产生,抑制神经元凋亡,改善大鼠后肢运动功能[19]。另一项临床研究采用亚甲蓝胸椎旁神经阻滞治疗带状疱疹后神经痛,结果显示病人VAS 评分明显降低,且血浆IL-6、TNF-α 和糖皮质水平降低,表明亚甲蓝具有抗炎镇痛作用[11]。
本研究术后6 个月时MB 组病人ODI、PHQ-9及PSQI 评分均较基线水平降低,提示亚甲蓝在改善病人疼痛症状的基础上,能够有效改善其腰椎功能,缓解病人焦虑抑郁情绪并改善睡眠。两组病人补救药物的使用情况无明显差异,但疗效评价显示MB 组有效率高于对照组(94.3%vs.78.4%)。安全性方面,术后第1 天两组病人不良反应中高血糖的发生情况比较有统计学差异,其中MB 组病人中合并糖尿病者高血糖的发生率明显比对照组低。这与其他研究结果一致,表明激素类药物确实会导致机体血糖变化,这也是激素类药物能否常规用于LFJS 治疗的主要争议点,尤其是对于糖尿病病人[3]。两组病人治疗期间及术后6 个月均未出现肝肾功能异常变化,表明亚甲蓝囊内注射神经阻滞不良反应少,更为安全。
本研究采用亚甲蓝关节囊内注射治疗关节突关节源性腰痛取得显著镇痛效果,为亚甲蓝神经阻滞镇痛提供依据,也为关节突关节源性腰痛提供新的治疗方案。最近有研究发现,除了局部阻滞,亚甲蓝静脉滴注全身运用也可起到良好的镇痛作用。Miclescu 等[20]的研究纳入10 名顽固性神经病理性疼痛病人(疼痛超过12 个月,最长达5 年),采用亚甲蓝2 mg/kg 静脉滴注,持续1 小时以上,结果显示病人疼痛评分明显降低,症状明显缓解,这为亚甲蓝静脉滴注全身运用提供了依据。但尚无文献报道此治疗方法运用于LFJS 的治疗。
本研究结果证实超声引导下亚甲蓝腰椎关节突关节囊内注射能明显改善关节突关节源性腰痛病人的疼痛症状,改善病人腰椎功能状态,提高其生活质量,且不良反应少安全性高。本研究为临床治疗LFJS 提供一种新的药物神经阻滞方案,但亚甲蓝治疗的确切机制尚待进一步研究。本研究存在一定局限性,纳入的病人来自单中心;病人治疗后仅随访6个月;本研究设计未采用双盲法。目前,腰椎关节突关节源性腰痛尚缺乏统一的治疗标准,期待制定有效、合理的诊疗方案,为临床医师提供诊疗依据。

