单源双能CT能谱成像定量参数评估T2及T3期胃腺癌的价值
王学东,刘爱连,田士峰
胃癌是起源于胃粘膜上皮的恶性肿瘤,居于我国恶性肿瘤死亡率的第二位[1]。大量研究结果表明胃癌病灶的浸润深度与临床治疗方案的选择、疗效的评估及肿瘤的复发和预后关系密切[2-3]。如今胃癌的分期和治疗更加趋于个性化,术前准确的病理分期,不仅利于选择最佳的治疗方式,同时也避免了一些不必要的扩大根治手术,提高患者的预后。据日本学者提出的T2期胃癌的概率,认为T2期胃癌属于中期胃癌,在病理角度上认为是初期的进展胃癌,是胃癌发生发展蔓延过程的一个节点,而T3期胃癌已属于进展期胃癌。部分学者[4-5]研究发现,T2期胃癌的预后生存率明显高于T3期(90.6% vs 52%)。中国临床肿瘤学推荐,T3期及以上的胃癌需要使用术前新辅助化疗,T2期胃癌不需要进行术前新辅助化疗。日本临床肿瘤学会[6]指出,通过CT将T2期胃癌误诊断为T3期的比例大约为22.8%。因能谱CT具有物质分离、单能量图像等多参数成像功能,Pan等[7]利用常规CT和能谱CT进行T分期的比较,结果也发现T1~T4各期准确率分别高出3.5%、6.9%、9.2%、8.0%,提示能谱CT成像的多定量参数能够进行胃癌分期的相关诊断。因此,本研究拟探讨双能CT能谱成像的增强定量参数鉴别T2期和T3期胃癌的价值,为术前评估胃癌的分期情况提供新方法。
材料与方法
1.研究对象
回顾性分析2017年7月-2019年8月于本院经手术病理证实为T2或T3期的胃腺癌患者的病例资料,纳入标准:①原发性胃腺癌患者,无胃肠道手术史,临床病理资料完整、详实,经术后病理证实为T2或T3期的胃癌患者;②无碘对比剂使用禁忌症,术前均行单源双能CT三期动态增强能谱扫描;③呼吸状态平稳,图像质量良好;④病灶直径大于1 cm。排除标准包括:①患者没有办法配合致使胃充盈欠佳;②术前已经进行放疗或者化疗。最终入组T2期胃癌19例,男15例,女4例,年龄51~83岁,平均66.6±8.2岁;T3期胃癌21例,男16例,女5例,年龄43~81岁,平均60.4±11.5岁。
2.检查方法
患者检查前3天禁服含重金属药物,并接受屏气指导训练,当日禁饮食,于检查前20 min饮清水800~1000 mL,使胃充盈。采用GE Revolution单源双能CT机行三期动态增强扫描,扫描范围自膈顶至肝脏下缘。扫描参数:GSI扫描模式,管电压80 kVp和140 kVp瞬时切换,管电流375 mAs,探测器宽度80 mm,螺距0.992:1,转速0.6~0.8 s/r,矩阵512×512,扫描及重组层厚和层间距均为1.25 mm,采用标准算法重建。平扫后采用欧立奇双筒高压注射器于肘正中静脉团注碘普罗胺注射液(拜耳药业,350 mg I/mL),流率4.0 mL/s,剂量1.5 mL/kg。于注药后28 s行动脉期扫描,延迟60 s行静脉期扫描,延迟120 s行平衡期扫描。
3.图像处理与数据分析
将三期增强扫描图像数据传输至ADW4.6工作站,由具一位有2年诊断经验的住院医师及一位具有10年腹部影像诊断经验的主治医师在互不知晓相关病理信息的前提下各自独立测量。分别将三期增强扫描原始数据载入能谱成像分析软件(GSI Viewer)。选择肿瘤增厚的最大层面进行ROI的勾画,ROI的大小大于病灶面积的2/3,同时避开大血管或因气-液平面交界存在伪影区等部位。于相邻3个层面各放置1个ROI后取平均值,并尽量保证各期图像的ROI大小和位置一致。测量参数包括:①三期增强单能量CT值:包括40~70 keV的单能量CT值(间隔10 keV);②IC值;③同层腹主动脉的IC值。计算各期病灶的标准化碘浓度(normalizing iodine concentration,NIC),NIC=病灶IC值/ICA值。
4.统计学分析
结 果
1.一般资料结果
19例T2期胃癌和21例T3期胃癌具体资料见表1。

表1 T2期和T3期患者一般资料 (例)
2.观察者测量结果的一致性
两位观察者测量T2和T3期胃癌各期参数结果见表2,数据的一致性均良好(ICC>0.75)。
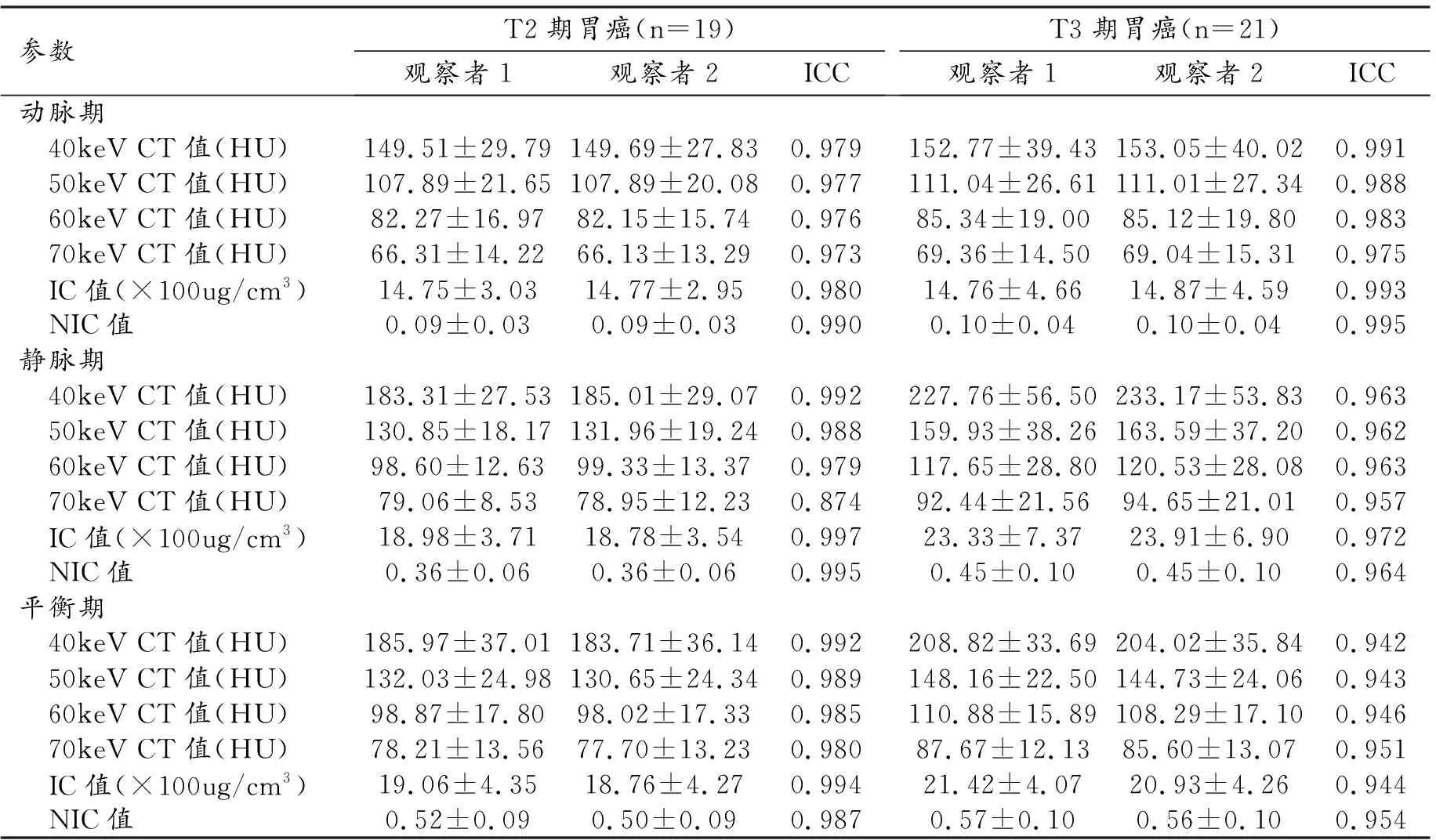
表2 两位观察者测量结果及一致性检验结果
3.各期参数值比较
T3期胃癌静脉期的40~70 keV CT 值、IC值、NIC值均高于T2期胃癌(P<0.05);动脉期和平衡期各参数值差异无统计学意义(P>0.05),见表3、图1~2。
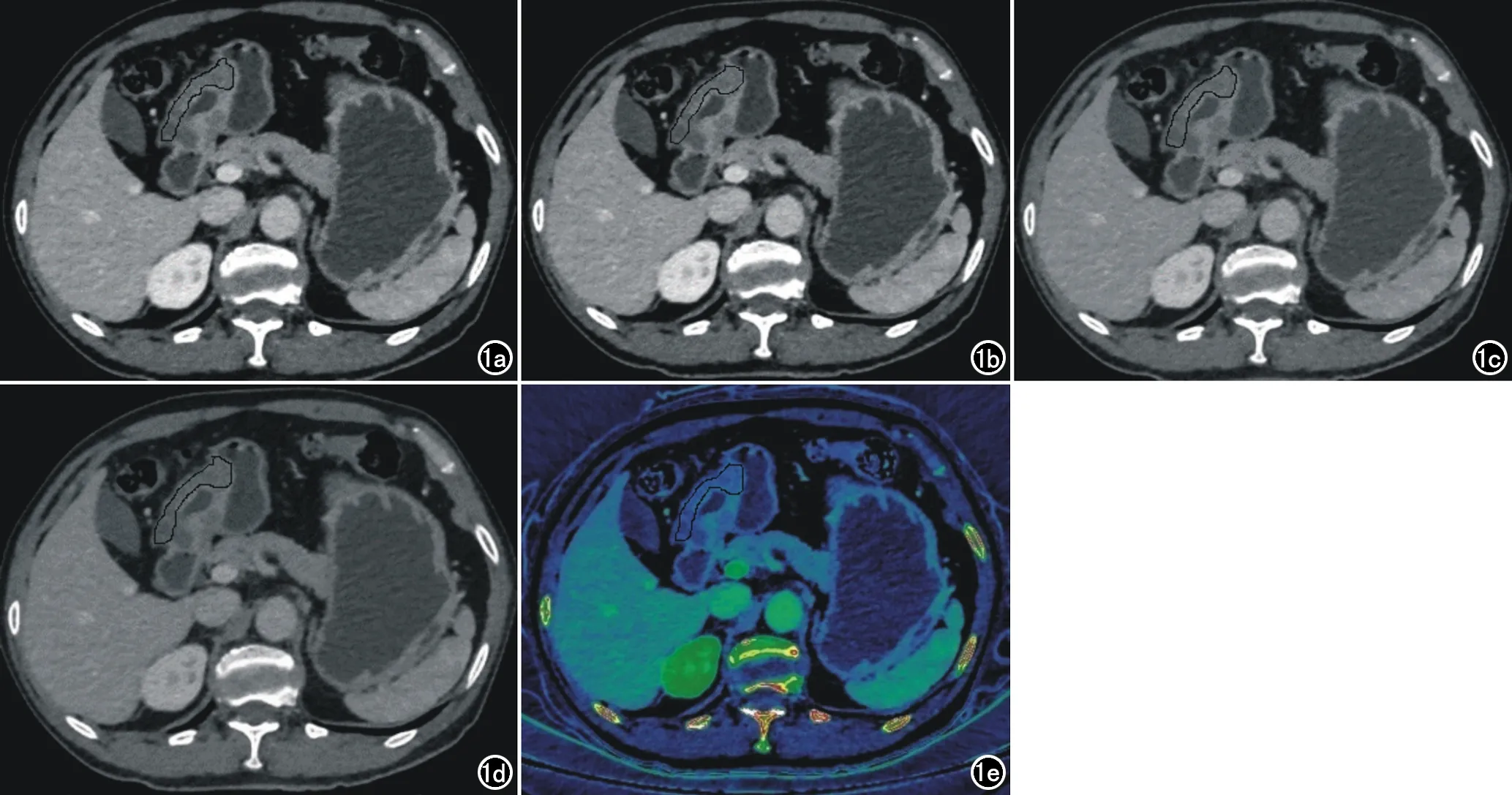
图1 男,67岁,胃腺癌T2期。a~d)分别为静脉期40、50、60、70 keV单能量图像,显示胃窦部胃壁增厚;e)为静脉期碘伪彩图,IC值为15.48×100ug/cm3,ICA值为48.71×100ug/cm3,NIC值为0.32。
4.各参数值对T2期和T3期胃癌鉴别诊断的效能评估

图2 男,61岁,胃腺癌T3期。a~d)分别为静脉期40、50、60、70keV单能量图像,显示胃窦部胃壁增厚;e)为静脉期碘伪彩图:IC值为29.86×100ug/cm3,ICA值为67.91×100ug/cm3,NIC值为0.44。
静脉期各参数鉴别T2和T3期胃癌的AUC、界值、敏感度、特异度见表3、图3,其中静脉期NIC鉴别诊断两组病灶的AUC最大(0.807),诊断T3期胃癌的敏感度和特异度分别为61.9%和89.5%;通过logistic回归,将静脉期40 keV CT值和NIC值联合诊断后AUC提高到0.822。Delong检验表明静脉期40 keV CT和NIC值的联合诊断AUC和IC值之间诊断效能差异具有统计学意义(Z=2.034,P=0.0419),余两两之间差异均无统计学意义(P>0.05)。
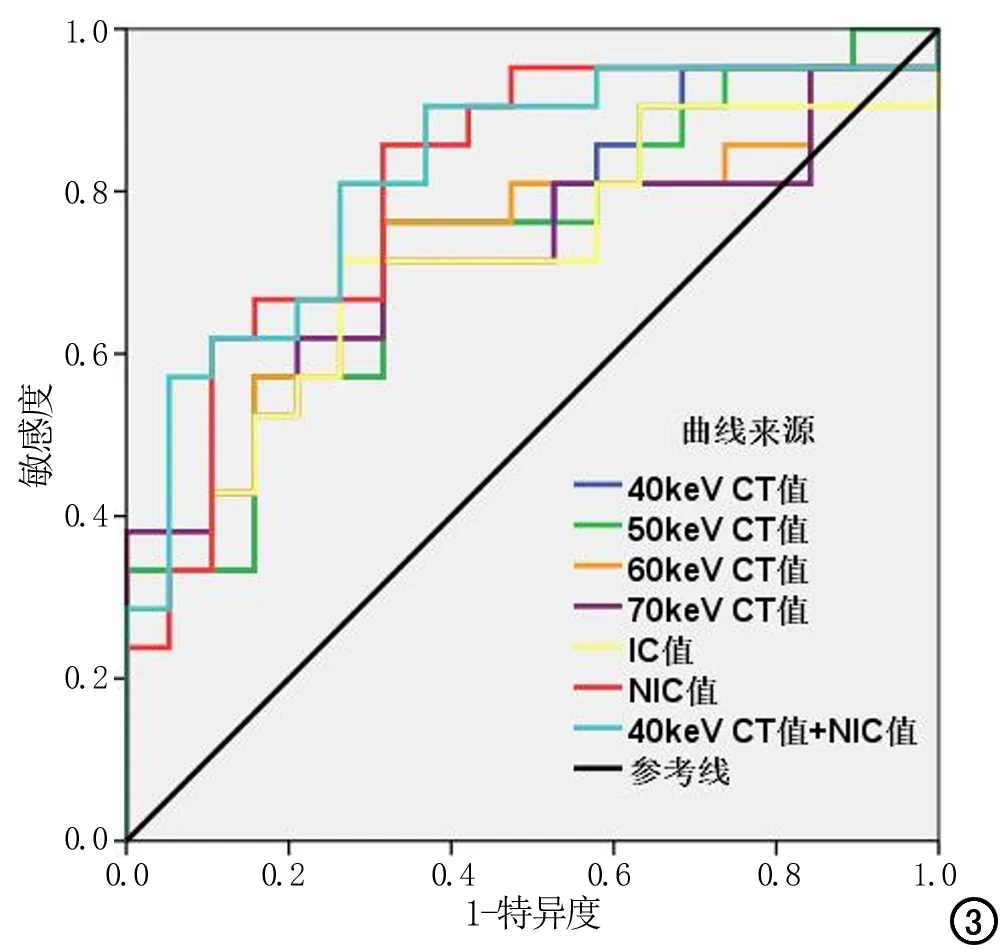
图3 静脉期40~70keV单能量CT值、IC值、NIC值诊断T3期胃癌的ROC曲线,其AUC分别为0.744、0.734、0.729、0.721、0.714、0.807,40keV单能量CT值联合NIC值诊断T3期胃癌的AUC为0.822。

表3 两组病灶间各参数值结果比较
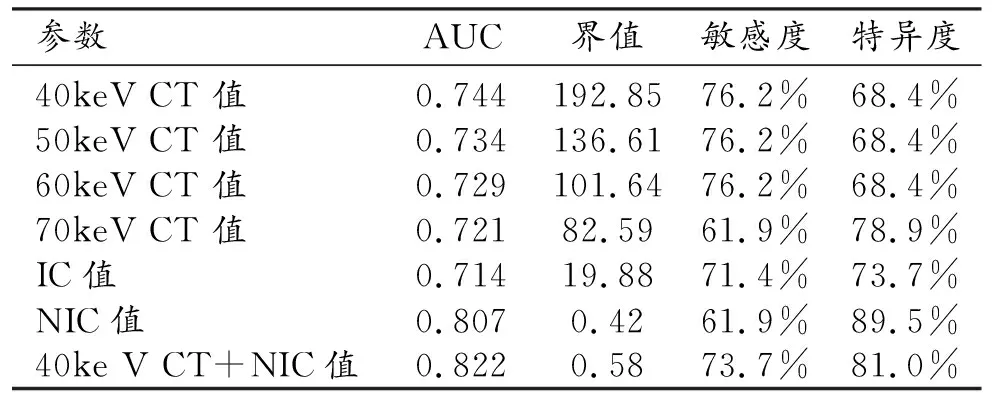
表3 静脉期各参数值的AUC、界值、敏感度、特异度
讨 论
目前,临床上对于胃疾病的检查主要包括胃镜、胃钡餐造影、CT、内镜超声和MRI。胃钡餐造影简单易行,患者无痛苦,是胃部疾病患者的首选检查方法。胃镜特别是电子胃镜由于能在直视下动态观察胃粘膜微小的病变,对胃肿瘤和非肿瘤性病变的鉴别尤其是早期胃癌的定性诊断独具优势。但是主要不足之处在于,对胃粘膜下以及浆膜外的病变往往难以发现或确认诊断,对于胃癌的分期往往敏感度较低。近年来,腔内超声在胃肿瘤的诊断特别是在T1/T2期胃癌方面显示出一定的优越性(敏感度87%),但对于进展期胃癌的分期较困难;并且腔内超声的准确性和操作者的经验有很大的关系,故目前尚难以在临床上广泛应用。MRI相关序列在胃癌的应用一直受到限制,但是随着技术的进步,可能会成为诊断胃肠道肿瘤更有效的成像技术[8]。随着CT技术的发展,特别是口服对比剂的合理应用,使CT在胃肠道肿瘤分期的应用越来越广泛。传统CT对于胃癌的诊断和分期采用高峰期增强和容积扫描技术,根据胃壁的异常强化方式,结合多平面重建图像可以来对胃癌进行分期。有学者[9]研究结果显示传统CT对于T2、T3期胃癌的诊断符合率较低。
能谱CT作为一种最新的CT技术,具有基物质成像、单能量成像等多定量参数,有望弥补常规CT的不足。单源双能CT是以瞬切双kVp为核心技术进行双能扫描:即高压发生器和球管在80 kVp和140 kVp间进行微秒级的瞬间切换,生成同源、同时、同向的“三同”能谱投影,不仅克服了患者和器官运动的影响,而且使原始数据空间的能谱分析成为可能。具有单能量成像、物质分离图像等多参数综合分析平台,较常规CT能够更好地显示形态学变化,同时也可以通过多参数成像、多定量参数来评价胃癌的分期。既往国内外学者[10-11]均利用能谱CT的多定量参数发现T3和T4a期胃癌可以进行鉴别诊断,据国内学者[12-13]等发现T1期和T2~T3期胃癌利用能谱CT可以进行鉴别,Wang等[5]学者的研究结果证实利用组学模型可以进行T2期和T3期以上胃癌的鉴别,动脉期的符合率为75.3%~84.1%,静脉期的符合率为61.6%~78.0%。但利用能谱CT成像对T2和T3期胃癌的鉴别诊断尚未见相关报道。
本研究结果显示,T3期胃癌的静脉期在40~70 keV单能量下CT值较T2期胃癌高,能量水平越低其间差异越明显,分析其原因可能是由于低能量keV成像硬化伪影较小,可以提供较好的对比噪声比,能够加大胃癌和正常胃壁的对比,便于病灶的显示;临床研究也证实,低能量图像可以显示出更微弱的对比剂强化,这正是因为病灶和背景实质之间的对比噪声比的提高,单能量图像提供了比传统复合能量CT成像更加可靠的CT值。因此本研究结果也表明鉴别T2和T3期胃癌的最大诊断效能是在40 keV单能量图像下。临床最常用的基物质成像图像是碘水图,因为碘水图可以评估碘的分布,增加组织对比和放大正常和异常组织间的微弱衰减差别。据李蕊等[14]研究结果发现,胃壁受侵的深度不同,各层的碘浓度亦不相同,与本研究的结果相一致,表明碘浓度具有判断胃癌的浸润深度的潜能。同时,为了消除不同个体之间注入对比剂的总剂量、个体循环差异、病灶累及范围等因素的影响,本研究以病灶相同层面腹主动脉的碘浓度值作为参考,获得了NIC,结果表明NIC的AUC均高于IC。T3期胃癌和T2期胃癌可以在静脉期进行鉴别诊断,分析其原因,可能是由于动脉期的NIC主要反映毛细血管密度和血供情况,静脉期的NIC主要反映血管内和血管外血供的流动和对比剂的滞留情况,说明胃癌在增强扫描时静脉期强化更为明显[25],与本文的研究结果一致。病理基础可能是由于胃癌的肿瘤细胞主要是腺体的异型增生。虽然肿瘤细胞是以动脉供血为主,但是肿瘤细胞结构往往比较紊乱,毛细血管网也非常复杂,局部血流较正常组织缓慢,对比剂通过的时间也会较长,所以动脉期强化不明显,而静脉期时对比剂已经大量进入,此时强化较明显。与Wang等[5]学者利用组学模型得出的结果不太一致,分析原因可能是:病例数、研究方法和仪器的不同,同时本研究病例数较少,统计结果不具有代表性,因此需要大样本进一步证实。同时联合静脉期的40 keV单能量CT值和NIC值可以进一步提高诊断效能和敏感度。
T3期胃癌的静脉期40~70 keV单能量的CT值、IC值、NIC值均高于T2期胃癌,静脉期最佳单能量CT值和NIC联合可以获得更高的诊断效能,提示能谱CT成像多定量参数可以进行术前的精确分期,具有一定临床应用价值。

